
2021-09-28 15:27:26來源:同寫意瀏覽量:1080
導讀:科學的監管離不開統計學。
統計學為循證醫學證據的萃取做出了重要貢獻,沒有統計學參與,臨床治療可能還停留于望、聞、問、切形而之下的經驗醫學模式。
生物統計人員不僅要有良好的統計學基礎和一定的醫學知識,還要有良好的科研素質,和臨床醫師共同營造“數據證據+醫師經驗+患者配合”三位一體的循證醫學模式。
——夏結來
01
科學的監管離不開統計學
1、統計學是監管的重要工具
不管是藥物研發,還是監管體系的打造,統計學都非常重要。科學的監管離不開統計學。藥物研發的監管是依法依規的,上位法是《藥品管理法》,指導原則是依法制定的規矩,遵循指導原則就是按照規矩辦事。
以臨床價值為導向的腫瘤藥物研發會脫離實際嗎?當然不會,相反會促進創新。創新就一定是firstinclass嗎?這樣理解是錯誤的。
舉例來講,如果能研制出28納米的芯片,就不會被國外“卡脖子”。雖然研制28納米的芯片不算創新,只是MeToo,但把仿制藥品做到全世界頂尖,也是國家實力的體現。所以應該強調腳踏實地的創新,采用科學的方法來監管藥物研發全過程。
統計學是監管的一個重要工具,用于保證上市藥物或器械的有效性和安全性。從關鍵質量參數,到臨床前的動物實驗;從早期臨床試驗,到II、III期試驗再到藥物上市,整個過程都離不開統計學。如果統計學“缺席”,藥物研發進程大概率會滯后,還會在黑夜里摸索很多年,統計的重要性不言而喻。
統計學是藥物研發中的重要環節。為什么需要統計學?醫學研究的對象是隨機現象,需要統計學來分析處理。統計學是醫學交流的一種語言,能使研究者透過現象看清本質,從數據變化中尋找規律。所以,研究的各個階段都離不開統計學的支撐。
2、統計學是安全性和有效性的保證
藥品或醫療器械的安全性和有效性必須經過臨床實驗的安全驗證。為了保障人民的健康,我國以主權的形式,對藥物上市進行強制監管。ICH組織和多個國家都分別制定了一系列臨床研究指導原則和規范。
“在整個臨床研究的過程中,對安全性和有效性的驗證,都要用到統計學。而臨床研究的拓撲關系中,涉及到主要研究者、監管機構、統計方、數據管理方、申辦方、受試者、臨床監查方,在這復雜的關系中最不能忽視的就是受試者,沒有受試者,又何談臨床研究?”
在沙特、東南亞等多個國家有四五萬名受試者參加新冠疫苗的臨床研究。沒有受試者的奉獻精神,很多藥是研發不出來的,藥物的成功研發和受試者有很大的關系,特別是腫瘤藥物。有句話叫“一藥功成萬骨枯”,受試者承受了莫大的期望與失望,許多參與試驗的腫瘤患者不幸離世,經治療成功存活的是少數。應向那些離去的志哀,應向他們表達謝意。
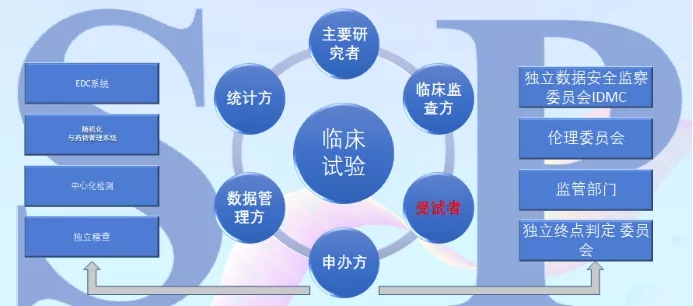
臨床拓撲關系圖
我國監管機構要求臨床試驗成立獨立的數據安全監查委員會(DSMB),例如新冠疫苗的臨床試驗中都成立了DSMB,我參與了其中的大部分。美國FDA有龐大的生物統計學審評隊伍,基本都是統計學博士,CDER有260名左右,CBER有60名左右,CDRH有100名左右。
歐盟、日本、韓國、我國的臺灣省等監管部門也都有大量的生物統計審評專家。歐美有龐大的生物統計監管體系,與之相比我國的統計審評隊伍還在發展階段。目前CDE、CMDE也配備了生物統計學審評專家,隊伍在逐步發展,審評水平也在逐步提高,希望最終能建立起與歐美國家水平相當的監管隊伍以適應我國藥物或器械創新研發的需求。
02
研究方案設計需要統計學
1、監管的科學性
監管的作用如何體現呢?所謂科學監管就是讓假藥或劣藥的比例控制在可接受的范圍內。我國目前的標準是最多能容忍100個上市藥物中有2.5個假/劣藥。美國對常規藥物,比如內分泌治療藥物、心血管治療藥物要求假/劣藥的比例控制在萬分之6.25以內,即1萬個上市藥物里,最多有6.25個假/劣藥。這是因為美國的常規藥要求兩個臨床研究相互支撐。
但去年美國FDA批準上市的治療老年癡呆的藥物,兩個試驗中有一個臨床終點并沒有達標,是通過臨床藥理學一系列模型擬合“操作”后批準上市了,也許是出于未被滿足的醫學需求的考慮吧。最近FDA把該藥的適應癥縮窄到輕型老年癡呆,不再適用于所有類型老年癡呆病人。由此外界對該藥的獲批也產生了質疑,前兩天美國藥監局局長,懇請美國檢察長前來調查該藥在審評審批過程FDA是否存在不當行為。
“監管的目的,就是把市場上的假/劣藥控制在一個可接受的范圍內。如果監管不力,就會有大量的假藥/劣藥在市場上流通的可能,在現行醫療體制下靠市場淘汰假/劣藥還是十分困難的。”
監管要求假陽性率(falsepositiverate)、假陰性率(falsenegativerate)處于較低的水平。目前我國的藥物審批采取了終身責任制,一旦批了假藥,后期被查出,審批人員要擔責,這就是審批風險。雖然審批風險使得審評專家在審評審批時心生敬畏,但事實上無論監管多嚴格都不能完全避免假陽性。
假陽性是消費者風險,也叫患者風險、審批風險。法規層面解釋:如果一個確證性試驗在單側α=0.025水平得出某干預是有效的即被批準上市,這個藥實際無效的風險最高為2.5%。統計規律是不可逾越的,如果非要把那個碰到了2.5%的倒霉蛋抓起來坐牢那也太武斷了。所以要科學的監管。
2、偏倚來源和醫學比較類型
臨床研究過程中常存在三種偏倚來源(偏倚:研究結果與真實結果的差異):選擇性偏倚、信息偏倚、混雜偏倚。要通過科學的統計設計來盡可能的減小偏倚對結果的影響,如采用隨機分組、設置合理的對照、盲法等。
試驗設計方法在不斷的發展,設計越來越彈性化。從最開始傳統的試驗設計方法到成組序貫設計,再到適應性設計。國家也出臺多項指導原則,以期縮短研究時間,著力于創新。
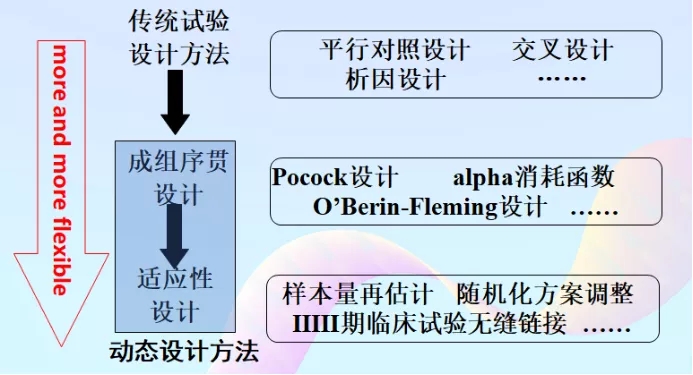
試驗設計方法的發展
現在強調以臨床價值為導向,試驗過程中盡可能采用盲法,盡可能依從方案。但并不排斥安慰劑對照的臨床試驗。FIC腫瘤藥物的臨床研究往往應從末線做起,沒有陽性對照,只能采用安慰劑對照。當然不可能直接就拿一線治療藥物做對照。以臨床價值為導向的指導原則沒有任何問題,但市場反應很大,這就暴露出了許多偽創新的存在不是“空穴來風”。
“在創新的大環境下,仿制藥廠步履維艱,勉強活下來的也有可能要偷工減料,這個一定要提前預防。畢竟當下創新藥物還難以擔起治病救人的大任,沒有了高質量的仿制藥,如果進口藥“斷供”,我們拿什么治病救人?”
臨床研究以臨床價值為導向,一般是優效(Superiority,單側檢驗)、等效(Equivalence,雙單側檢驗)和非劣效(Non-inferiority,單側檢驗)。侖伐替尼沒有做優于索拉非尼的設計,選擇跟索拉非尼共生,做了非劣效設計,上限設為1.08,結果侖伐替尼成功“上岸”,那個非要做優效于索拉非尼的藥物卻“隕落”了。
03
結語
上醫治未病,如預防性疫苗;中醫治欲病,如早診早治;下醫才治已病,但晚期的腫瘤患者挽救的希望微乎其微了。應重視統計學在臨床研究中的應用,助力藥物臨床試驗,持續國家數據建設,有效利用臨床大數據,為“健康2030”做貢獻。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!