
2021-08-10 14:35:30來源:藥智網瀏覽量:376
導讀:深剖CD7 CAR-T療法研究技術!
8月6日,博生吉自主研發的自體CD7 CAR-T細胞注射液(PA3-17注射液)的臨床試驗申請獲默示許可,適應癥為成人復發/難治性CD7陽性血液淋巴系統惡性腫瘤(r/r T-ALL)。
T-ALL是一種侵襲性的血液系統惡性腫瘤,占成人ALL病例的20%。目前,對于T-ALL的治療,同種異體干細胞移植(SCT)僅推薦用于首次復發但可能再次誘導達到完全緩解狀態的患者,r/r T-ALL預后較差,缺少有效的治療方案。盡管FDA批準了奈拉濱用于治療至少兩種方案無效或復發的T-ALL,但奈拉濱尚未在我國上市,且CR率不足30%。CD7作為T細胞表面的特異性靶點,CD7 CAR-T有望為r/r T-ALL患者提供新的治療路徑。
01
CD7和CD7 CAR-T
CD7是T細胞表面的高特異性靶點,與大多數T細胞血液腫瘤的發生和發展息息相關,包括幼稚T細胞腫瘤(T-ALL/LBL/NKT細胞白血病)和成熟T細胞腫瘤(外周T細胞淋巴瘤、NKT細胞淋巴瘤、間變大細胞淋巴瘤)。
作為跨膜蛋白,CD7和抗體或者抗體衍生物結合后會迅速內化,這使得針對CD7分子的抗體非常適合作用藥物運輸工具。目前,針對CD7的開發主要集中于CAR-T療法,但是,與靶向B細胞表面膜受體的CAR-T細胞療法不同,靶向CD7的CAR-T療法存在“自相殘殺”的風險。
自相殘殺的風險:與表達CD7的T細胞相同,CAR-T細胞也是一種T細胞,在細胞膜表面同樣表達CD7,這一特征導致免疫細胞和腫瘤細胞擁有相同的靶點。因此,CD7 CAR-T不僅會殺滅CD7高表達的腫瘤細胞,亦會“誤殺”同樣表達CD7的CAR-T伙伴,最終導致CAR-T細胞被快速清除。值得注意的是,這個問題并不會發生在CAR-T回輸入患者體內階段,在CD7 CAR-T體外培養階段,便已出現“自相殘殺”的問題,最終導致CAR-T細胞的數量大幅降低。
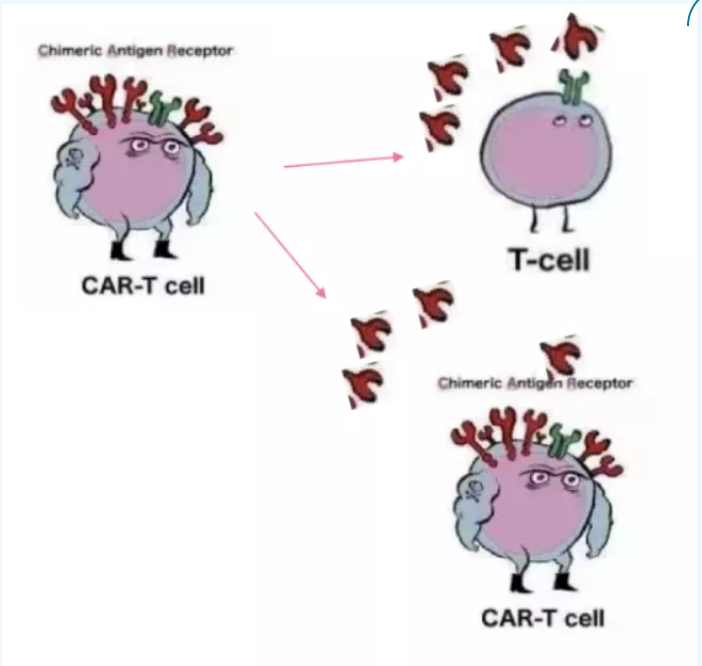
圖:“自相殘殺”示意圖
針對這一問題,普遍的做法是通過基因編輯敲除CAR-T細胞表面的CD7和TCR,即制備不表達CD7的CAR-T細胞。如此,由于CAR-T細胞不表達CD7,因此不會發生“內訌”,進而齊心協力清除腫瘤細胞。
但是,敲除CD7后的CD7 CAR-T并非“無懈可擊”,繼發性免疫缺陷仍可能是潛在的問題。眾所周知,CAR-T細胞憑借超強的清除作用,在腫瘤治療中療效十分顯著。過去,CAR-T細胞療法更多用于B細胞表面的靶點,如CD19、BCMA等,盡管接受CAR-T細胞治療的患者常出現B細胞缺陷,但可通過持續輸注丙球蛋白補充B細胞。但以T細胞為靶細胞的CAR-T療法,大量清除T細胞后可能使患者出現嚴重的免疫缺陷,因此有科學家擔心可能使患者出現類似艾滋病的問題,即由于免疫缺陷導致的感染。
對于這一問題,CD7陰性的T細胞或許可緩解免疫缺陷的問題。有研究表明,CD7陰性的T細胞同樣具有一定的免疫功能,在一定程度上彌補CD7陽性T細胞缺失造成的免疫缺陷。但是,考慮到CD7陰性T細胞數量較少,僅占T細胞總數的10%左右,究竟能發揮多大的免疫作用仍需要進一步研究。
02
CD7 CAR-T細胞臨床進展
目前布局CD7 CAR-T的企業并不多,國內主要為亙喜生物和博生吉。
(1)亙喜生物的GC027是基于TruUCAR平臺的一款靶向CD7的異體CAR-T候選產品,由無需人類白細胞抗原(HLA)匹配的健康供者T細胞制備,適應癥包括CD7陽性T細胞急性淋巴細胞白血病(T-ALL)等,目前處于臨床Ⅰ期。與培養周期較長、無法量產的自體CAR-T細胞相比,異體CAR-T細胞能夠在患者需要治療時馬上使用,避免患者錯過最佳治療時機。
TruUCAR是亙喜生物的通用型CAR-T平臺。通過敲除TCR,TruUCAR可誘導患者產生長期免疫抑制,促使通用型CAR-T細胞在體內擴增并殺死腫瘤細胞,無需使用CD52單抗聯合化療清除人體淋巴細胞以規避移植物抗宿主病(GvHD)。
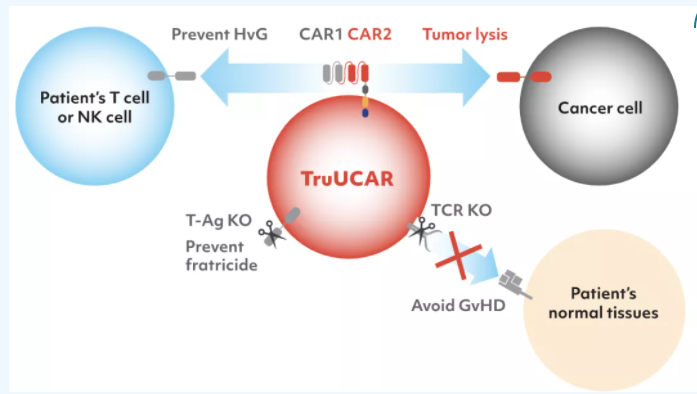
TruUCAR平臺
數據來源:亙喜生物
針對CD7 CAR-T可能引發的“自相殘殺”問題,亙喜生物通過納米技術及內質網技術,將CD7引入CAR-T細胞內,使細胞表面不表達CD7,避免了CAR-T細胞間的相互干擾。針對異體GvHD問題,通過運用CRISPR/Cas9技術干擾TRAC位點,清除細胞表面的TCR,規避GvHD風險。
在2021年AACR上,亙喜生物公布了GC027的Ⅰ期臨床數據。截至2021年2月4日,試驗納入6名T-ALL受試者,ORR達100%,MRD-CR達83%(5/6)。在接受治療6個月后,5名患者中的3名仍然保持MRD-CR狀態(60%)。安全性方面,所有患者均出現不同程度的細胞因子釋放綜合癥,但未觀察到神經毒性事件(ICANS)或移植物抗宿主病(GvHD)的發生。
總的來說,GC027治療T-ALL表現出良好的療效,且安全性可以控制,未發生GvHD和ICANS是藥物亮點,但仍需更長期的追蹤以觀察藥物的長期療效和安全性。
(2)博生吉深耕于CD7靶點,自2012年便開始研制CD7單域抗體,先后開展了CD7免疫毒素和CD7-CAR-NK的研發,并最終研制成功國際上首個First-in-class潛力的自體CD7 CAR-T細胞。目前,公司的研發管線涵蓋自體和異體CD7 CAR-T細胞產品,均已申報臨床。
PA3-17是公司自主研發的基于納米抗體的自體CD7 CAR-T產品,5月17日臨床試驗申請獲NMPA受理,8月6日獲NMPA默示許可。與通用型CAR-T細胞療法相比,PA3-17無需通過基因編輯敲除TCR,避免了基因編輯的相關風險。此外,PA3-17在體內呈現優越的擴增和持續性,因此療效和安全性有望提升。
在2020年EHA會議上,張明智教授公布了PA3-17的臨床前研究結果和Ⅰ期早期臨床試驗結果。試驗納入3名T-ALL患者,結果顯示ORR達100%,其中CR達66.6%(2/3),PR達33.3%(1/3),三名患者均未出現神經毒性,CRS分別為1名2級,2名1級。總的來說,PA3-17臨床療效顯著,且安全性較好。
除了自體CD7 CAR-T細胞注射液外,公司亦布局了異體CD7 CAR-T細胞療法。5月27日,公司的異體CD7 CAR-T細胞注射液的臨床申請獲NMPA受理,有望于近期獲默示許可。公司的異體CD7 CAR-T細胞采用高度優化的全自動制備工藝,成本顯著降低。
03
小結
目前,r/r T-ALL患者的選擇較少,預后較差。CD7 CAR-T憑借優異的療效和安全性數據,有望為r/r T-ALL患者提供更佳的治療選擇。當然,并非所有淋巴瘤患者均適用CD7 CAR-T療法,患者首先須通過骨髓流式報告或病例免疫組化報告確定CD7的表達,通常70%以上的表達才建議使用。
此外,無論亙喜生物或博生吉的CD7 CAR-T療法,目前均處于Ⅰ期臨床,受試者較少,未來尚需更多的數據以支撐其療效和安全性。衷心希望CD7 CAR-T療法順利進展,早日開花結果。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!