
2021-07-14 14:51:42來源:藥智網瀏覽量:480
導讀:肺癌治療進入精準時代!多款靶向藥跑步進入市場
肺癌疾病概述
(1)肺癌定義
原發性支氣管肺癌,簡稱肺癌,是起源于氣管、支氣管黏膜或腺體,是最常見的肺部原發性惡性腫瘤。早起肺癌分型以病理組織學為主,肺癌大致能夠分為非小細胞肺癌〔nonsmallcelllungcancer,NSCLC〕和小細胞肺癌〔smallcelllungcancer,SCLC〕兩大類,其中非小細胞肺癌約占80%~85%,其余為小細胞肺癌,非小細胞肺癌主要包括兩個亞型,腺癌和鱗癌。肺癌無傳染性,但具有一定的家族聚集性和遺傳易感性;從基因分型來看,常見基因分型包括EGFR突變、ALK突變、ROS1突變、BRAF突變等。
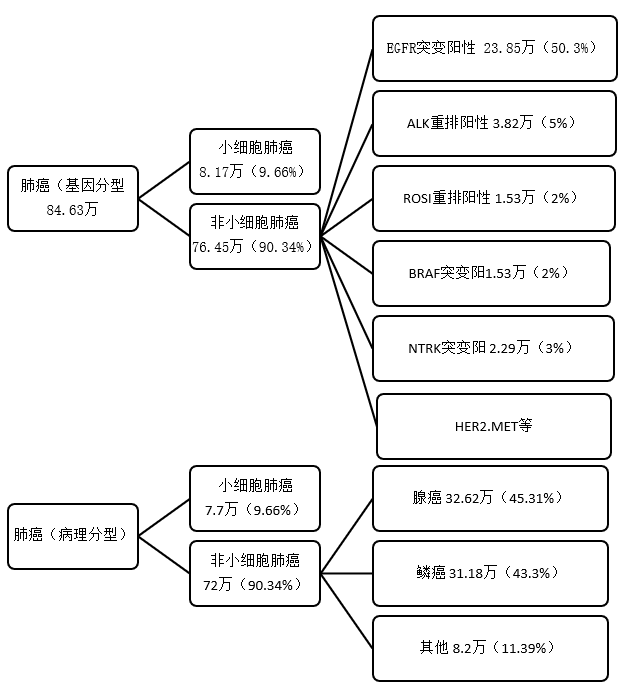
圖1 肺癌病理組織學分型和驅動基因分型
中國與歐美在肺癌驅動基因圖譜上存在明顯差異。在中國,EGFR突變占比50.3%,KRAS突變與ALK突變分別占比6.7%、4.3%;而相比之下,歐美KRAS占比較大(25.0%)、EGFR突變占比較小(EGFR sensitizing與EGFR other合計29.0%)、ALK突變略高(7.0%)。EGFR突變率在亞洲肺癌患者中顯著高于歐美人種,因此EGFR-TKI被稱為上帝送給亞洲人的“禮物”。
(2)致病原因與臨床癥狀
肺癌的病因至今未完全明確,致病因素主要包括吸煙、職業暴露、空氣污染、電離輻射、飲食、遺傳、肺部病史等。
肺癌的臨床表現具有多樣性但缺乏特異性,因此常導致肺癌診斷的延誤。周圍型肺癌通常不表現出任何癥狀,常是在健康查體或因其他疾病行胸部影像學檢查時發現的。肺癌的臨床表現能夠歸納為:原發腫瘤本身局部生長引起的癥狀,原發腫瘤侵犯鄰近器官、結構引起的癥狀,腫瘤遠處轉移引起的癥狀以及肺癌的肺外表現〔瘤旁綜合征、副腫瘤綜合征〕等。
(3)疾病分類與分期
根據臨床疾病進展,對肺癌患者病情狀況進行分期:小細胞肺癌劃分為局限期和廣泛期兩個主要階段;非小細胞肺癌分為ⅠⅡⅢⅣ期,其中Ⅰ期屬于早期,指腫瘤位于肺組織中,尚未發生轉移。Ⅱ期屬于中期,指癌細胞已經轉移到了肺門附近的淋巴結。Ⅲ期屬于中晚期,指癌細胞已經進一步轉移到縱隔或肺外淋巴結。Ⅳ期屬于晚期,指腫瘤出現胸膜轉移、胸腔積液或全身多處轉移,如肝、腦、骨等。
疾病流行病學研究
大量流行病學研究證實,吸煙是肺癌的最大風險因素,煙草中有50多種物質會引起癌癥,70%~80%的肺癌與吸煙(包括被動吸煙)相關,隨著年齡的增長,患肺癌的概率就會增大,被診斷為肺癌患者有一半年齡在70歲以上,另外,有癌癥病史者、與致癌劑(氡、砷、煤煙、二氧化硅等)長期接觸者、其他肺部疾病患者(如COPD、肺纖維化)患肺癌的風險也會增大。
根據CA
Cancer J
Clin,2018年全球有大約1810萬癌癥新發病例和960萬癌癥死亡病,肺癌依舊是發病比例(11.6%)和死亡比例(18.4%)第一位的腫瘤,新發病例209.4萬,死亡病例176.1萬。分地區看,亞洲肺癌新發病例(48.4%)和死亡病例(57.3%)在全球的比重最高,其中中國占比最高。
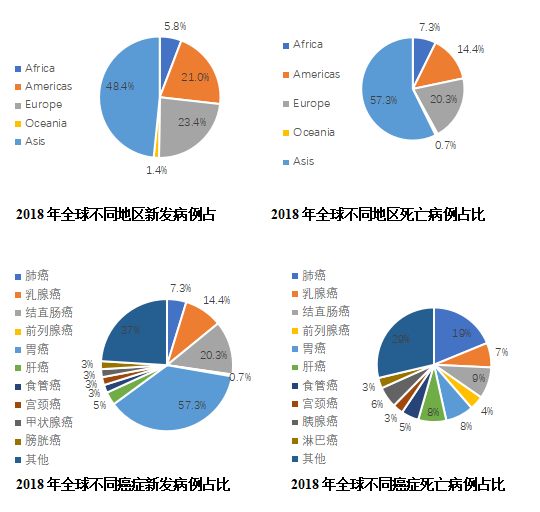
圖2 2018年全球癌癥流行病學餅圖
根據國際癌癥研究機構2018年分析報告,肺癌的發病率為22.48/10萬(每年新增患者209.4萬),死亡率為18.51/10萬(每年新增死亡人數176.1萬)發病率和死亡率均居首位。
根據美國癌癥中心網站數據,美國肺癌發病率為60.5/10萬,死亡率為41.9/10萬,發病率排第二,死亡率均居首。
根據中國癌癥統計數據,中國肺癌發病率為57.13/10萬,死亡率為45.8/10萬,二者均居所有癌癥首位。
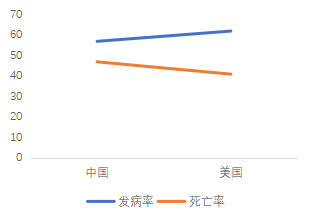
圖3 中美肺癌發病率與死亡率對比(例/10萬)
國內肺癌的5年生存率偏低。根據2018年發表在柳葉刀數據顯示,2010-2014年,日本肺癌5年生存率最高達32.9%,美國肺癌5年生存率為21.2%,中國為19.8%(略高于胰腺癌、肝癌),盡管與德國、法國、英國等歐洲國家相比中國肺癌生存率略高,但與日本、美國相比偏低,對比其他癌種的生存率也存在顯著差異。

圖4 2000-2014年中、美、德、法、英肺癌五年生存率(%)
疾病治療分析
3.1肺癌的診斷與治療
(1)肺癌的篩查與診斷
高危人群的篩查,在高危人群中開展肺癌篩查有益于早期發現早期肺癌,提高治愈率。低劑量螺旋CT low dose computedtomography LDCT)對發現早期肺癌的敏感度是常規X線胸片的4~10倍,可以早期檢出早期周圍型肺癌。國際早期肺癌行動計劃數據顯示,LDCT年度篩查能發現 85% 的期周圍型肺癌,術后10年預期生存率達92%。
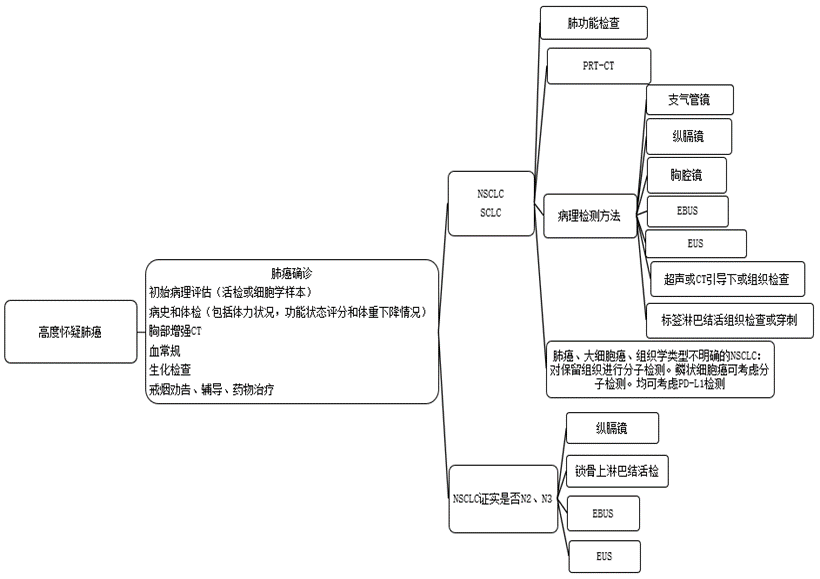
圖5 肺癌活組織檢查流程圖
1)影像學檢查
胸部X線:可了解肺癌的部位、大小對鄰近部位的侵犯性、伴發的炎性病變等,是早期發現肺癌的一個重要手段。"S形倒影”(或稱“反S征”)是診斷肺癌的典型征象。
計算機斷層成像(CT):胸部CT可進一步驗證病變所在的部位、范圍,也可大致區分良惡性,是目前診斷肺癌的重要手段。
磁共振成像(MRI) 、B超、發射型計算機斷層成像(ECT) 、正電子發射計算機斷層顯像(PET-CT) 等,特別適用于判斷肺癌顱腦、淋巴結、骨等組織的轉移。
內鏡檢查可直接觀察病變情況,并獲取病變部位的組織或細胞,便于進行病理診斷。
支氣管鏡是診斷肺癌的主要方法之一,可直接觀察到支氣管內的病變情況,主要適用于中央型肺癌,必要時可行超聲引導下的縱隔淋巴結活檢(EBUS) ,明確病理診斷。
縱隔鏡是目前臨床評價肺癌縱隔淋巴結狀態的金標準,主要用于伴有縱隔淋巴結轉移,不適合手術治療,又不能通過其他方法進行病理診斷的病例。
胸腔鏡在胸腔鏡下對肺部微小病變、可疑淋巴結、胸膜、心包等組織進行病灶切除送檢等,可對肺癌進行準確診斷和臨床分期,適用于經支氣管鏡檢查和經皮肺內病灶穿刺活檢無法取得病理標本或合并胸膜病變的診斷。
2)病理學檢查
細胞學檢查:對內鏡檢查、細針穿剌、胸腔積液、痰液獲得的細胞,進行細胞學檢查,可以進行初步診斷。
組織學檢查:對肺活體組織進行檢查,是確診肺癌的金標準。
基因檢查:對腫瘤組織進行基因檢查,如EGFR基因突變、ALK與ROS1基因融合檢測等,有利于個體化的靶向治療。
實驗室檢查:血常規、肝腎功能及其他必要的生化免疫檢測、出凝血功能檢測等,便于術前、術后對患者的整體狀況進行評估。
腫瘤標志物如癌胚抗原(CEA) 、神經特異性烯醇酶(NSE)、細胞角蛋白19片段抗原(CYFRA21-1) 、胃泌素釋放肽前體(ProGRP) 、鱗狀細胞癌抗原(SCC-Ag) 等聯合檢查,對肺癌的診斷具有一定的參考價值。
(2)肺癌的治療

圖6 肺癌國內外治療指南總覽
肺癌的治療應當采取多學科綜合治療〔multipledisciplinaryteam
,MDT〕與個體化治療相結合的原那么,即依照患者的機體狀況、腫瘤的病理組織學類型和分子分型、侵及范圍和進展趨向采取多學科綜合治療的模式,有計劃、合理地應用手術、放療、化療、分子靶向治療和免疫治療等手段,以期達到最大程度地延長患者的生存時間、提高生存率、操縱腫瘤進展和改善患者的生活質量。
1)外科治療
解剖性肺切除術是早中期肺癌的要緊治療手段,也是目前臨床治愈肺癌的重要方法。肺癌手術分為完全性切除、不完全性切除和不確定性切除。應力爭完全性切除,以期達到完整地切除腫瘤,減少腫瘤轉移和復發,同時進行精準的病理TNM分期,力爭分子病理分型,指導術后綜合治療。
2)放射治療
肺癌放療包括根治性放療、姑息放療、輔助放療和預防性放療等。
表1 肺癌放射治療

3)藥物治療
肺癌的藥物治療包括化療、分子靶向治療以及免疫治療。化療分為新輔助化療、輔助化療、姑息化療,應當嚴格掌握臨床適應證,并在腫瘤內科醫師的指導下施行。
肺癌的藥物治療包括化療、分子靶向治療以及免疫治療。化療分為新輔助化療、輔助化療、姑息化療,應當嚴格掌握臨床適應證,并在腫瘤內科醫師的指導下施行。化療應當充分考慮患者病期、體力狀況、不良反應、生活質量及患者意愿,幸免治療過度或治療不足。應當及時評估化療療效,緊密監測及防治不良反應,并酌情調整藥物和〔或〕劑量。分子靶向治療需要明確基因突變狀態,依據分子分型指導靶向治療。近年,以免疫檢查點抑制劑〔如PD-1
單抗或PD-L1單抗等〕為代表的免疫治療取得了可喜的進展。基于免疫檢查點抑制劑已被證實的生存獲益,同時基于在中國人群中被證實的顯著生存獲益,國內首個PD-1
抑制劑納武利尤單抗〔Nivolumab 〕等獲批上市用于驅動基因陰性的晚期NSCLC患者。
晚期NSCLC的藥物治療
一線藥物治療:含鉑兩藥方案是標準的一線化療方案,在化療基礎上能夠聯合血管內皮抑素;關于晚期無驅動基因、非鱗NSCLC患者,還可在化療基礎上聯合貝伐珠單抗;肺癌驅動基因陽性的患者,如EGFR基因突變〔包括19外顯子缺失、21 外顯子L858R和L861Q、18 外顯子G719X、以及20 外顯子S768I 〕陽性的患者, 可選擇表皮生長因子受體酪氨酸激酶抑制劑〔EGFR-TKI〕治療,包括吉非替尼、厄羅替尼、埃克替尼或阿法替尼治療,一線給予吉非替尼治療時還可考慮聯合培美曲塞和卡鉑。ALK或ROS1融合基因陽性的非小細胞肺癌患者,可選擇克唑替尼治療。目前可選用的治療藥物詳見表2、表3。
表2 非小細胞肺癌常用的一線化療方案
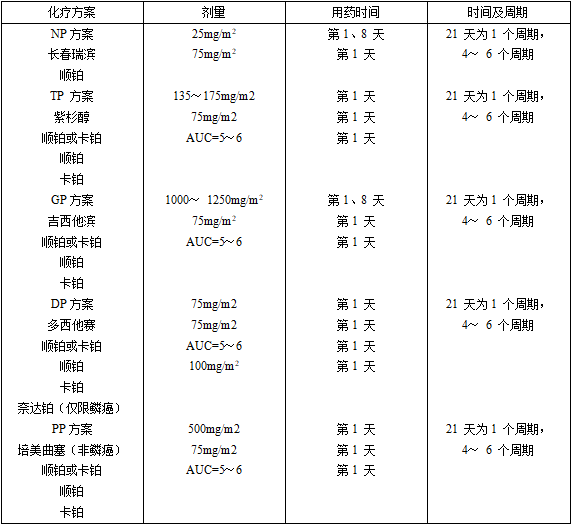
表3 非小細胞肺癌常用的抗血管新生藥物和靶向治療藥物
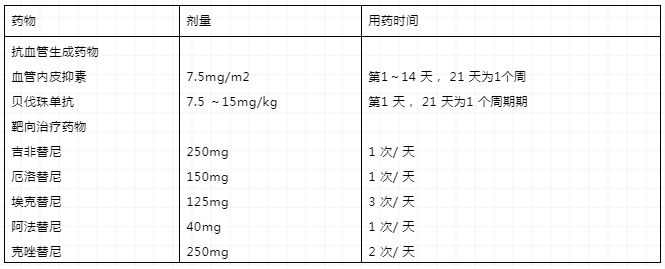
對一線治療達到疾病操縱〔完全緩解、部分緩解和穩定〕的患者,可選擇維持治療。目前同藥維持治療有循證醫學證據支持的藥物有培美曲塞〔非鱗癌〕、貝伐珠單抗〔非鱗癌〕和吉西他濱;有循證醫學證據支持的換藥維持治療的藥物有培美曲塞〔非鱗癌〕,關于EGFR基因敏感突變患者能夠選擇EGFR-TKI進行維持治療。
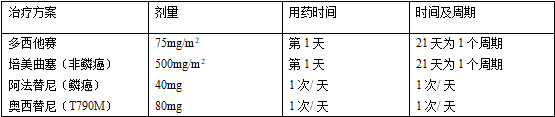
二線藥物治療:二線治療可選擇的藥物包括多西紫杉醇、培美曲塞、Nivolumab
、EGFR-TKI
和克唑替尼。肺癌驅動基因突變陽性的患者,假如一線和維持治療時沒有應用相應的分子靶向藥物,二線治療時應優先應用分子靶向藥物;一線EGFR-TKIs
治療后耐藥同時EGFRT790M突變陽性的患者,二線治療時應優先使用奧希替尼。關于ALK陽性,一線同意克唑替尼治療后出現耐藥的患者,二線治療時可序貫使用塞瑞替尼。關于一線同意EGFR-TKI
或者克唑替尼治療出現耐藥,
二線同意化療治療的患者,可依照患者的ECOGPS評分選擇含鉑雙藥或者單藥治療方案。關于驅動基因陰性的患者,應優先考慮化療,關于無驅動基因且組織學類型為鱗狀細胞癌的患者,可選擇使用阿法替尼。
關于含鉑兩藥聯合化療/ 靶向治療失敗后的NSCLC患者可選擇PD-1 抑制劑Nivolumab 。
三線藥物治療:可選擇參加臨床試驗,三線治療也可選擇VEGFR-TKI單藥口服。目前VEGFR-TKI三線治療有循證醫學證據支持的藥物有安羅替尼。
表4 非小細胞肺癌常見的二線治療方案
不能手術切除的NSCLC的藥物治療,推舉放療、化療聯合,依照具體情況可選擇同步或序貫放化療。同步治療推舉化療藥物為依托泊苷聯合順鉑〔EP〕或卡鉑〔EC〕、培美曲塞聯合順鉑或卡鉑、紫杉醇或多西紫杉醇聯合鉑類。序貫治療化療藥物為順鉑+依托泊苷,順鉑+紫杉醇,順鉑+多西他賽,順鉑或卡鉑+培美曲塞〔非鱗非小細胞肺癌〕。多學科團隊討論評價誘導治療后降期患者手術的可能性,如能做到完全性切除,可考慮手術治療。
NSCLC的圍手術期藥物治療
術后輔助化療:完全切除的Ⅱ~Ⅲ期NSCLC,推舉含鉑雙藥方案術后輔助化療4 個周期。輔助化療始于患者術后體力狀況差不多恢復正常,一般在術后4~6 周開始,最晚建議不超過手術后3 個月。
新輔助化療:對可切除的Ⅲ期NSCLC可選擇含鉑雙藥,2~3
個周期的術前新輔助化療。應及時評估療效, 監測并處理不良反應,幸免增加手術并發癥。手術一般在化療結束后2~4
周進行。術后輔助化療應當依照術前分期及新輔助化療療效,有效者連續原方案或依照患者的耐受性酌情調整,無效者那么應當調整治療方案。建議圍手術期化療共進行4
個周期。
SCLC的藥物治療
一線治療方案:T1~2N0 局限期小細胞肺癌推舉肺葉切除術+肺門、縱隔淋巴結清掃術,術后輔助化療。超過T1~2N0 局限期小細胞肺癌推舉放、化療為主的綜合治療。化療方案推舉依托泊苷聯合順鉑〔EP〕或依托泊苷聯合卡鉑〔EC〕方案。廣泛期小細胞肺癌推舉化療為主的綜合治療,有局部癥狀或伴腦轉移者推舉在化療基礎上聯合放療或其他治療方法。化療方案推舉EP、EC、伊立替康聯合順鉑〔IP 〕、伊立替康聯合卡鉑〔IC 〕或依托泊苷聯合洛鉑〔EL〕方案。〔2〕二線治療方案:一線化療后3 個月內復發或進展者推舉拓撲替康、伊立替康、吉西他濱、替莫唑胺或紫杉等藥物治療;3~6 個月復發或進展者推舉拓撲替康、伊立替康、吉西他濱、多西他賽、替莫唑胺或長春瑞濱等藥物治療;6個月后復發或進展者可選擇初始治療方案。鼓舞患者參加新藥臨床試驗。
4)支氣管鏡介入治療
隨著支氣管鏡在臨床應用的日益普及,對不能手術和放療的患者,以下局部治療手段可作為治療選擇,各種支氣管鏡介導的激光、高頻電刀、射頻消融、氬等離子體凝固術〔argonplasmacoagulation , APC〕、微波、激光、光動力治療、冷凍、氣道支架、球囊擴張、黏膜下或瘤體內藥物注射等技術,實施支氣管腔內介入治療必須嚴格掌握適應證,明確治療目的,客觀評估擬采納的某項治療技術能否實現預期目標,并在有條件的醫院開展治療。
3.2靶向治療
(1)EGFR:靶點及TKIs作用原理
EGFR是表皮生長因子受體(HER)家族成員之一,主要由胞外區、跨膜區以及胞內區酪氨酸酶三部分構成,其與胞外的表皮生長因子(EGF)結合時會形成二聚體結構從而激活下游的信號通路。
EGFR過度表達,會激活下游信號通路,使得細胞生長無法抑制,腫瘤細胞增殖、轉移等特性得以增強,最終促使腫瘤的發生與進展受體與配體結合,與EGF、TGFα等配體結合,受體活化后形成二聚體,胞內區酪氨酸激酶相互磷酸化后,磷酸化的的酪氨酸部位與胞內的信號傳導蛋白結合,形成信號傳導蛋白復合物,同時信號傳導蛋白被激活。持續活化的EGFR通路將向腫瘤細胞內傳遞生長、增殖和抗凋亡信號。下游信號通路包括Ras-MAPK(促進基因轉錄、細胞分裂和細胞周期進程)、PI3K/Akt(抗凋亡通路和新血管生成)、JAK/STAT(細胞增殖和延長細胞生存)、PLCγ/PKC(細胞分化、凋亡等)等。
EGFR-TKIs通過抑制胞內絡氨酸激酶的磷酸化阻礙下游信號傳遞。小分子抑制劑通過與ATP競爭性結合目標,阻斷絡氨酸激酶與ATP結合,從而影響下游通路的激活,對腫瘤細胞產生抑制。
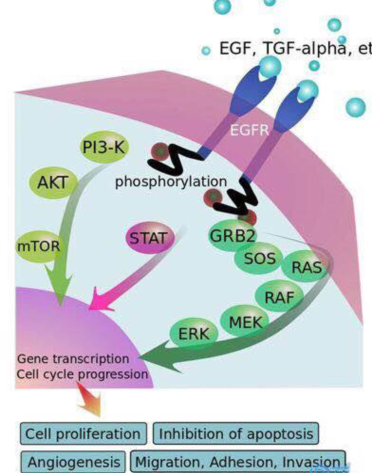
圖7 EGFR信號通路
(2)EGFR:19del和L858R是常見突變位點
EGFR基因的常見突變位點發生在18、19、20和21號外顯子上。根據核苷酸的變化,EGFR突變可以分為3類:以19外顯子編碼的E746到S752的缺失突變為代表;單個核苷酸的替換;插入或重復突變。
在所有的突變類型中,85%-90%為19外顯子缺失突變(19del)以及21外顯子L858點突變(L858R),這兩種突變都會導致酪氨酸激酶域的激活(與對EGFR-TKI的敏感性有關),所以將這兩種突變稱為EGFR敏感突變。其余對EGFR-TKI也敏感的不常見突變有19外顯子插入突變、20外顯子插入突變A763_Y764insFQEA、L861Q、G719S和S768I。EGFR基因突變是預測NSCLC患者使用EGFR-TKIs療效的重要靶標,針對EGFR基因突變已有多種靶向藥物上市,不同的EGFR突變狀態對應不同的靶向藥物選擇。
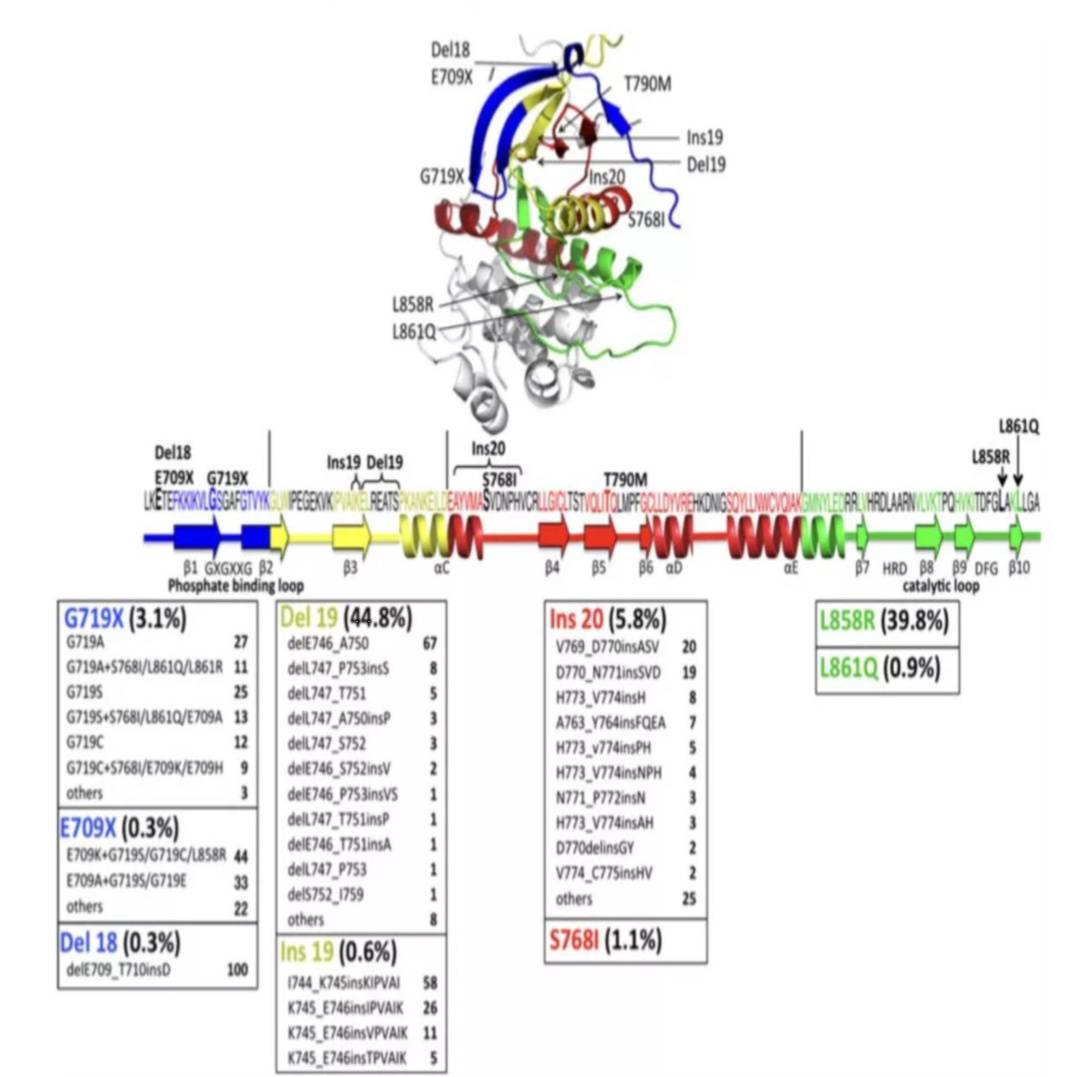
圖8 EGFR基因常見突變位點
(3)EGFR敏感突變陽性治療
NCCN治療指南要求患者在接受治療前進行病理分型檢測和分子檢測,以確定具體NSCLC的病理類型(鱗癌or非鱗癌)與基因突變類型;2020V3指南把奧希替尼列為EGFR敏感突變一線用藥首選,推薦厄洛替尼、阿法替尼、吉非替尼和達可替尼為其他一線用藥,若治療中發現T790M耐藥突變(占比約60%),則需選擇奧希替尼繼續治療,若小分子抑制劑治療后依舊無效,則考慮采用免疫抑制劑(首選)或者其他化療藥物治療。
表5 NCCN推薦EGFR突變陽性患者用藥
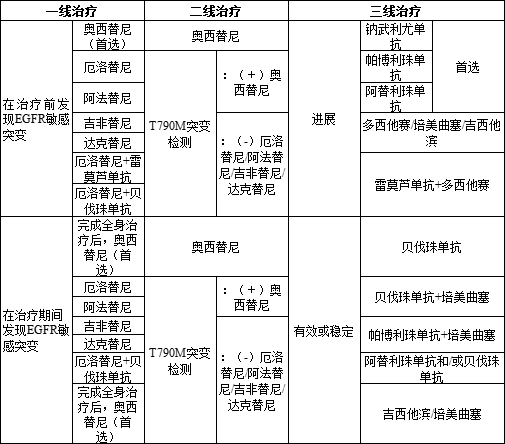
吉非替尼、厄洛替尼、埃克替尼是肺癌靶向藥物第一代治療藥物,與靶點的結合并不牢固,結合一段時間就分開,因為也被稱為可逆的靶向藥物,阿法替尼、達克替尼為二代靶向藥物,能與靶點不可逆的結合,永久鎖住靶點。大多數在接受一代、二代EGFR-TKI藥物治療的患者,在治療一年左右出現耐藥,其原因為患者出現T790M突變,奧西替尼作為三代靶向藥物,能作用于一代或者二代靶向藥物發生耐藥性的特定基因突變(T790M),具有高度的特定基因突變選擇性。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!