
2021-07-05 15:42:59來源:藥方舟瀏覽量:378
導讀:摘要:2021上半年FDA批準藥物報告
創新推動進步,時代引領發展。每年FDA(美國食品藥品管理局,以下統稱FDA)都要批準多種新藥和生物制品以促進醫療保健的進步和民眾健康發展。本文主要介紹在2021年上半年,經由CDER(FDA藥物審評和研究中心)批準的多種新藥及部分生物制品,為廣大制藥企業提供數據支持,提供市場參考。
新藥分布
2021年1月至6月,美國FDA共計批準了52款新藥,6款生物制品(CDER批準)。按照企業提交的申請分類包括新分子實體類占比50%,新酯新鹽類或其他非共價鍵的衍生物類5%,新劑型10%,新配方26%,其他類(新藥物組合等)9%。近半年來,其批準的新藥藥理主要分布在系統用抗感染藥類、神經系統類、心血管系統類以及消化道代謝和抗腫瘤藥等領域。如下圖展示了近半年以來,FDA批準的新藥和部分生物制品的趨勢圖。
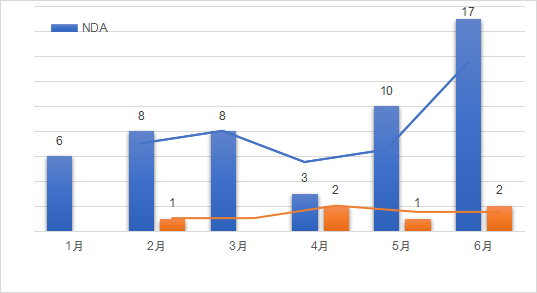
數據來源:藥智數據,藥智咨詢整理
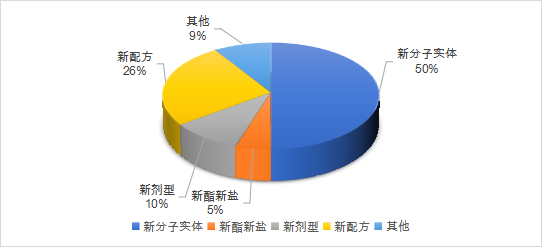
數據來源:藥智數據,藥智咨詢整理
其中,商品名稱MAVYRET和EPCLUSA這兩款新藥為美國FDA首次批準,都為新劑型類藥物,并已獲得了FDA的孤兒藥認定。MAVYRET是格卡瑞韋和哌侖他韋的固定劑量組合藥物,由艾伯維制藥持有并于2021年6月獲得FDA的上市批準,主要治療慢性丙型肝炎病毒。EPCLUSA是一種核苷酸類似物聚合酶抑制劑和泛基因型NS5A抑制劑的固定劑量組合藥物(索磷布韋和維帕他韋),由吉利德科學公司持有并于2021年6月獲得FDA的上市批準,同樣也用于慢性丙型肝炎病毒的治療。
中國藥企
中國藥企在2021年上半年中,有超過20家企業拿到了FDA授予的上市批準,有30個品種(多以注射劑和片劑為主)通過了FDA仿制藥上市批準,同比下降16%。復星醫藥執掌牛耳,共計有9款仿制藥在美國獲批上市。
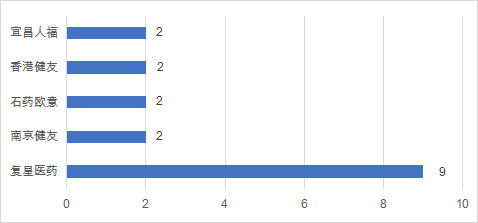
數據來源:藥智數據,藥智咨詢整理
以下為2021年上半年FDA批準新藥和部分生物制品的數據(參考)。
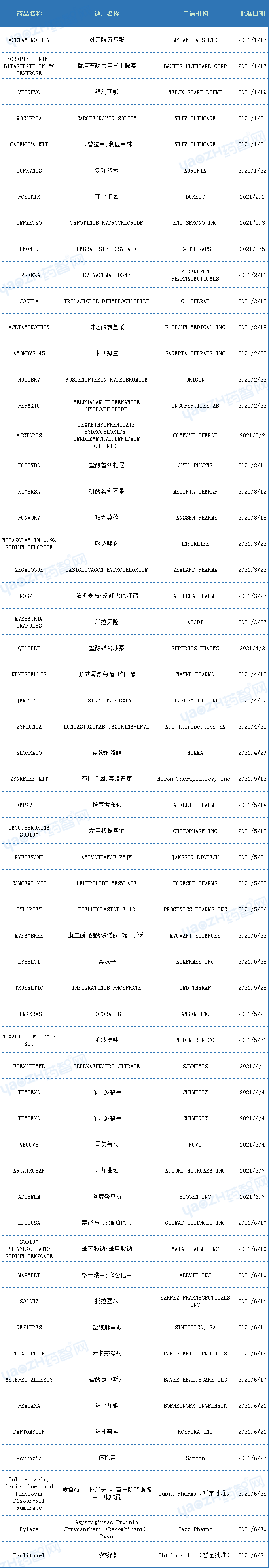
數據來源:藥智美國上市藥品數據庫、Drugs@FDA
想要了解更多信息,請登錄藥智企業版美國上市藥品數據庫查詢,如有不足,敬請指正。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!