
2021-05-07 10:16:17來源:藥智網瀏覽量:652
導讀:知過往,迎未來。
5月4日,輝瑞公布2021Q1業績,公司一季度收入達146億美元,同比增長42%,業績的主要推手為輝瑞與BioNTech合作的新冠疫苗,一季度疫苗收入達到驚人的34.62億美元。有分析師認為,鑒于全球對新冠疫苗的旺盛需求,輝瑞財報的強勁表現將至少在未來2年得以保持。
盡管公司在新冠疫苗上取得了卓越進展,但是,對于公司BCMA×CD3的雙抗產品Elranatamab,卻因1期臨床觀察到的3例外周神經痛不良反應而暫停新受試者的入組。雙抗藥物的安全性再次受到挑戰。實際上,就雙抗藥物與雙藥聯合療法相比,療效的差異性并不顯著,但雙抗藥物有望大幅降低聯合療法所誘發的不良事件,因此藥物安全性備受關注。
目前,全球共有三款雙抗藥物獲批上市,包括Trion Pharma靶向CD3和EpCAM的卡妥索單抗(Removab)、安進靶向CD3和CD19的倍林妥莫雙抗(Blincyto)、羅氏靶向FIX和FX的艾美賽珠單抗(Hemlibra)。其中,Removab和Blincyto均以CD3作為其中一個靶點。在這一時點,回顧全球已上市的雙抗產品,思考其發展歷史及不良反應事件,十分有意義。
(一)卡妥索單抗
卡妥索單抗(Catumaxomab)是全球首個商業化的雙特異性抗體藥物,也是全球首個退市的雙抗藥物。卡妥索單抗由Trion Pharma公司研發,商品名Removab,可同時靶向T細胞表面抗原受體CD3和癌細胞標志物EpCAM。

圖片來源:凌騰醫藥
圖1:卡妥索單抗結構
2009年,Removab獲EMA批準上市,用于治療EpCAM陽性腫瘤引起的惡性腹水。惡性腹水是指由于全身或腹腔發生惡性腫瘤或癌性病變引起的胸腹內臟壁彌漫性病變,為癌癥晚期的并發癥之一。多種疾病可引起惡性腹水,如卵巢癌、胃癌、結直腸癌等。
但是,Removab上市后,市場表現十分糟糕,最終于2014年停止于市場銷售并于2017年6月官宣退市。對于退市的原因,公司解釋是市場表現不佳,惡性腹水適應癥的選擇易使Removab淪為一種昂貴的輔助用藥療法。此外,由于公司未對Removab制定合理的價格和營銷方案,更未充分將藥物對延長病人生存期的療效作為主要亮點推廣,最終導致商業上的失敗。
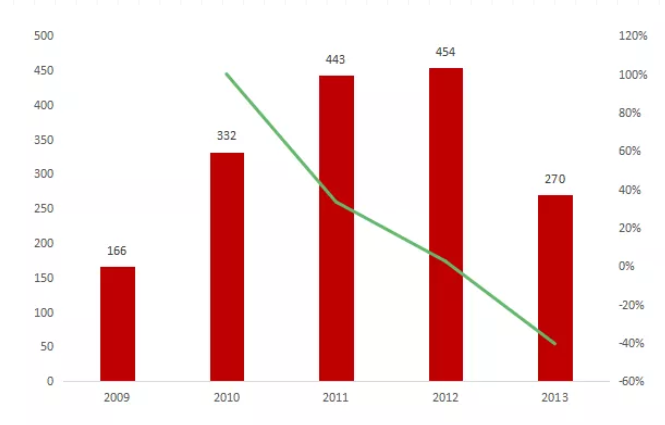
圖片來源:公開數據整理
圖2:2009-2013年Removab市場表現(萬美元)
除了商業化的失敗外,藥物的設計亦可能存在弊端。Removab是一種大小鼠嵌合雙抗,存在人抗鼠抗體反應。而CD3作為一個重要的T細胞靶點,易誘發細胞因子釋放綜合征(CRS)。CRS作為高級別免疫激活所導致的一種非抗原特異性毒性,與包括IL-6和IFN-γ在內的細胞因子循環水平的升高相關。這些炎癥介質導致的炎性反應會引起組織損傷,導致微血管病變、心臟衰竭甚至死亡。
這從臨床數據可見一斑。Ⅰ/Ⅱ期臨床試驗表明,卡妥索單抗最常見的突發性不良反應包括:發燒(83%)、惡心(61%)、嘔吐(57%)、腹痛(39%)、淋巴細胞減少(26%)、肝功能檢查異常,特別是ALP、AST、GGT和膽紅素升高。Ⅱ/Ⅲ期臨床研究報告,15%患者發生了治療相關的嚴重不良事件。
(二)博納吐單抗
博納吐單抗(Blincyto)是一款雙特異性CD19導向的CD3 T細胞銜接分子,靶向T細胞表面的CD3及惡性B淋巴細胞表面的CD19。Blincyto為基于安進公司BiTE平臺研發的雙抗藥物。BiTE是一種串聯型的單鏈抗體,不含Fc結構,分子量較小,滲透性高,可以到達大分子抗體難以抵達的部位與抗原發生結合。缺點是半衰期較短,需要頻繁的給藥。
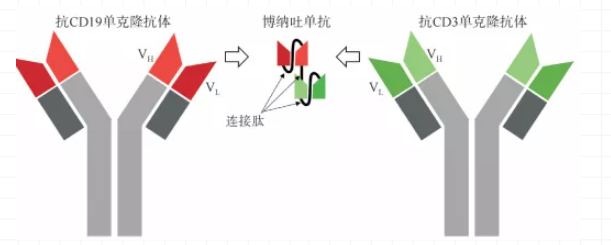
圖片來源:安進
圖3:Blincyto分子結構
2014年,Blincyto獲FDA批準上市,用于治療成人和兒童復發或難治性前體B細胞急性淋巴白血病;2018年,Blincyto將適應癥拓寬至微小殘留病(MRD)陽性前體B細胞急性淋巴細胞白血病。2020年12月,Blincyto獲NMPA批準用于治療成人復發或難治性前體B細胞急性淋巴細胞白血病(ALL)。在國內,百濟神州擁有其開發和商業化權力。
2014年,Blincyto在美國上市后,憑借顯著的療效,銷售額不斷攀升,2020年全球銷售額達3.79億美元。但是,Blincyto價格十分高昂,美國市場兩輪療程的定價為17.8萬美元。
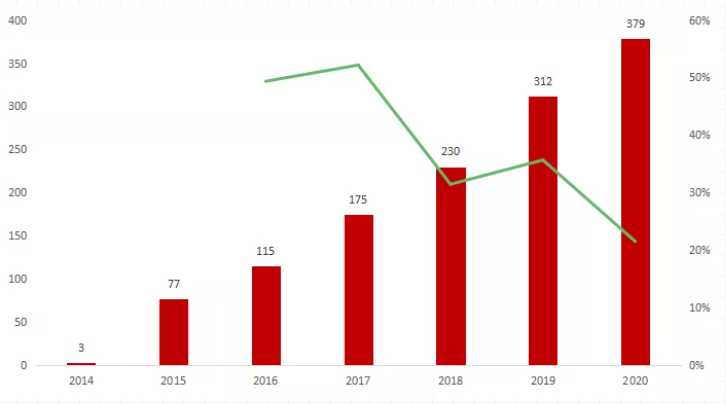
圖片來源:安進
2014-2020年Blincyto全球銷售額(百萬美元)
從安全性的角度,Blincyto常見的不良反應包括發熱、頭痛、感染等。但說明書中亦包含一項黑框警告,即Blincyto存在CRS和神經性毒性的不良事件。簡而言之,CRS這一不良事件與T細胞息息相關,依賴于靶抗原對T細胞的激活、T細胞的擴增和功能響應,這與CAR-T療法常出現的CRS十分一致。考慮到IL-6可能是CRS發生的核心調節者,臨床上常使用托珠單抗予以治療。
(三)艾美賽珠單抗
艾美賽珠單抗(Hemlibra)由羅氏公司研發,是一種重組人源化的IgG4雙特異性單克隆抗體。Hemlibra通過橋接FIXa和FX,促進凝血酶的生成,恢復A型血友病患者的凝血過程,使FⅧ功能障礙或完全缺乏FⅧ的A型血友病患者的出血部位達到止血。
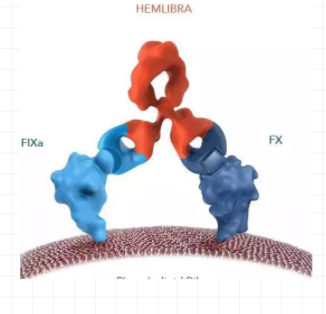
圖片來源:羅氏
圖3:艾美賽珠單抗結構
2018年12月4日,Hemlibra獲得NMPA批準,用于存在凝血因子Ⅷ抑制物的A型血友病成人和兒童患者的常規預防性治療。2021年3月底,Hemlibra第二個適應癥——不存在凝血因子Ⅷ抑制物的A型血友病患者常規預防性治療上市申請的辦理狀態變更為“在審批”,預計不日將獲批上市。
艾美賽珠單抗作為全球唯一一款可治療所有A型血友病的藥物,臨床意義非凡。2020年,Hemlibra創下21.9億瑞士法郎銷售額的好成績,躋身全球TOP 100藥物榜單。但其缺點在于價格過高,年治療費用高達數十萬人民幣。
從安全性的角度,Hemlibra常見的不良反應包括注射部位反應、頭痛和關節痛等,FDA在其說明書中亦添加了一項黑框警告——血栓事件風險,這點值得醫生與患者關注。
來源:藥智網
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!