
2021-04-08 10:14:08來源:藥智網瀏覽量:765
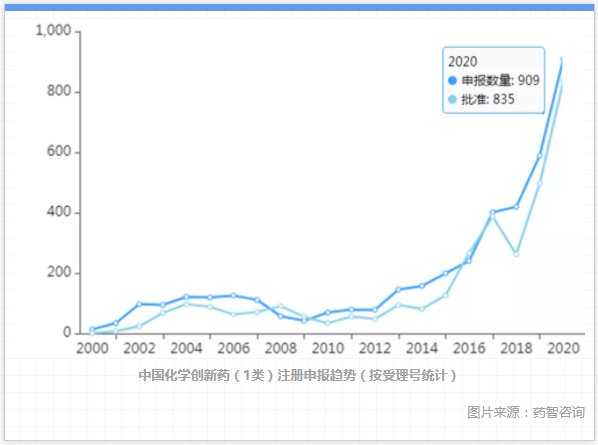
經過2006年藥品注冊核查風暴引發的低谷后,從2009年起,國內創新藥申報開始緩慢增長;2015年畢老爺醫藥研發新政實施后,創新藥研發進入暴發期,每年的新藥申報數量都創出新高,到2020年,僅化學創新藥(1類新藥)注冊申請受理號就達909個,批準的受理號達到835個(平均一個品種有2個受理號,即相當于400多個新藥),年度批準臨床和生產的化藥創新藥個數可能比美國還多。
創新藥是什么?它可不是低技術含量的仿制藥,更不是滿大街賣的大白菜,但為何有如此多的申報呢?當真是中國醫藥創新已進入世界一流水平?且慢,我們不能只看數量,還需分析質量。
創新藥指“境內外均未上市的創新藥(新的結構)”,也就是我們俗稱的1類新藥。美國稱為505b(2)的“改良型新藥”不在本文討論的創新藥之列。
同為創新藥,卻也有云泥之別,其中,高高在上的就是“Firstinclass”——也就是原創新藥,不僅要求是新分子實體,而且要求新機制(新靶點)或新適應癥,具備現有藥品不具備的優勢。
我們經常聽到“研發一個新藥,需要10年時間、10億美元(現在已需要20億美元了)”,指的就是這類新藥,難度可見一斑,而中國幾十年來得到國際認可的這類創新藥只有青蒿素、二巰丁二酸等寥寥數個藥物。
中國現在有沒有研發“Firstinclass”?
此類藥不僅難度大,風險更大,因為“Firstinclass”的本質就是走一條前人尚沒有走過/走通的路,但收益也很大,國內個別有實力的大企業與創新型團隊也在進行研發,只是道路漫且長,還需上下而求索。
如果說“Firstinclass”走的是一條前人尚沒有走過/走通的路。那Me-too藥就是看到別人走通了之后,再研發(改造)一個類似的藥物去走同樣的路,風險和難度大大降低。
如果不做改造,完全一模一樣,那不是Me-too藥,而是仿制藥(ANDA)了,那需要等到專利保護期過后才能仿制。
既要走別人的路,又要規避專利,于是Me-too藥就應運而生了。這一操作在中國更是被發揮到了極致,常見的手段就是作用機理、適應癥不變,只對化合物的結構做一點輕微變動,成為一個化合物,能規避專利就可。

我們還聽說過一類藥叫Me-better,它是Me-too中有個別藥物,經過改造之后,其臨床效果明顯的比首創藥“Firstinclass”更好。在中國,雖然宣稱Me-better的藥物比比皆是,但實際卻是少之又少,因為真正的Me-better是需要靠臨床試驗數據說話的,如果不與“Firstinclass”進行頭對頭的對比試驗,是沒有資格稱自己是Me-better的。
更有甚者,部分Me-too藥臨床效果其實還不如改造前的藥物,我們稱其為“Me-worse”。雖然研發者決不承認自己的藥是“Me-worse”,但國內的不少創新藥其實屬于此類。
對于文字游戲,國人向來是樂此不彼的,不僅對于漢字,對于英語單詞也玩得爐火純青,最近冒出一詞,形像而貼切,堪稱一針見血!說中國現在研發的新藥已經不是Me-too(你有我也有),而是We-too(你有,我們也有),就是每當有一個全新的藥物出來,我們就會有一堆的企業去跟風做,直至把Me-too藥,作成We-too藥,這才有文章開篇所說2020年有400多個新藥被批準臨床或生產,終于成功地把我國的藥物研發從低水平的重復研究,提升為高水平的重復研究。我曾說,再好的賽道,到了中國,也會變得擁擠,也許We-too藥就是最好注腳。
不僅化藥如此,號稱尖端技術的生物藥也是如此,如針對PD-1這一個靶點的同類創新藥,目前就有約60多個廠家注冊申報。既然賽道已變得如此擁擠,大家為何還是樂此不彼呢?
國家藥品帶量采購將仿制藥的價格打到了低谷,但對于藥企而言,沒有研發就沒有出路,仿制藥受打壓,投資者和地方政府對于創新藥卻親睞有加。而中國的絕大多數企業既沒有技術能力,也沒有資金實力去做“Firstinclass”,那Me-too藥就成了眾多藥企無奈中的必然選擇,更何況在立項時,還有點夢想,萬一做出更好的Me-better呢?
在過去的藥品注冊制度下,原創新藥在中國上市平均要比歐美晚5年到8年,而這個時間差就是Me-too(包括Me-worse)最好的紅利基礎。但隨著前幾年藥品注冊監管的改變,創新藥逐漸在中國同步上市后,Me-too藥將越來越難走,雖然技術之路好走,市場之路卻難了,所以我們會聽到一些看似笑話的新聞:“因為XX創新藥上市了,所以該企業估值/市值下降了”,就是因為原本讓人充滿期待的新藥在殘酷的市場面前碰了個頭破血流。
在中國要想改變現狀,從國家層面講:首先是要加強基礎研究,很多創新藥,如偉哥藥物的誕生背后就源于一個諾貝爾獎發明,沒有基礎研究,就沒有新機制、新靶點的發現,沒有這些發現何談真正的創新藥。不能指望歐美做基礎研究,中國來做研發“Firstinclass”,撿現成是不可持續的,當然對于單個企業而言,可以緊跟世界生命科學前沿,尋找機會,通過跟蹤最新文獻就是有效的手段之一。
其次是要優化創新藥的市場環境,市場這只無形的手才是真正的指揮棒!
雖然中國生物醫藥基礎研究較弱,但并非沒有,甚至國際成果也可為我所用,那為什么中國很少有人愿意做“Firstinclass”呢?
除了技術方面的問題,還有更重要的就是市場的問題——中國的藥品消費市場(用詞不當,但藥品其實也是一種商品)對創新藥并不友好:
一是進入醫保有難度。以前只有每五年調整一次醫保目錄時,才有機會進入醫保,當然,隨著醫保目錄動態調整,創新藥可通過談判進醫保,部分現已得到解決。2016年至2020年我國共有194個創新藥上市,已有119種進入《2020年國家醫保目錄》。
二是進醫院難,進了醫保進不了醫院。據中國藥學會1420家樣本醫院的統計數據顯示,截至2019年底,2018年納入醫保的腫瘤創新藥僅不到20%成功入院。
三是高價格藥物在中國市場上難以立足。10億美元的研發費用,需要高價格的藥價支撐。美國的創新藥是純市場定位,原創性新藥基本都伴隨高價格,即使天價藥,也時有出現,一款治療骨硬化癥和慢性肉芽腫病兩種罕見病的藥物Actimmune,每月費用高達52322美元(每針價格為4360美元)。這在中國是不可想像的,既沒有患者,也沒有醫保愿意為之買單(國家醫保只保基本,而商業醫保力量太弱),說不定還會罵藥企老板沒有良心。于是創新藥在價格談判中往往遇到的是靈魂砍價,進入醫保的代價就是價格腰斬。
最后就是對孤兒藥(罕見病藥)的各種支持政策需要盡快出臺。我國對孤兒藥的重視都還停在口頭上,缺乏明確的政策支持,所以創新藥中大品種扎堆,孤兒藥無人問津。
這些問題不僅“Firstinclass”會遇到,Me-too藥也會遇到,但Me-too藥不怕,因為其研發成本低,不必強求高價格、大市場,只要能占領部分市場就能回本,Me-too怕的是過度競爭、慘烈的競爭。
對于企業而言,做創新藥研發,則可以尋求以下出路:
第一、走國際化道路。國內要想較好地解決藥品支付市場問題,短期內看不到希望,也不由咱們老百姓控制,企業還得自謀生路。縱觀國際大公司的新藥研發,之所以熱衷于原創性新藥“Firstinclass”,主要就是有廣大的市場,歐、美、日、中,甚至全球都是他們的目標市場,特別是歐、美市場的豐厚回報,完全可以支撐其巨額研發支出。如果要研發一款“Firstinclass”,那就必須走上國際舞臺,否則,僅憑中國市場難以支撐,而且也是資源浪費,即使自己沒有實力、渠道在國外申報、銷售,也可以采用授權(Licenseout)方式,將國際市場轉讓給國外企業。如果這款藥沒有希望打入國際市場,只能說你可能遇到了偽“Firstinclass”。
第二、尋求合作。對于有資金、有渠道,沒有技術,但又想做創新藥的,可通過Licensein獲得在國內市場的授權,以前不少日本藥企的創新發展之路就是這樣走出來的。
第三、除了一些依賴某個項目而生的創新型小公司外,一般的藥企做新藥研發不是一錘子買賣,必須要有持續的創新,利用最初的創新藥研發初戰,建立高效的研發體系,逐步形成創新研發管線,只有這樣才可持續,規避創新藥的風險問題,不至于一個藥品研發失敗,全盤皆敗,一個藥品成功,也是曇花一現。
第四、如果確實沒有實力做Firstinclass,只能做Me-too藥,也不是不可以,選擇品種、及早進入是關鍵,Me-too最怕的是慘烈競爭,而恰巧國人卻喜歡追熱點,一窩蜂。擁有一個良好的BD總監,選擇一個優秀的藥品數據庫進行篩選,請專業團隊做分析評估(藥智數據和藥智咨詢就挺不錯,哈),找到既有市場,但還未被眾人追求的“女神”,避免將Me-too做成We-too。對于一個Me-too藥,好的立項就成功了一半。
來源:藥智網
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!