
2025-04-01 00:00:00來源:微譜生物科技瀏覽量:50
單克隆來源評價是生物制藥,尤其是單克隆抗體藥物開發中至關重要的質量控制環節,其核心意義在于確保治療產品的一致性、安全性和有效性。缺乏嚴格的單克隆驗證可能導致藥物失效、臨床試驗失敗或上市后召回等嚴重后果。本期專家解讀,將開啟單克隆來源評價系列的第1期。

1997 年 ICH Q5D 的第 2.1.3 章節指出:
“對于重組蛋白產品,細胞底物是含有所需序列的,來自于單個細胞前體的轉染細胞。”
1997年FDA在《用于人類使用的單克隆抗體產品的制造和測試需考慮的事項》中指出:
“主細胞庫被定義為來自單一組織或細胞的具有均勻組成的細胞集合。”
2013 年 WHO 生物標準專家委員會 47 在第 111 頁陳述了如下內容:
“在單克隆細胞培養過程中,應選擇單個細胞進行擴增。應當詳細記錄克隆過程,包括原始培養物的來源、克隆的方案以及所用的試劑。通過一輪有限稀釋獲得的克隆不一定能夠保證來自于單一細胞,應當執行其他的亞克隆步驟… ... 克隆過程需要充分的文件記錄,并附有詳細的成像技術和/或適當的統計數據。對于使用重組質粒 DNA 技術轉染的蛋白質,如果能夠在整個的生產過程以及超出生產過程之外的細胞代次內證明產品同質性和一致的產品特征,那么一輪完整記錄的克隆即已經足夠。”

2.1 行業挑戰
2016年,禮來公司等聯合發表了一篇名為《生物制藥生產細胞系“克隆性”相對重要性的行業觀點》的綜述,闡明對于制藥行業的產品質量來說,應該著重監管生產工藝與產品質量檢測;提出“單克隆性”是錯誤概念,理由是CHO細胞自身有基因重排等不穩定性,傳代培養后會積累遺傳與表型異質性;同時,歷來的生物制品生產體系也存在非單克隆性的群體細胞,不影響產品的質量。

▲ 圖源 | Frye C, et al., Industry view on the relative importance of “clonality” of biopharmaceutical-producing cell lines, Biologicals (2016).
2.2 監管回應
2019年,CDER辦公室主任Joel T. Welch也在相同期刊上發表一篇名為《考慮“克隆性”:對生物制藥開發中哺乳動物細胞庫克隆衍生重要性的監管觀點》的綜述,闡明雖然CHO細胞系是不可穩定的會形成一個遺傳和表型多樣化的家族,體現在單核苷酸多態性(SNPs)、拷貝數變異和染色體型中。

▲ 圖源 | Joel T. Welch.,Considering “clonality”: A regulatory perspective on the importance of the clonal derivation of mammalian cell banks in biopharmaceutical development, Biologicals (2019)
通過對比非單克隆來源與單克隆來源的細胞,在生產穩定性上來說,盡管非克隆衍生庫在收獲時可能與克隆衍生庫具有相同的CQA平均值,但其克隆期間的不同起點可能會導致一個或多個CQA的更大變異性,以及在制造期間可能更容易受到漂移、移動和不可預見的選擇壓力的影響。如下圖所示。
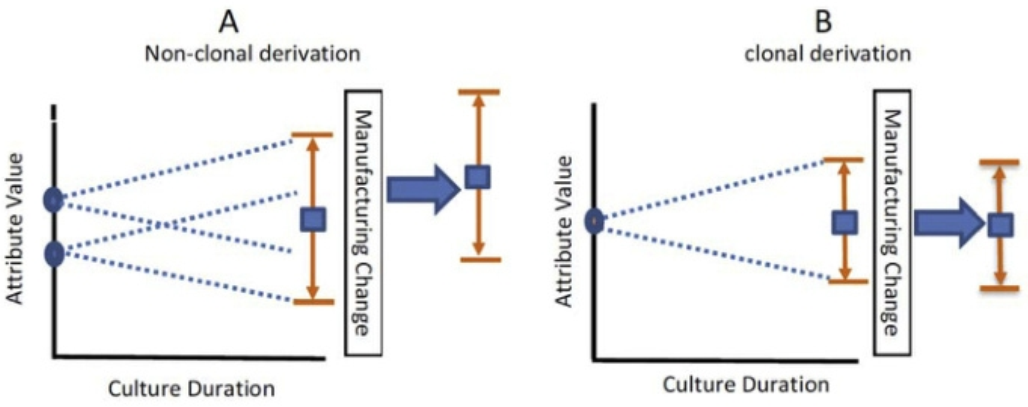
▲ 圖源 | Joel T. Welch.,Considering “clonality”: A regulatory perspective on the importance of the clonal derivation of mammalian cell banks in biopharmaceutical development, Biologicals (2019)

目前,無論是CDE還是FDA對于重組蛋白抗體的上市階段,均要求補充細胞庫單克隆來源的驗證資料,以此評估生產工藝與質量控制的策略是否能夠保證產品的穩定性。
但在IND及研發階段,有的通過有限稀釋法以及單克隆拍照的方式證明單克隆來源;有的通過ClonePix或FACS以及其他分選儀器進行分選,再進行一輪有限稀釋和單克隆拍照來證明單克隆來源;有的未在建庫之前完成單克隆的無血清馴化改造。如果前期對于MCB是否單克隆衍生評價的不充分,需要在BLA階段補充單克隆來源的驗證試驗從染色體水平(FISH)與基因水平(NGS或Southern Blot)來提供證明。
目前監管越來越關注在研發階段或IND階段,提供篩選的方法與數據對于單克隆株的評價更為重要;同時也影響后續生產工藝與質量控制的策略。如果前期缺乏對于單克隆細胞株的篩選與評價數據,那么需要增加更加嚴格的工藝控制與質量控制策略。

從法規與審批要求來看,對于單克隆來源的驗證要求,根據單克隆分選的方式、是否有照片跟蹤資料、研發階段的篩選評價、有無整合位點的分析等,決定IND階段與BLA階段分別對于MCB/WCB與EOPC進行驗證檢測。主要的檢測方法包括:
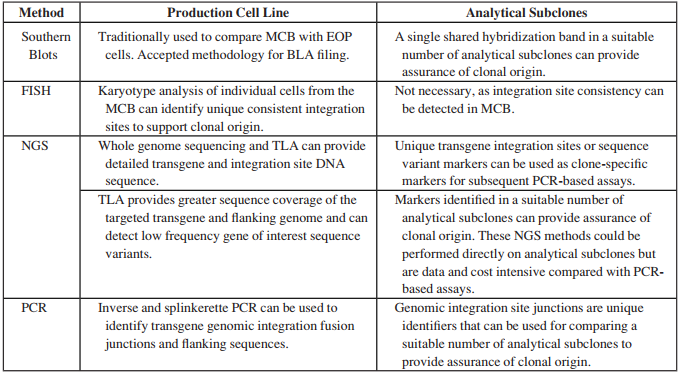
▲ 圖源 | Paul Wu., et al., Advancing Biologics Development Programs with Legacy Cell Lines: Advantages and Limitations of Genetic Testing for Addressing Clonality Concerns Prior to Availability of Late Stage Process and Product Consistency Data, PDA Journal of Pharmaceutical Science and Technology

微譜生物科技可以為客戶提供FISH檢測簡化版與標準版、Southern Blot、NGS整合位點分析、單細胞分選等檢測服務,能夠滿足研發階段、IND申報階段與BLA申報階段的單克隆來源驗證服務。
參考單克隆來源驗證解決方案如下表所示:
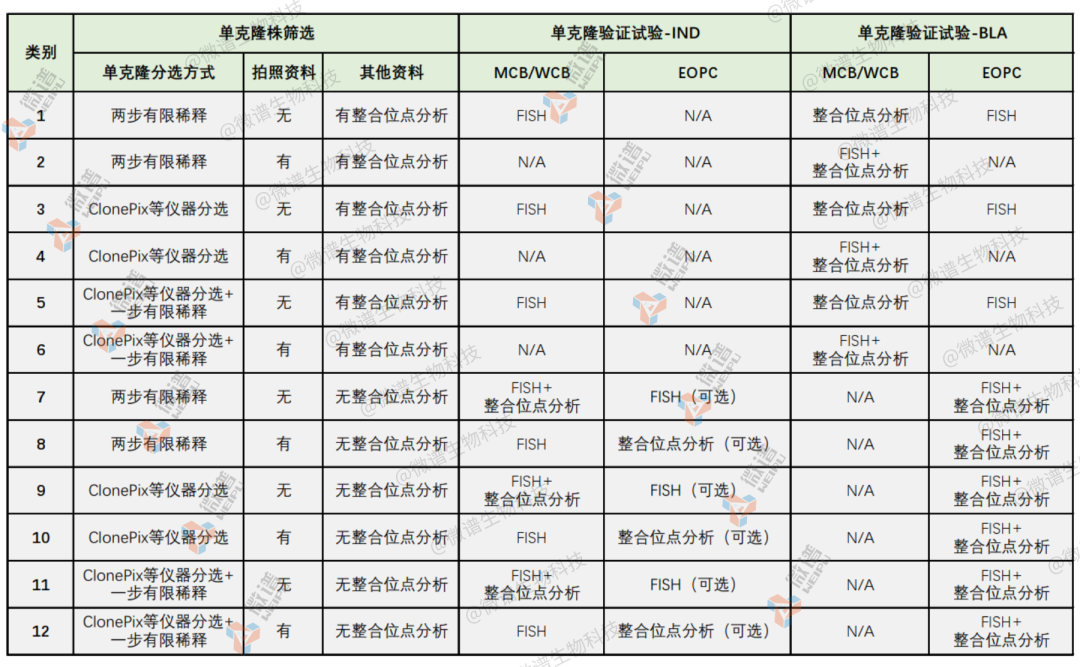
▲ 圖源 | 微譜生物科技