
2025-03-20 14:46:58來源:藥方舟瀏覽量:173
2025年3月19日,智飛生物發布關于15價肺炎球菌結合疫苗獲得Ⅲ期臨床試驗總結報告的提示性公告,該疫苗具有良好的免疫原性及安全性,全面達到臨床試驗預設目標,在免疫原性方面非劣效于對照疫苗。

肺炎是一種肺部炎癥性疾病,通常由細菌、病毒、真菌或其他微生物感染而引起,細菌性肺炎占人體感染的肺炎的80%,其中肺炎鏈球菌是重要的病原體。早在2008年,WHO就已將肺炎球菌疾病列為需“極高度優先”使用疫苗預防的疾病。
在我國,肺炎球菌疫苗尚未被納入我國國家免疫規劃,屬于自費接種疫苗。從市場規模看,據觀研天下數據顯示,到2026年,中國肺炎球菌疫苗市場規模將突破200億元,年復合增長率達到18.24%。
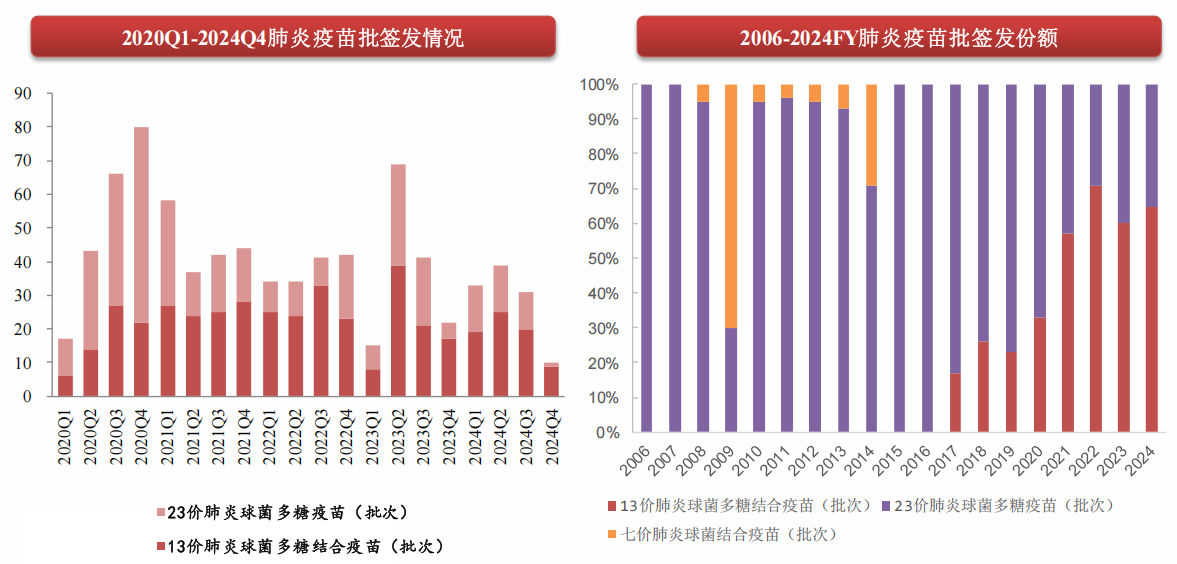
目前,國內上市的肺炎疫苗包括13價肺炎結合疫苗和23價肺炎多糖疫苗。據西南證券報告顯示,2024年國內肺炎疫苗批簽發110批次(-27%)。其中,13價肺炎結合疫苗批簽發71批次(-23%);23價肺炎多糖疫苗批簽發39批次(-34%),智飛生物的23價肺炎疫苗批簽發4批次。
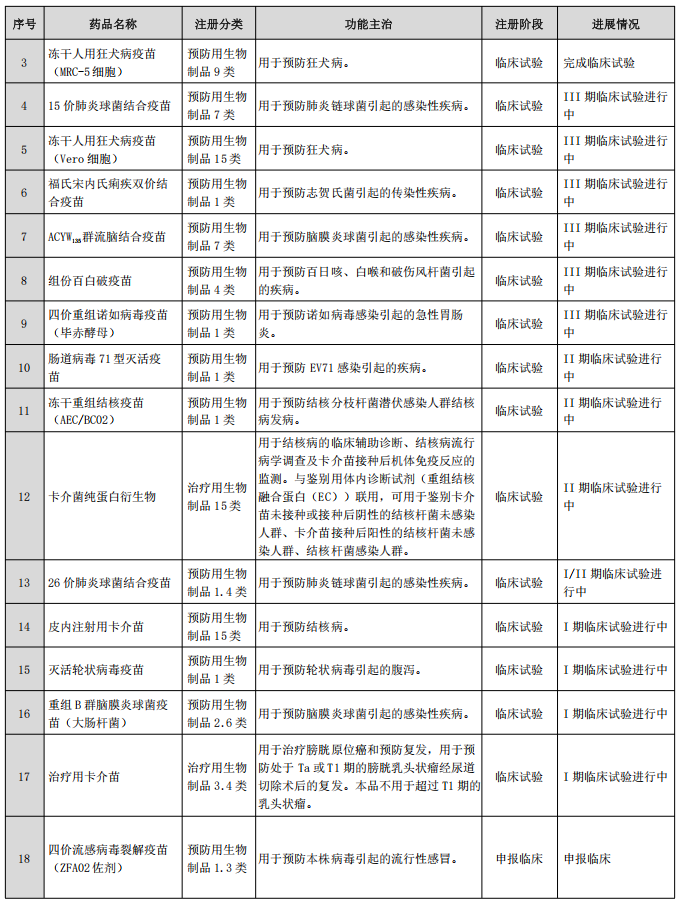
目前,智飛生物共有13種產品上市在售,1種產品附條件上市,包括預防流腦、宮頸癌、肺炎、輪狀病毒、帶狀皰疹等傳染病的疫苗產品,也涵蓋提供結核感染診斷、預防、治療有效解決方案的藥品,覆蓋人群包括嬰幼兒、青少年、成人;自主研發項目共計32項(不含新冠系列項目),其中處于臨床試驗及申請注冊階段的項目18項。
在肺炎球菌疫苗產品方面,除了15價肺炎球菌結合疫苗外,智飛綠竹研發的23價肺炎球菌多糖疫苗已于2023年8月29日獲批上市,26價肺炎球菌結合疫苗則處于I/II期臨床試驗。值得注意的是,公司的26價肺炎球菌結合疫苗是目前國內已獲批臨床試驗的最高價次的同類產品。
而15價肺炎球菌結合疫苗獲得Ⅲ期臨床試驗總結報告后可向國家藥品監督管理局遞交藥品生產注冊申請,此后還需經過技術審評、臨床試驗現場核查、生產現場檢查等程序,待獲得藥品注冊批件、且產品獲得批簽發后方可上市銷售。

若未來公司的15價肺炎球菌結合疫苗成功獲批上市銷售,將與另外兩款疫苗形成協同效應,進一步豐富公司肺炎疫苗矩陣產品結構,強化公司的市場地位,增強行業競爭力。

聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容