
2025-03-04 09:31:05來源:? 注冊圈瀏覽量:314
一、藥審中心舉辦2025年第二期“藥審云課堂” 網址: https://www.cde.org.cn/main/newspic/view/0e8e0c23a57e9288371af1c76e690e20 2025年2月14日,藥審中心舉辦第二期“藥審云課堂”,講解申請人較為關注的藥品研發中的藥學研究內容,幫助申請人更好掌握藥學研究的理念。來自藥品監管機構、藥品研發及生產企業等近1萬人在線觀看。 本期云課堂從中藥、創新藥和生物類似藥方面,綜合申請人咨詢問題及補充資料常見問題,選派了4名審評員精心準備課程,對上述類別的藥學研究進行講解,并對收集的共性問題進行了集中解答。 為進一步提升“藥審云課堂”課程質量,請觀看人員及時登錄藥審云課堂平臺,對本期云課堂進行評價,并就下一期云課堂主題等內容提出寶貴意見建議。 近期藥審云課堂平臺新上傳視頻列表如下,請業界及時觀看學習。 1. 中藥PCMC質量控制研究的考慮 2. 中藥新藥工藝研究、過程控制及變更研究技術要求的一般考慮 3. 化學創新藥質量控制與常見問題分析 4. 生物類似藥CMC質量控制研究的考慮 5. 新藥加快上市程序概述 6. 藥品注冊受理常見問題 7. 藥品注冊受理案例分享 8. 生物制品藥學溝通交流常見問題的考慮 9. 溝通交流申請中臨床常見技術問題的考慮 二、關于將乙磺酸尼達尼布軟膠囊納入《以患者為中心的罕見疾病藥物研發試點工作計劃(“關愛計劃”)》試點項目的通知 網址: https://www.cde.org.cn/main/news/viewInfoCommon/7d8a4a5c596e0c5368271d0165710382 依據《以患者為中心的罕見疾病藥物研發試點工作計劃(“關愛計劃”)申報指南》,現將乙磺酸尼達尼布軟膠囊納入“關愛計劃”,試點項目的基本信息如下: 品種名稱:乙磺酸尼達尼布軟膠囊 申報單位:勃林格殷格翰(中國)投資有限公司 適應癥:特發性肺纖維化(IPF) 申報階段:E階段:上市后階段 工作要點:計劃在中國開展上市后研究,整合定性研究和定量研究的混合研究方法收集患者體驗數據。 國家藥品監督管理局藥品審評中心 2025年2月28日 三、關于公開征求“兒童抗腫瘤藥物研發鼓勵試點計劃(星光計劃)”相關工作文件意見的通知 網址: https://www.cde.org.cn/main/news/viewInfoCommon/0104c865410b8becaa67c7c30ddc7676 兒童腫瘤是一類對社會和家庭危害程度大的少發、罕見疾病,為了持續推動以患者為中心的藥物研發,落實國家藥監局“提前介入、一企一策、全程指導、研審聯動”的要求,藥審中心將啟動“兒童抗腫瘤藥物研發鼓勵試點計劃”,即“星光計劃”(SPARK計劃,Support Anti-tumor drugs R&D for Kids)。 我中心現對“星光計劃”的申報指南、申請表和實施框架公開征求意見。我們誠摯地歡迎社會各界提出寶貴意見和建議,并及時反饋給我們,以便后續完善。征求意見時限為自發布之日起1個月。 您的反饋意見請發到以下聯系人的郵箱: 聯系人:唐凌,艾星 聯系方式:tangl@cde.org.cn, aix@cde.org.cn 感謝您的參與和大力支持。 國家藥監局藥審中心 2025年2月28日 一、國家藥監局綜合司關于2025年醫療器械行業標準制修訂計劃項目公示 一、江蘇省藥品監督管理局新增19個共性問題 (一)統一咨詢問答2個 網址: http://da.jiangsu.gov.cn/col/col84641/index.html (二)優化藥品補充申請改革試點前置服務問答及典型案例新增12個 二、北京市藥品監督管理局 (一)北京市藥品監督管理局關于印發《北京市藥品零售企業許可管理規定》的通知 網址: https://yjj.beijing.gov.cn/yjj/zwgk20/zcwj91/543536185/index.html 各有關單位: 為加強藥品零售企業規范化管理,進一步完善藥品零售企業經營許可管理,促進藥品零售企業連鎖化、規模化發展,依據相關法律、法規和規范性文件,我局結合監管實際組織制定了《北京市藥品零售企業許可管理規定》,現予以印發,請遵照執行。 特此通知。 北京市藥品監督管理局 2025年2月24日 (二)文字解讀:《北京市藥品零售企業許可管理規定》 政策解讀 網址: https://yjj.beijing.gov.cn/yjj/zwgk20/zcjd8/543536302/index.html 一、修訂《北京市藥品零售企業許可管理規定》的背景和意義是什么? 答:2019年,新修訂《中華人民共和國藥品管理法》要求建立健全藥品追溯制度,鼓勵、引導藥品零售連鎖經營,對藥品經營活動及其監督管理提出新要求。同時,隨著“放管服”改革不斷深入,藥品經營許可準入管理進一步優化調整。2024年1月1日,《藥品經營和使用質量監督管理辦法》正式實施,與已廢止的《藥品經營許可證管理辦法》《藥品流通監督管理辦法》相比有較大的調整。《北京市開辦藥品零售企業暫行規定》因制定時間較早,已不適應上位法及我市藥品零售行業高質量發展的需要,有必要進行全面修訂。 二、《北京市藥品零售企業許可管理規定》的修訂思路是什么? 答:以習近平新時代中國特色社會主義思想為指導,以“守底線保安全、追高線促發展”為出發點,圍繞保障藥品質量安全、優化民生服務、促進產業高質量發展等方面,全面加強藥品零售企業經營質量監管。一是堅持“四個最嚴”要求,加強藥品零售企業規范化管理,進一步提升藥學服務水平。二是貫徹落實“放管服”要求,進一步優化營商環境、進一步完善藥品零售企業經營許可管理。三是夯實藥品經營活動中各相關方責任,發揮藥品連鎖企業經營優勢,推動藥品零售企業經營高質量發展。 三、《北京市藥品零售企業許可管理規定》的主要內容有哪些? 答:根據《中華人民共和國藥品管理法》《藥品經營和使用質量監督管理辦法》《藥品檢查管理辦法(試行)》《藥品網絡銷售監督管理辦法》有關規定,對《北京市開辦藥品零售企業暫行規定》進行了修訂,包括總則、經營許可、藥品經營許可辦理程序、藥品經營許可證管理、經營管理、監督檢查和附則共七章61條。主要涵蓋以下幾方面: (一)優化營商環境,減輕企業負擔。對在農村鄉鎮以下地區開辦藥品零售企業、開辦藥品零售連鎖門店、開辦僅經營同一品牌的藥品零售企業、開辦經營類別僅為乙類非處方藥的藥品零售企業經營場所使用面積以及經營中藥飲片(僅經營非臨床配方使用的定型包裝中藥飲片除外)的調劑區域使用面積均有所下調。經核準的藥品零售企業經營面積內可依法申請經營醫療器械等相關健康類產品,其中藥品經營面積不少于50%。藥品零售連鎖總部設置配送中心(倉庫)的,建筑面積不少于 200平方米(同一平面連續面積或同一建筑物連續樓層),較原《規定》減少100平方米。 (二)強化政策引導,促進連鎖發展。國家鼓勵、引導藥品零售連鎖經營,明確藥品零售連鎖企業由總部、配送中心和若干個門店構成及各自職責,推動藥品零售企業連鎖化、規模化、集約化發展。支持集團內部委托和批零一體化經營,支持藥品零售連鎖企業委托屬于同一集團管理或同一法定代表人的藥品批發企業儲存、配送藥品,支持藥品零售連鎖總部設立遠程藥學服務中心,為公眾提供遠程處方審核、合理用藥指導等藥學服務,實現資源共享、優勢互補。鼓勵藥店設置自助售藥機,提供24小時藥學服務,推進“24小時藥店”在全市優化布局。 (三)統一規范管理,壓實企業責任。加強藥品零售企業規范化管理,提升藥學服務水平,進一步規范“綠十字”燈箱標識懸掛、藥品陳列擺放、從業人員藥學服務行為。藥品零售連鎖總部應當建立健全質量管理體系,統一企業標識、規章制度、計算機系統、人員培訓、采購配送、票據管理、藥學服務標準規范等,對所屬零售門店的經營活動履行管理責任。總部應當加強對所屬零售門店的管理,保證其持續符合藥品經營質量管理規范和統一的質量管理體系要求。 (四)加強信息化建設,提升管理能力。藥品零售企業應具有符合質量管理與追溯要求的信息管理系統。例如:經營血液制品、細胞治療類生物制品的藥品零售企業,應當具備與經營品種相適應的質量保證能力和產品信息化追溯能力。 (五)堅持線上線下一致原則,促進藥品網絡銷售發展。明確藥品零售企業網絡銷售管理相關要求,按照“線上線下一致”原則,加強藥品網絡交易活動監管,落實藥品經營企業主體責任,壓實藥品網絡銷售平臺責任,加強處方藥網絡銷售管理,國家禁止零售和實行特殊管理的藥品不得在網絡上銷售,切實防范用藥安全風險。 四、鼓勵藥品零售企業連鎖化發展有哪些政策? 答:(一)藥品零售連鎖總部對下轄門店持股比例不再限制。對于增加直營門店的,若僅整體變更經營主體或者企業名稱等項目,其經營場所、倉庫地址、質量管理體系等影響質量安全事項未發生變化的,可免現場檢查,將《藥品經營許可證》的經營方式變為“零售(連鎖)”。 (二)藥品零售連鎖總部根據自身業務需要,在滿足藥品經營質量管理規范的要求下,允許選擇不超過2家批發企業進行委托儲存運輸。對于藥品零售連鎖總部委托儲存藥品的,按照變更倉庫地址辦理。 (三)允許藥品零售連鎖總部設置遠程審方中心,通過遠程網絡審方系統為連鎖門店提供在線審方和指導合理用藥服務。鼓勵同一實際控制人或同一集團內的多個連鎖總部共享遠程審方中心。 五、開辦藥品經營企業應當具備哪些條件? 答:在企業開辦條件、藥品質量管理、從業人員資質等方面提出了嚴格的要求,進一步明確藥品零售企業的場地標準、設施設備配備以及藥品采購、儲存、銷售等環節的規范操作。同時,加強對企業日常監督檢查力度,建立健全藥品追溯體系。 從事藥品零售活動,經營處方藥、甲類非處方藥,應當按規定配備依法經過資格認定的藥師或者其他藥學技術人員;有符合要求的營業場所、設備、陳列、倉儲設施以及衛生環境,在超市等其他場所從事藥品零售活動的,應當具有獨立的經營區域;有與其經營藥品相適應的質量管理機構或者人員;有保證藥品質量的質量管理制度、符合質量管理與追溯要求的信息管理系統,符合《藥品經營質量管理規范》要求。 從事藥品零售連鎖經營活動,應當設立藥品零售連鎖總部,對零售門店進行統一管理。藥品零售連鎖總部應當有與其經營范圍相適應的質量管理機構和人員;有依法經過資格認定的藥師或者其他藥學技術人員;具備能夠保證藥品質量、符合要求的倉庫、配送場所和設施設備;有保證藥品質量的質量管理制度以及覆蓋藥品經營、質量控制和追溯全過程的信息管理系統,并符合《藥品經營質量管理規范》要求。 (三)新增2個共性問題 網址: https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/xx-yjj.html 問1:老師您好:對于已上市中成藥,如把該膠囊劑中成藥的膠囊殼變更顏色,其質量標準不變,需要做備案嗎?如備案,是以微小變更來申報嗎?謝謝 答1:網民您好!關于您咨詢的問題,經核實回復如下:為強化藥品上市后變更的指導和服務,我局鼓勵支持持有人在充分研究驗證的基礎上與省局開展溝通交流,針對咨詢內容提及的變更情況,建議結合產品具體特點,與省局進行溝通交流。相關程序按照我局官網發布的《北京市藥品監督管理局關于藥品上市后變更管理溝通有關事項的通知》。北京市藥品監督管理局 2025年2月25日 問2:您好,我公司為某藥品的許可持有人,該藥品有兩種不同規格(批號相同),因代理銷售商不同,我公司擬在其中一種規格的該藥品的包裝上增加兩個銷售商許可我們使用的該銷售商所有的注冊商標,并履行藥監局備案手續,其他兩種規格的該藥品的包裝保持不變,請問是否可以。 答2:網民您好!關于您咨詢的問題,經核實回復如下:《藥品說明書和標簽管理規定》第二十七條規定,藥品說明書和標簽中禁止使用未經注冊的商標以及其他未經國家食品藥品監督管理局批準的藥品名稱。未對同一品種不同規格使用不同商標進行限制,持有人可按照相關法規集結合品種實際情況進行說明書和標簽管理。北京市藥品監督管理局 2025年2月27日




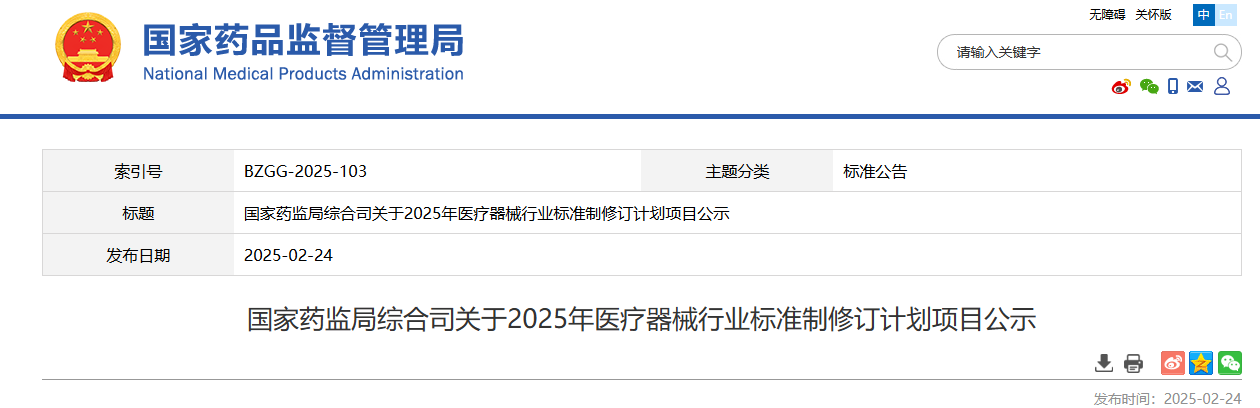
公示時間:國家藥監局發布該公示之日起7日
電子郵箱:mdct@nmpa.gov.cn(郵件主題請注明“2025年行業標準制修訂項目反饋意見”)
附件:1.2025年強制性醫療器械行業標準制修訂項目計劃
2.2025年推薦性醫療器械行業標準制修訂項目計劃





聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容