一、關于將酒石酸艾格司他膠囊納入《以患者為中心的罕見疾病藥物研發試點工作計劃(“關愛計劃”)》試點項目的公示
https://www.cde.org.cn/main/news/viewInfoCommon/1dd3dc2fe02a1e5f77dff31d950ae318依據《以患者為中心的罕見疾病藥物研發試點工作(“關愛計劃”)申報指南》,現將擬納入“關愛計劃”試點項目的基本信息予以公示,公示時間截止至2025年2月28日。工作要點:面向戈謝病患者人群,設計調研問卷,收集國內患者體驗數據以及治療偏好,使用定性、定量方法進行分析。如有異議,請將具體意見發送至郵箱:zhaona@cde.org.cn。
一、國家藥監局關于復方公英膠囊轉換為非處方藥的公告(2025年第17號)
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250219112912133.html根據《處方藥與非處方藥分類管理辦法(試行)》(原國家藥品監督管理局令第10號)規定,經國家藥品監督管理局組織論證和審核,復方公英膠囊由處方藥轉換為非處方藥。品種名單(見附件1)及非處方藥說明書范本(見附件2)一并發布。請相關藥品上市許可持有人于2025年9月30日前,依據《藥品注冊管理辦法》(國家市場監督管理總局令第27號)等有關規定,就修訂說明書事項向省級藥品監督管理部門備案,并將說明書修訂的內容及時通知相關醫療機構、藥品經營企業等單位。非處方藥說明書范本規定內容之外的說明書其他內容按原批準證明文件執行。藥品標簽涉及相關內容的,應當一并修訂。自補充申請備案之日起生產的藥品,不得繼續使用原藥品說明書。雙跨品種的處方藥說明書可繼續使用。二、國家藥監局關于修訂氟尿嘧啶注射劑說明書的公告(2025年第18號)https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypshmshxdgg/20250221114058101.html
根據藥品不良反應評估結果,為進一步保障公眾用藥安全,國家藥監局決定對氟尿嘧啶注射劑說明書內容進行統一修訂。現將有關事項公告如下:
一、所有上述藥品的上市許可持有人均應當依據《藥品注冊管理辦法》等有關規定,按照附件要求修訂說明書,于2025年5月8日前報國家藥監局藥品審評中心或省級藥品監督管理部門備案。修訂內容涉及藥品標簽的,應當一并進行修訂;說明書及標簽其他內容應當與原批準內容一致。在備案之日起生產的藥品,不得繼續使用原藥品說明書。藥品上市許可持有人應當在備案后9個月內對已出廠的藥品說明書及標簽予以更換或以其他形式將說明書更新信息告知患者。二、藥品上市許可持有人應當對新增不良反應發生機制開展深入研究,采取有效措施做好藥品使用和安全性問題的宣傳培訓,指導醫師、藥師合理用藥。三、臨床醫師、藥師應當仔細閱讀上述藥品說明書的修訂內容,在選擇用藥時,應當根據新修訂說明書進行充分的獲益/風險分析。四、患者用藥前應當仔細閱讀藥品說明書,使用處方藥的,應當嚴格遵醫囑用藥。五、省級藥品監督管理部門應當督促行政區域內上述藥品的上市許可持有人按要求做好相應說明書修訂和標簽、說明書更換及說明書更新信息的告知工作,對違法違規行為依法嚴厲查處。
一、浙江省藥品監督管理局
(一)浙江省藥品監督管理局2024年法治政府建設年度報告https://mpa.zj.gov.cn/art/2025/2/20/art_1228989285_58939526.html2024年,省藥監局堅持以習近平新時代中國特色社會主義思想為指導,深入學習貫徹習近平法治思想,全面貫徹落實黨的二十大和二十屆二中、三中全會精神,認真落實省委十五屆五次、六次全會精神,聚焦監管主責主業,統籌發展和安全,統籌效率和公平,統籌監管和服務,全力筑牢藥品安全底線,全力助推醫藥產業高質量發展。一、2024年推進法治政府建設的主要舉措和成效
(一)持續推進法治建設。加強習近平法治思想學習,落實集體學法制度,將習近平法治思想列入省局黨組理論學習中心組專題學習內容,編制年度法治宣傳教育個性工作責任清單。加強業務培訓,組織干部學法用法考試和法制、稽查專題培訓,增強尊法學法用法守法意識。強化執法監督,編制年度行政執法工作計劃,根據法律規章立改廢釋情況動態調整執法事項清單,開展委托下放許可事項實施情況專項監督,組織行政處罰案卷評查和優秀案件交流,切實規范監管執法。全年辦理行政復議案件12件、行政訴訟案件3件,連續七年復議案件零撤銷、訴訟案件零敗訴。(二)持續健全法規制度。根據國家藥監領域法律法規調整情況,完善我省藥品和醫療器械管理地方立法草案內容。主動參與國家藥監局立法工作,研究反饋《藥品管理法實施條例》修訂、醫療器械管理立法、藥品醫療器械質量安全“吹哨人”舉報實施獎勵辦法等征求意見。全面梳理《浙江省醫療機構藥品和醫療器械使用監督管理辦法》所涉罰款事項,聯合省市場監管局印發《浙江省市場監管領域依法不予實施行政強制措施事項清單》,修訂《行政處罰案件負責人集體討論制度》。公布年度重大行政決策事項目錄,全面落實規范性文件合法性審核機制和公平競爭審查制度,嚴把審查關,全年出臺行政規范性文件5件。(三)持續優化營商環境。推動制定藥監領域增值化改革實施方案,制定支持藥品、醫療器械、化妝品3個領域發展舉措,配套出臺“四重”服務、“柔性”服務2個管理辦法和若干改革試點方案,形成“1+3+2+N”藥監政務服務增值化制度體系,相關改革工作多次被國家藥監局推廣。成功爭取國家“優化藥品補充申請審評審批程序改革”試點,成立全國首個由藥監系統內單位承擔的醫療器械產業專利導航基地,全國率先開展藥品生產企業“搬遷一件事”、藥品流通“多倉一體化”、醫療器械“研審聯動”改革試點,提升審評審批質增。2024年,我省獲批的創新藥、國內首仿藥、創新醫療器械和進入國家、省創新審批通道總數位居全國前列,化妝品新原料通過備案量創歷史新高。(四)持續完善監管體系。全國率先成立浙江省藥品安全風險管理控制中心,構建信息傳遞、評估會商、處置轉辦和風險關閉等風險評估閉環機制。深化“1+4+1+X”省市縣協同監管體系,制定加強跨區域跨層級藥品監管協同指導意見,提升省市縣三級監管協同效能。深化“1+11+N”三級藥品檢查體系,探索縣級藥品檢查員隊伍建設新模式,推動設立全省首家縣級藥品檢查中心。深化藥品監管專業能力建設,實施“執法雄鷹”“尖兵領航”等工程,舉辦全省首屆藥品檢查技能競賽、中藥材鑒別職業技能競賽,積極營造“比技術、學技能”的良好氛圍。積極推動長三角跨區域監管協作,簽訂長三角藥品跨省委托生產協同監管合作、藥械化跨省委托生產協同監管信息化項目等協議。(五)持續筑牢安全底線。加強重點品種重點企業重點領域監管,全年開展省級飛行檢查305家次,藥械化抽檢16072批次,監測收集藥械化不良反應報告15.3萬余份。全省12315平臺受理藥品投訴舉報10450件,按期受理率、辦結率均達100%。深化藥品安全鞏固提升暨打假治劣“藥劍”行動,聚焦疫苗監管、網銷監管、醫美整治、中藥材、染發類化妝品等重點領域,嚴查重處違法違規行為。全省全年辦結藥械化違法案件4894件,罰沒款1.22億元,移送公安機關涉嫌犯罪案件51件,6起案件入選國家藥監局典型案例庫,1件入選國家藥監局首批涉嫌犯罪案件移送證據標準案例。承辦國家級醫療器械安全突發事件應急演練,組織省級化妝品安全突發事件應急演練,提升突發事件應急處置能力。(六)持續深化法治宣傳。組織新修訂《中華人民共和國行政復議法》和《藥品監督管理行政處罰裁量適用規則》專題培訓,開展《浙江省優化營商環境條例》宣貫,更新領導干部應知應會黨內法規和國家法律法規清單。開設專欄持續推送新近出臺藥品監管領域相關政策、法律法規文件解讀。開展“《中華人民共和國藥品管理法》頒布40周年”專題宣傳,舉辦“醫療器械‘浙’十年”“‘生態美妝’全國媒體看浙江”等系列主題活動,多方位展現浙江藥械化監管領域創新實踐和亮點成果。二、2025年推進法治政府建設的主要安排
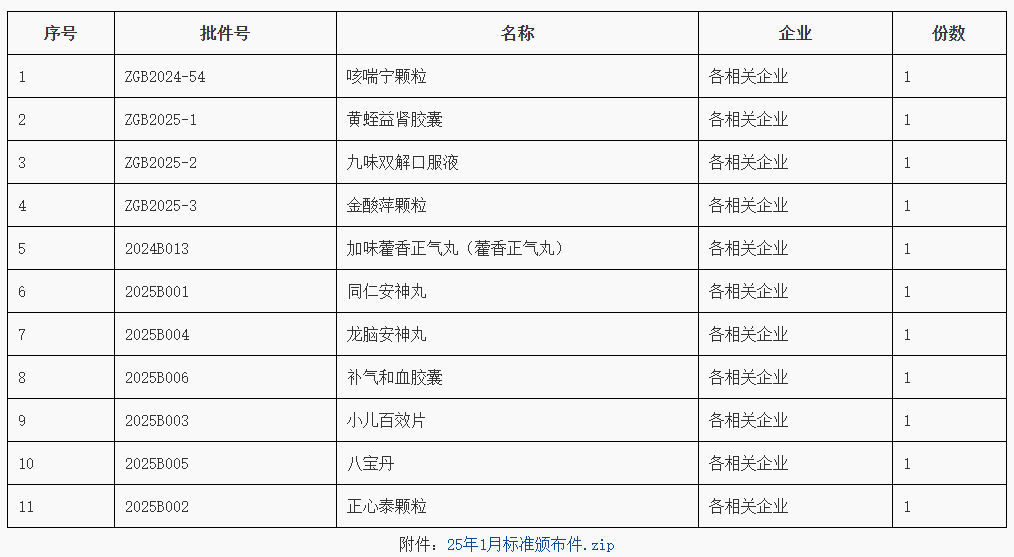
2025年,省藥監局將堅持以習近平新時代中國特色社會主義思想為指導,深入學習貫徹習近平法治思想和習近平總書記關于藥品監管重要指示批示精神,認真落實省委、省政府和國家藥監局各項決策部署,以高標準的法治建設和改革舉措,全面完成藥品安全“十四五”目標任務,加快推進省域藥品監管現代化先行,為高質量發展建設共同富裕示范區貢獻藥監力量。(一)增強法治思維能力。把學習貫徹習近平法治思想,同黨的二十屆三中全會和省委十五屆五次、六次全會精神學習緊密結合起來,用好黨組理論學習中心組學習、干部教育培訓等載體,采用集體學習、專題輔導、集中培訓等多種形式開展學習、指導實踐,持續提升領導干部運用法治思維水平,提高以法治方式推動發展、化解矛盾、維護穩定、應對風險的能力。(二)完善政策制度體系。堅持“以良法促進發展、保障善治”,持續推進藥品醫療器械地方立法調研論證,加強重點領域政策文件立改廢力度。制定年度重大行政決策目錄,完善法律顧問和公職律師參與機制,加強決策風險評估,提高決策質量和效率。強化規范性文件管理,全面落實合法性審核機制和公平競爭審查制度。(三)改革賦能優化服務。圍繞貫徹落實習近平總書記關于藥品監管重要指示批示精神、黨中央國務院和省委省政府決策部署、企業基層群眾“急難愁盼”等,系統謀劃部署推進重大改革項目。積極爭取承接國家藥監局改革創新試點,探索建立藥品技術審評、抽樣核查分級分類管理模式,推進注冊核查和GMP符合性檢查協同開展,推動審評檢查省市聯動試點改革等,加快培育發展新質生產力,推動我省醫藥產業高質量發展。(四)提升行政執法水平。嚴格規范性文件管理、公平競爭審查、重大案件法制審核,動態管理執法人員資格及行政執法事項清單,規范執法水平。嚴格行政執法程序,全面落實行政執法“三項制度”,加強處罰文書釋法說理,持續組織開展案卷評查,提高執法能力。建立行政復議應訴工作制度,構建糾錯案件閉環處置機制,推動行政爭議實質化解,降低執法風險。(五)強化法治宣教實效。落實“誰執法誰普法”普法責任制,制定個性普法計劃,明確任務清單,完善工作體系。加強執法人員依法行政能力培養,全面實施企業落實質量安全主體責任監管規定,有序引導消費者依法維權,營造三方共贏的藥品監管法治環境。創新普法方式,推進“以案釋法”,發布藥監領域典型案例,開展社會熱點案件解讀。高標準做好“八五”普法收關,高質量謀劃“九五”普法規劃。https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25021900281Q:已上市化學藥品在包裝及說明書上增加商標,變更說明書不涉及技術審評的企業聯系方式信息需不需要省局備案?A:網民您好!關于您咨詢的問題,經核實回復如下:根據《已上市化學藥品和生物制品臨床變更技術指導原則》,更新持有人的聯系信息屬于微小變更。《藥品注冊管理辦法》第七十九條規定,藥品包裝標簽內容的變更,持有人應當在變更實施前,報所在地省級藥品監督管理部門備案。北京市藥品監督管理局 2025年2月20日(一)國家藥品標準頒布件(含修訂件、補充頒布件、修訂頒布件)(202501)http://mpa.gd.gov.cn/zwgk/jgsz/zcc/zlbzj/content/post_4669894.html
(一)中檢院公開征求《中藥材及中藥飲片國家藥品標準研究用代表性樣品提交并留存中檢院程序規范(征求意見稿)》意見
https://www.nifdc.org.cn/nifdc/xxgk/ggtzh/tongzhi/202502210846521451748.html為貫徹落實《中藥標準管理專門規定》,中檢院起草了《中藥材及中藥飲片國家藥品標準研究用代表性樣品提交并留存中檢院程序規范(征求意見稿)》,現向社會公開征求意見,請各有關單位于3月10日前將意見反饋至zysbbg@nifdc.org.cn,請在電子郵件主題注明“文件名稱—意見建議反饋”。 附件:《中藥材及中藥飲片國家藥品標準研究用代表性樣品提交并留存中檢院程序規范(征求意見稿)》
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容