近日,Gameto公司宣布其研發(fā)的iPSC療法產(chǎn)品Fertilo已獲得美國食品藥品監(jiān)督管理局(FDA)的新藥臨床試驗申請(IND)批準,將啟動美國首個基于iPSC療法的Ⅲ期臨床試驗。
Fertilo依托Gameto開發(fā)的卵巢支持細胞(OSC)技術,旨在利用iPSC衍生的細胞在體外環(huán)境下促進卵子成熟。與傳統(tǒng)方法相比,F(xiàn)ertilo通過工程化的年輕卵巢支持細胞在培養(yǎng)皿中重現(xiàn)自然卵子成熟過程,從而減少了80%的傳統(tǒng)體外受精(IVF)所需的激素注射,并將治療周期縮短至僅2-3天。這不僅為患者提供了更舒適、更少“體內(nèi)侵入性”的體驗,還顯著降低了卵巢過度刺激綜合征等風險,并減輕了高劑量激素治療帶來的副作用。
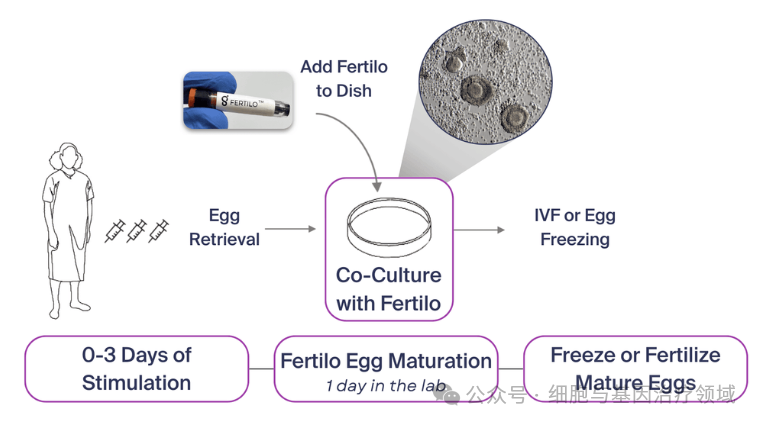
Fertilo療法示意圖(圖源:Gameto公司官網(wǎng))
據(jù)悉,Gameto將在美國15個地區(qū)啟動其Ⅲ期臨床試驗,其研究將采用雙盲、隨機對照試驗。該研究將評估關鍵結果,包括胚胎發(fā)育、妊娠率(作為療效指標)以及母體健康和活產(chǎn)率(作為安全終點)。試驗方案包括最多兩天的激素注射刺激和最多兩次胚胎移植,并向至少一年不孕的夫婦開放招募。
值得一提的是,在該Ⅲ期臨床試驗獲批不久前的2024年12月,秘魯利馬的Santa Isabel診所使用Fertilo技術成功實現(xiàn)全球首例活產(chǎn)嬰兒,研究人員通過將未成熟卵子與Fertilo專有的卵巢支持細胞共培養(yǎng),在實驗室中重現(xiàn)了自然卵子成熟過程,提供了一種更快、更安全、更易獲得的生育解決方案。
通過Fertilo療法出生的第一個嬰兒(圖源:The Blueprint)
Gameto的首席執(zhí)行官兼聯(lián)合創(chuàng)始人Dina Radenkovic博士表示:“FDA批準Fertilo進入Ⅲ期臨床試驗是Gameto的重要里程碑,也是iPSC技術領域的標志性時刻。我們很自豪能夠成為這一領域的先驅(qū)。我要感謝我們的團隊,他們的工作致力于提供一種更少侵入性、改善IVF流程的解決方案。在出生率下降成為全球性挑戰(zhàn)的當下,該為數(shù)百萬人提供了組建新家庭的可能性。”Gameto的聯(lián)合創(chuàng)始人兼董事長、北美最大IVF和生育診所網(wǎng)絡Prelude Fertility的創(chuàng)始人Martin Varsavsky表示:“生育診所一直希望有一種解決方案,使成為父母的過程更短、更安全、更有可能成功。Fertilo的三天IVF和卵子冷凍就是答案。”Gameto的首席科學官Christian Kramme博士表示:“Gameto的技術平臺通過細胞工程技術創(chuàng)新,展示了基于iPSC的療法在卵巢健康及生育護理方面的潛力,為應對生殖健康挑戰(zhàn)開辟了全新道路。”Gameto公司正在積極擴大Fertilo的覆蓋范圍,并已在澳大利亞、日本、阿根廷、巴拉圭、墨西哥和秘魯獲得監(jiān)管批準。該公司最近還宣布與Virtus Health集團旗下的IVF Australia建立戰(zhàn)略合作伙伴關系,以將Fertilo帶給更多患者群體。總結來說,Gameto公司的Fertilo療法通過創(chuàng)新的iPSC技術,為生殖醫(yī)學帶來了革命性的變革。其Ⅲ期臨床試驗的啟動不僅標志著iPSC技術在臨床應用中的重要進展,也為全球數(shù)百萬不孕不育患者提供了新的希望。Fertilo的獨特之處在于其能夠顯著減少激素注射,縮短治療周期,并降低相關風險,從而為患者提供更安全、更舒適的生育解決方案。隨著Gameto在全球范圍內(nèi)的擴展和合作伙伴關系的建立,F(xiàn)ertilo有望在未來成為生殖醫(yī)學領域的一款標準療法,為更多家庭帶來福音。此外,值得一提的是,F(xiàn)ertilo在生殖醫(yī)學領域的突破性成果,還進一步印證了iPSC技術在多種疾病治療中的廣泛應用潛力,展示了該技術在再生醫(yī)學和個性化治療領域的巨大前景。近年來,針對關節(jié)炎、癌癥、自身免疫病等疾病的iPSCs臨床應用也已取得突破,例如:Fate Therapeutics研發(fā)的iPSC衍生CAR-T產(chǎn)品FT819已開展針對紅斑狼瘡的Ⅰ期臨床試驗;Century Therapeutics開發(fā)一款治療復發(fā)/難治性CD19陽性B細胞淋巴瘤的基于iPSC的通用型CAR-iNK療法目前正在開展Ⅰ期ELiPSE-1 臨床試驗;國內(nèi)公司中盛溯源開發(fā)的iPSC衍生NK細胞療法NCR300已開展針對骨髓增生異常綜合征(MDS)和預防急性髓系白血病異基因造血干細胞移植后復發(fā)的Ⅰ/Ⅱ期臨床試驗。此外,該公司針對關節(jié)炎的iPSC衍生MSC細胞治療產(chǎn)品NCR100已進入Ⅱ期臨床試驗,針對間質(zhì)性肺病的iPSC衍生MSC細胞治療產(chǎn)品NCR101已于近日獲批IND;國內(nèi)公司啟函生物研發(fā)的iPSC衍生CD19 CAR-iNK細胞療法QN-019a正在開展治療非霍奇金淋巴瘤的1期臨床試驗。
聲明:本文系藥方舟轉載內(nèi)容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容



