
2021-03-22 11:03:30來源:康橙投資瀏覽量:1401
至今還清晰記得報考研究生選專業的時候自己非常堅決地選擇了藥物化學,在我當時有限的書本知識范圍里,小分子靶向藥物的春天就要來了,而我蠢蠢欲動,想做那“站在風口的豬”。研究生入學是2014年,也正是PD-1單抗上市的元年,BMS的Opdivo(O藥)與MSD的Keytruda(K藥)相繼成功上市,并以摧枯拉朽之勢迅速拿下多個腫瘤適應癥。再到后來基因療法、細胞療法等多種創新生物技術的層出不窮,我想可能很多從事小分子藥物研發的人和我一樣如坐針氈,這也迫使我在五年研究生階段一直到后來參加工作都在思考小分子藥物“尚能飯否”這個問題。關于這個問題,我和同學、同事以及導師都有過多次激烈的討論,終究也沒有誰能完全說服對方,小分子藥物與生物創新療法(包括抗體、基因療法、細胞療法等)的博弈,到底是“愈久彌香”還是“長江后浪拍前浪”,我想結論還是留給時間來檢驗。
回顧創新藥近20年的銷售數據,我們發現在2000年全球銷售額Top10創新藥中8個為小分子藥物,從2008年開始Top10銷售額創新藥中的小分子藥物開始小于等于5個,到2019年Top10中僅有4個為小分子,小分子藥物逐步失去了銷售額的頭把交椅,在整體銷售額中的占比也呈現逐步下降趨勢。在眾多潛力生物技術療法的沖擊下,小分子藥物的市場正在逐步被侵蝕,更有悲觀者擔憂隨著層出不窮生物療法的涌現,小分子藥物是否可能最終逐步退出歷史的舞臺。
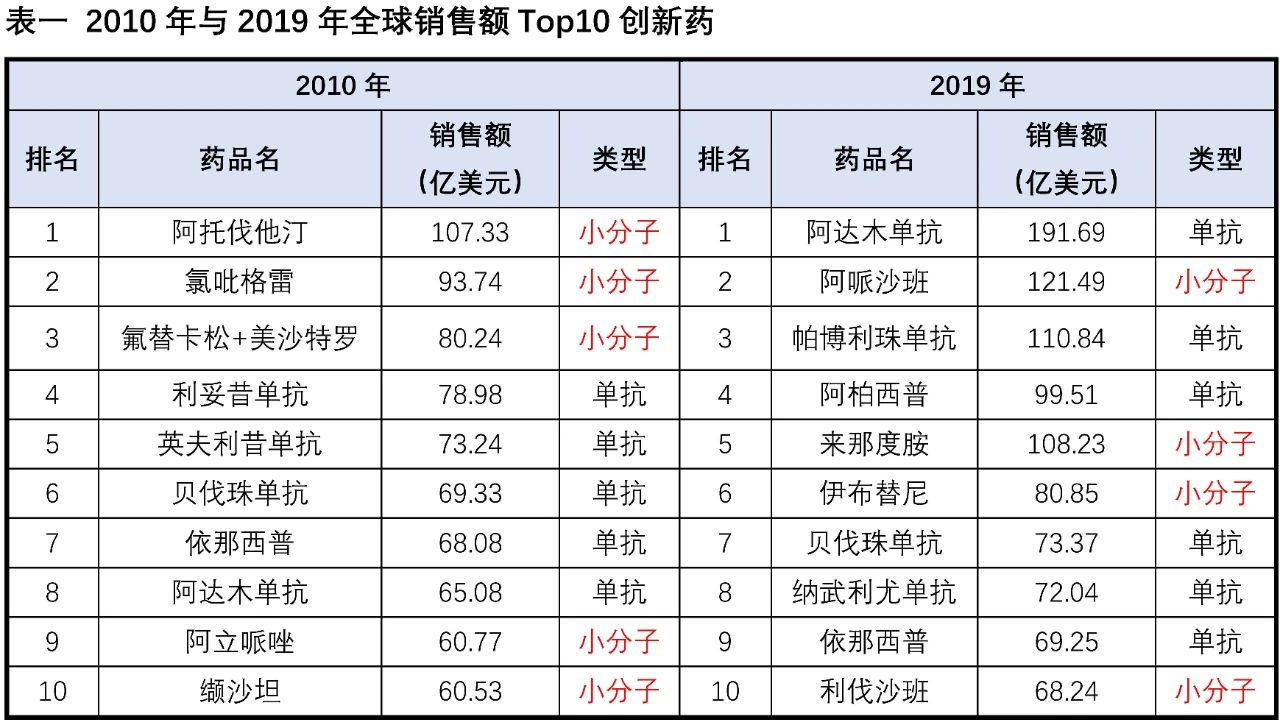
小分子藥物從最早罌粟中的嗎啡、柳樹中的水楊酸到上個世紀出現歷史上第一個年銷售額超10億美元的“重磅炸彈”藥物-地西泮,到2001年第一個針對癌細胞特定基因突變的靶向小分子藥格列衛,再到如今有獲批超過60個的激酶抑制劑小分子,小分子藥物的開發經歷了輝煌的歷史。從2005-2020年FDA批準的新藥統計數據可以看出,新分子實體(即小分子藥物)的占比從2005的90%左右,逐步下降到70%附近,并呈現進一步緩慢下降的趨勢。小分子藥物的開發貌似進入了“前狼后虎”的困境期,當前小分子藥物的開發不僅受限于新靶點發現與小分子庫多樣性的增速逐年降低,使得小分子藥物的開發一直保持相對較低的成功率(小分子靶向藥物成功率均值約為11%,腫瘤藥物的成功更是低至5%),同時還受到抗體、基因療法、細胞療法、ADC、溶瘤病毒等眾多創新生物技術對相同適應癥市場的圍住堵截。在尚未充分開拓的適應癥市場(包括各類罕見病),新開發的生物技術療法同樣表現出非常好的潛力與優勢,如血友病(雙抗藥物Hemlibra與基因療法ValRox)、地中海貧血癥(基因療法Zyntegl)、三陰性乳腺癌(ADC藥物-Sacituzumab Govitecan)、家族性淀粉樣多發性神經病變(siRNA藥物-Patisiran)等。

在巨大的醫藥市場與強大的社會責任感的驅使下,全球主要經濟體都在竭盡所能努力發展生物醫藥產業,各種創新生物技術療法如雨后春筍般涌現,為廣大的病患帶來更多恢復健康、延長壽命的選擇。目前已經有成功上市產品的生物技術療法包括抗體藥物、ADC、CAR-T細胞療法、基因療法、RNA藥物、溶瘤病毒等,其中抗體藥物的發展最為成熟,以2019年為例,銷售額Top10中有6個為抗體藥物。下表我們以小分子藥物與抗體藥物的對比為例,來探討小分子藥物與創新生物技術的優劣勢。
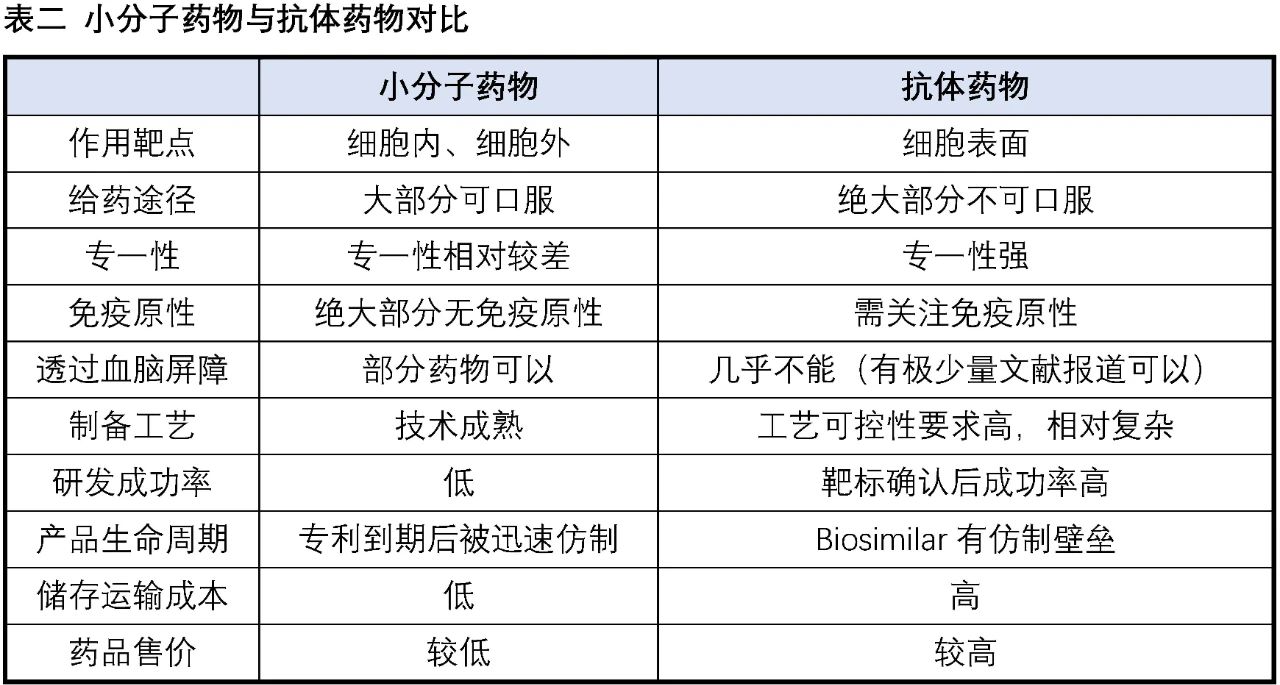
相對大分子抗體藥物等生物技術,小分子藥物的優勢:
(1)大部分的小分子藥物可以口服,給藥方便,相比之下絕大部分的生物技術產品都采用注射類給藥方式,患者依從性差。
(2)小分子藥物能很好地作用于細胞內(包括細胞核內靶點)與細胞外的靶點。
(3)部分小分子藥物能通過血腦屏障,可用于腦部疾病治療,目前作用于中樞神經體統的藥物依然以小分子為主。
(4)小分子藥物對儲存環境的敏感性相對較低,儲存運輸方便。
(5)幾乎沒有免疫原性,生物技術產品如抗體、基因治療的AAV病毒等都有可能被免疫系統識別為抗原激發免疫反應。
(6)小分子藥物相對更容易實現差異化,這受益于小分子藥物眾多且相對成熟的靶點,同時針對小分子進行的微小改動往往能收獲意向不到的效果(如代謝改善、選擇性提高、毒性降低等)。相比之下生物技術相關療法的起步相對較晚,技術相對不是那么成熟,從而使得同一技術在相同領域容易出現嚴重的同質化現象,如“百家爭鳴”的PD-1/PD-L1抗體、CD-19-CAR-T細胞療法(這兩個產品的國內臨床試驗登記項目數量都超過了100家)。
相對大分子抗體藥物等生物技術,小分子藥物的劣勢:
(1)對于沒有適合作用口袋的靶點較難開發,比如蛋白質-蛋白質相互作用界面一般大而平坦,沒有很好的口袋容納小分子,而利用大分子藥物比如擁有類似作用面的抗體來干擾卻特別有效。
(2)特異性不高,小分子藥物由于結構相對較小,往往容易對多個靶點有活性,這也是許多小分子藥物副作用大的原因。
(3)半衰期短,往往需要一日一次甚至一日多次服用。
(4)開發成功率較低,以抗體藥物為例的整體研發成功率約為20%,相比之下小分子藥物整體研發成功率僅為約11%。
(5)制備工藝相對簡單成熟。這一點既是優勢也是劣勢,相對簡單成熟的制備工藝使得小分子藥物的生產成本遠低于其他生物技術產品,同時正是相對簡單成熟的制備工藝,當一種小分子藥物的專利到期時,仿制藥能以相對低廉的成本搶占原研市場,造成小分子藥物的“專利懸崖”。
小分子藥物作為最傳統的藥物形式,雖然當前的發展遇到一些困境,但也有其難以替代的優勢。ADC、細胞療法、基因治療等新藥物形式正在逐步興起,在多個治療領域表現自己獨到的優勢和驚人的潛力,但同時也面臨著各自的嚴峻挑戰,相信在不久的將來也會是多種藥物形式共存的競爭格局,各類療法的追隨者也會努力在自己的領域尋求突破。
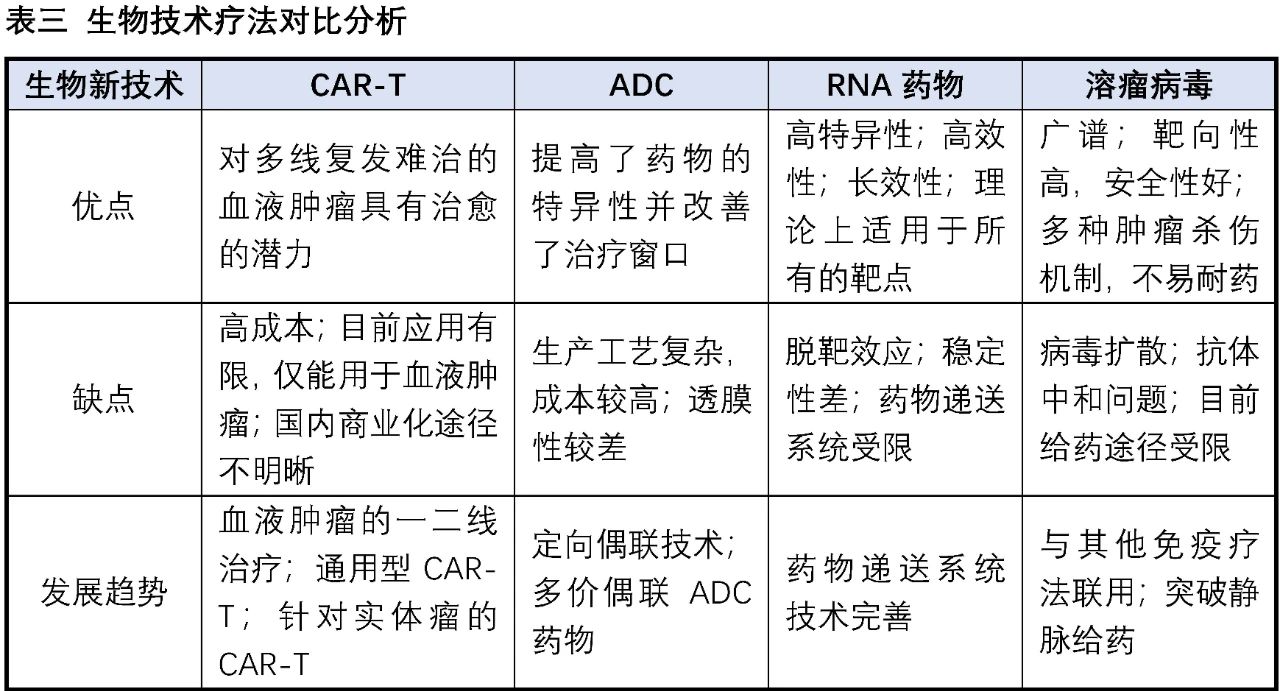
三、 小分子的出路—“長出一個小翅膀,就能飛得更高”
“站在風口上豬都能飛起來”后面其實還有下半句—“長出一個小翅膀,就能飛得更高”。小分子藥物作為曾經“站在風口的豬”,當前的發展雖然遭遇困境,但是只要在某些關鍵點做出新的突破,為自己加上一個小翅膀,我想小分子藥物的未來當然可以更高更遠。隨著分子生物學、結構生物學的快速發展,小分子藥物發現進入基于靶點的藥物設計的時代,我們能夠基于某個靶點進行高通量篩選,可以獲得小分子和靶蛋白的復合晶體結構,在計算機的輔助下進行合理優化,藥物的研發變得如此清晰。高通量篩選(High Throughput Screening,HTS)、虛擬篩選(Virtual Screening)、基于結構的藥物設計(Structure-based Drug Design,SBDD)以及基于片段的藥物設計(Fragment-based Drug Discovery,FBDD)逐漸成為小分子藥物研發的常見技術。這些技術取得了很大的成功,也仍然在不斷豐富和發展中,然而小分子藥物發現的效率并沒有如人們期待的那樣大幅提高。近幾年小分子領域也在出現諸多新的思路,實現新的突破,小編認為小分子可能在如下幾個方面實現突破:PROTAC技術、分子膠、變構調節、老藥新用。
PROTAC(Proteolysis Targeting Chimera,蛋白降解靶向嵌合體)是一種雙功能小分子,由靶蛋白配體和E3泛素連接酶配體通過Linker連接得到,利用泛素-蛋白酶系統識別、結合并降解疾病相關的靶蛋白。該技術最早由Raymond Deshaies等人在2001年提出,理論上可以將任何過表達和突變的致病蛋白清除,從而治療疾病。
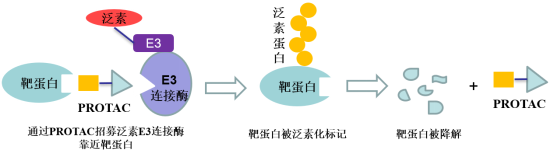
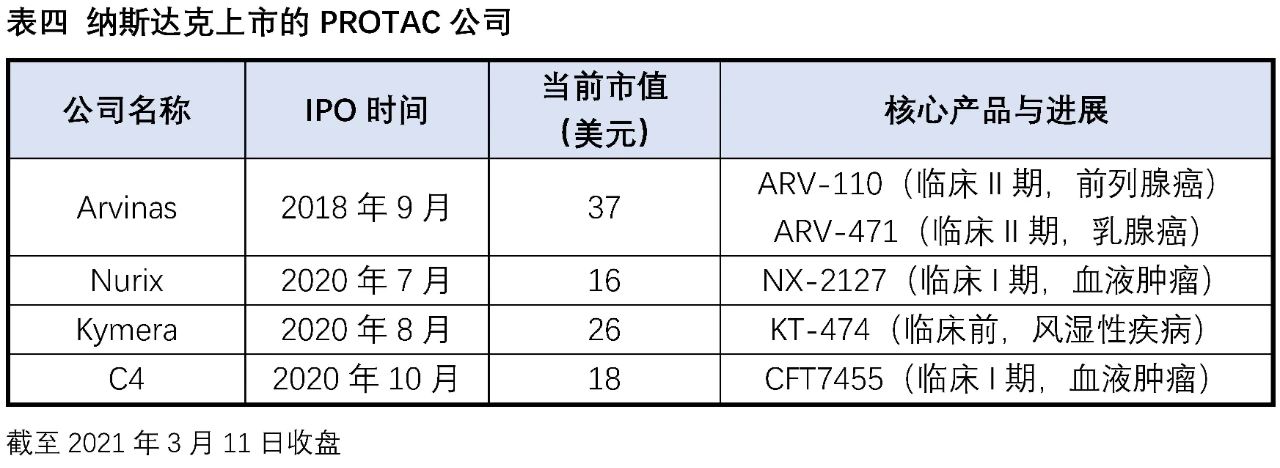
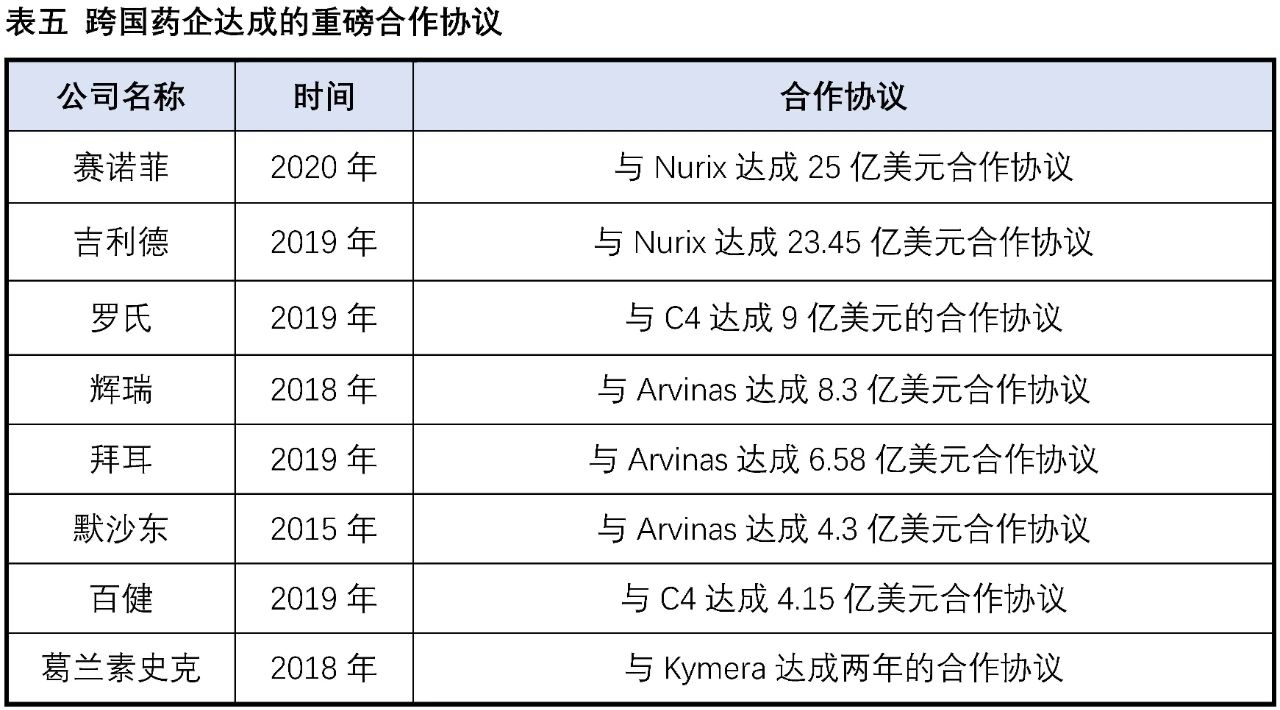
實際在臨床上也有部分藥物被意外發現具有降解靶蛋白的作用:比如乳腺癌治療藥物氟維司群可以降解雌激素受體;來那多胺可以特異性降解轉錄因子IKZF1和IKZF3;第三代EGFR抑制劑奧希替尼也能選擇性誘導EGFR-T790M的降解。這些意外的發現沒有普適性,也較難通過合理設計來得到。PROTAC作為主觀設計的降解靶標蛋白的小分子,在腫瘤、自身免疫性疾病領域已經取得了驚人的進展,同時在“不可成藥靶點”與當前療法耐藥患者治療中表現出巨大的潛力,獲得了科學界和資本市場的廣泛認可,目前已有多家PROTAC公司登陸納斯達克,多家跨國藥企也積極參與布局該賽道,達成了多筆重磅合作協議。PROTAC技術戴著“明星光環”前行,是否能夠帶領小分子藥物再度崛起,取決于未來幾年相關產品的臨床進展。
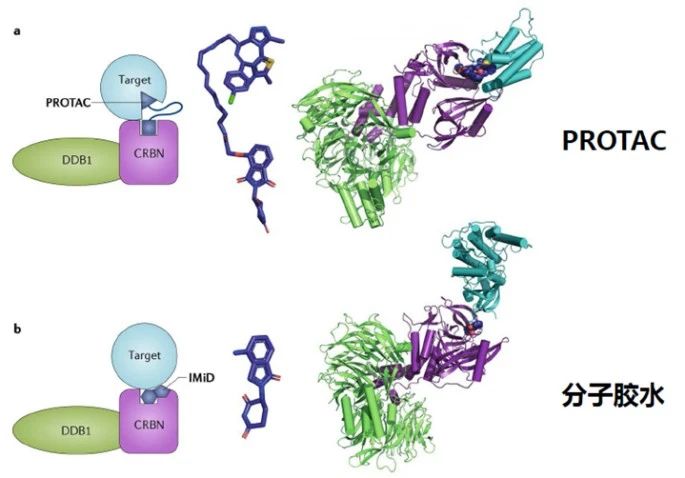
分子膠(Molecular Glues)是一類可以誘導或穩定蛋白質間相互作用的小分子化合物。當其中一個蛋白質分子為泛素連接酶時,分子膠可以引起另外一個蛋白質發生泛素修飾,并通過蛋白酶體途徑發生降解,與PROTAC有異曲同工之妙。經典的分子膠降解劑如沙利度胺類似物和芳基磺酰胺類抗癌藥Indisulam等都是利用E3泛素連接酶與靶蛋白之間的互補蛋白-蛋白作用界面,重編程泛素連接酶的選擇性,以催化劑的方式驅動靶點泛素化。因此,分子膠也巧妙地避開了傳統抑制劑的局限性,使得一部分靶點從“無成藥性”變為“有成藥性”,同時分子膠相比PROTAC有更小的分子量,理論上會有更好的成藥性。早期發現的分子膠也多是偶然所得,近年來主動設計的分子膠也取得了不錯的進展。2020年11月,禮來制藥與萬春醫藥子公司萬春Seed完成簽署總金額達到7.9億美元的合作,將借助Seed自主研發的獨特分子膠蛋白降解專利技術開發候選新藥。2020年12月,分子膠技術公司Neomorph宣布完成1.09億美元的A輪融資,用以推進專有的靶向蛋白降解平臺以及相關項目的發展。同月,勃林格殷格翰也在分子膠領域有所布局,與Proxygen簽訂了合作和授權協議,共同開發靶向多種致癌靶點的分子膠降解劑。2021年3月,Monte Rosa Therapeutics宣布完成9500萬美元的C輪融資用于將其主要分子膠產品推入臨床,加速管線發展并增強平臺能力。
變構調節(Allosteric Regulation)通過特異性影響蛋白構象變化,從而將其穩定在某個非活化或活化狀態,這與傳統的底物競爭性抑制劑比如ATP競爭性激酶抑制劑有所不同。變構調節中有一個有趣的“胖子理論”,以激酶抑制劑設計為例,激酶底物比如ATP與酶活性中心結合緊密,就像是一個胖子坐在一把椅子上。傳統的競爭性抑制劑要把這個胖子拉起來,需要更大的力氣,也就是更高的親合力。而變構抑制劑則是在椅子的某處扎了一根釘子,胖子自己就跳起來了,并不需要多大的力氣。變構調節因為其“四兩撥千斤”的獨特機制,不僅具有更好的選擇性、安全性和克服耐藥的潛力,還能使得一部分靶點從“無成藥性”變為“有成藥性”,引起了眾多科研機構和制藥企業的重點關注。隨著結構生物學的發展,變構位點的確認變得相對容易,也進一步推動了變構調節小分子藥物的開發。
諾華的BCR-ABL1變構抑制劑Asciminib,與BCR-ABL1蛋白的肉豆蔻酰基位點結合(非ATP結構位點),通過不同于其他BCR-ABL1激酶抑制劑的機制將BCR-ABL1鎖定為無活性構象。Asciminib在用于曾接受過兩種以上酪氨酸激酶抑制劑(TKI)治療,并且對最近接受的TKI治療產生耐藥性或不耐受的慢性髓系白血病(CML)患者的3期臨床試驗的初步分析中達到主要臨床終點,并于近期獲得FDA授予的2項突破性療法(Breakthrough Therapy)資格。最近兩年比較火熱的KRAS抑制劑(如AMG510,臨床III期,已提交上市申請)、SHP2抑制劑(TNO155,臨床II期)都是相應靶點的變構抑制劑,均是“不可成藥靶點”的偉大突破。
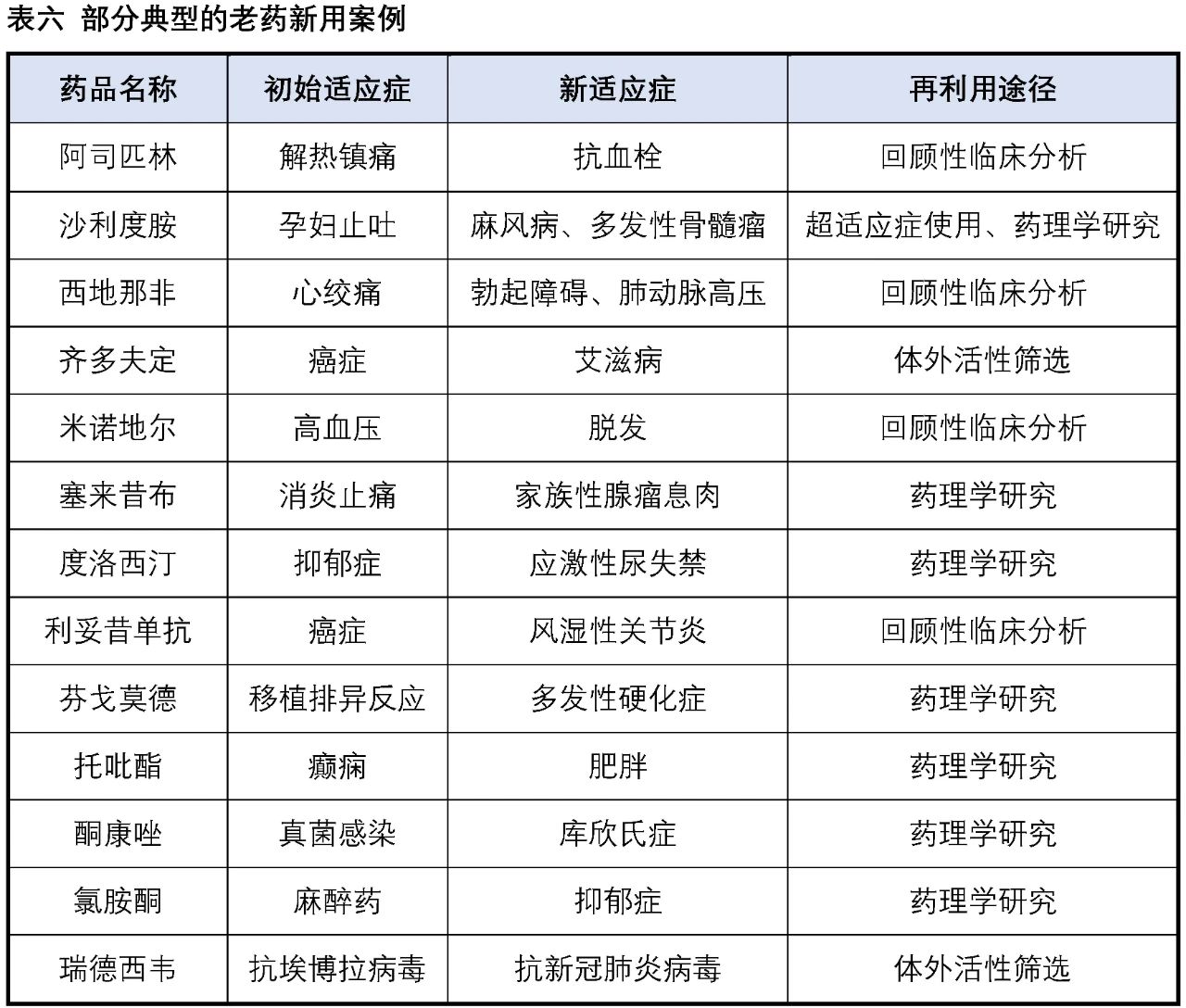
“The best way to discover a new drug is to start with an old one”,這是1988年諾貝爾生理學或醫學獎獲得者藥理學家James Black提出的,簡而言之就是“老藥新用”。“老藥”是指已上市的藥物或正在進行臨床試驗的藥物,“新用”是指發現在新的適應癥上使用這些藥物。
阿司匹林于1899年在美國被發明,作為解熱鎮痛藥的應用已有百余年,隨著臨床研究的不斷深入,阿司匹林的許多新功效和新作用逐漸被發現,特別是其心血管疾病預防和治療中的作用。《中國心血管病預防指南(2017)》中開始將低劑量阿司匹林作為心血管疾病預防的基礎藥物。臭名昭著的沙利度胺同樣也是老藥新用的經典案例,20世紀50年代沙利度胺(商品名:反應停)成功在歐洲上市,在短短幾年時間里就造成了全球上萬例新生兒畸形(海豹胎),成為藥物史上最大的悲劇之一,使得該藥品于1963年被迫退市。1964年醫生在給麻風病患者使用時,結果意外發現沙利度胺可以有效地減輕患者的皮膚癥狀。20世紀90年代又陸續發現了抗炎、抗腫瘤作用,1998年沙利度胺被FDA批準用于多發性骨髓瘤的治療。西地那非(商品名:萬艾可)最初開發是用于擴張心血管平滑肌以擴張血管治療心絞痛,但是療效不盡人意,同樣的作用機制,臨床上發現其對陰莖海綿體平滑肌的舒張作用卻很顯著。1998年,FDA正式批準西地那非用于勃起功能障礙治療。
資料來源:康橙投資
在氘代藥物、共價抑制劑、多肽藥物等發展相對成熟的技術方面,小分子藥物也很有可能迎來突破。隨著人工智能(AI)技術的不斷成熟以及在新藥研發中的不斷滲透,人工智能在靶點發現、苗頭化合物與先導化合物發現、藥物分子合成路線設計、疾病模型建立、新適應癥挖掘等諸多方面助力新藥研發,將大大提高新藥的研發效率。近日,AI制藥巨頭強強聯合,Roivant擬以20.5億美元收購Silicon Therapeutics(首付款4.5億美金+里程碑付款);國內互聯網巨頭BAT(百度、阿里、騰訊)近年來也投入大量精力積極布局AI藥物發現,相信借助人工智能技術不論是小分子藥物還是大分子藥物都能迎來蓬勃發展的時機。小分子藥物有其難以替代的優勢,它的發展也是困境與突破交替輪動的歷史,隨著各種新科技的不斷涌現,我們也期待能有更多的“黑科技”助力小分子藥物研發的突破,給世界帶來更多的驚喜。
勇當主角,甘當配角。小分子藥物在藥物發展史的中一直擔任“主角”,隨著各種生物技術療法的日益豐富與成熟,疾病的治療手段必然會呈現百花齊放的趨勢。近年來聯合用藥也逐漸成為臨床試驗發展的趨勢,特別是腫瘤免疫療法的興起,更是進一步推動了聯合用藥方案的嘗試與突破。我想未來在某些疾病領域小分子藥物依然會是“主角”,在另一些領域小分子藥物可能真的會逐步被取代直至淘汰,在更多的領域將是小分子藥物與生物技術療法的“強強聯合”,從而更好地為患者排憂解難。
作者簡介
郭祖浩 博士
來源:康橙投資
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!