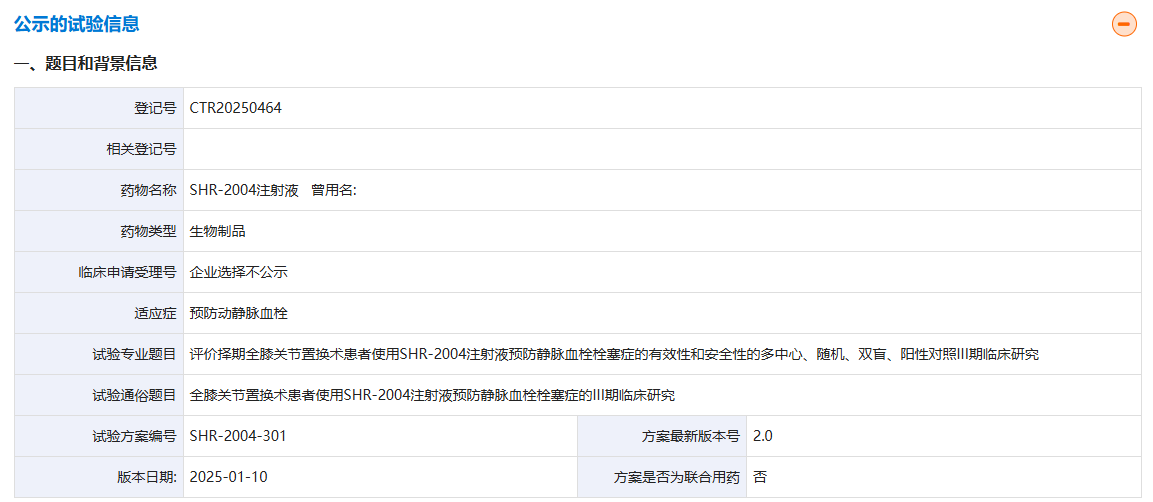
2月12日,藥物臨床試驗登記與信息公示平臺顯示,恒瑞醫(yī)藥啟動了新型抗凝藥SHR-2004的首個III期臨床試驗。SHR-2004是一種靶向凝血因子XI(FXI)的人源化單克隆抗體,可選擇性結(jié)合FXI和凝血因子XIa(FXIa),阻礙凝血因子XIIa(FXIIa)對FXI的激活,從而阻斷內(nèi)源性凝血途徑的級聯(lián)反應(yīng)過程,發(fā)揮抗凝作用。臨床前研究顯示,SHR-2004可以延長活化部分凝血活酶時間(一種血液檢測方法,用于評估血液的凝血功能),抑制FXI活性。2023年12月,恒瑞醫(yī)藥在美國血液學(xué)(ASH)年會上公布了SHR-2004的I期健康人研究結(jié)果。結(jié)果顯示,SHR-2004靜脈給藥組的Tmax中位數(shù)為1.76-2.79h,皮下給藥組Tmax中位數(shù)為4.0-6.5天;SHR-2004靜脈給藥組的消除半衰期(t1/2)幾何均值為12.4-13.2天,皮下給藥組為11.7~12.0天。
本次啟動的III期研究是一項多中心、隨機、雙盲、陽性藥物對照臨床試驗(n=1167),旨在評估接受全膝關(guān)節(jié)置換術(shù)后的成人患者使用SHR-2004(皮下注射,120mg,用藥1次或靜脈輸注1次,90mg,用藥1次)或依諾肝素鈉(皮下注射,40mg,用藥12-14次)或安慰劑預(yù)防靜脈血栓栓塞癥(VTE)的有效性和安全性。研究的主要終點為VTE和全因死亡的發(fā)生率(有效性指標)以及符合大出血和臨床相關(guān)非大出血事件的復(fù)合終點發(fā)生率(安全性指標)。目前,全球尚無FXI/FXIa抑制劑上市,但已有abelacimab(諾華)、asundexian(拜耳)、milvexian(強生/BMS)、SHR-2004四款產(chǎn)品處于III期階段,其中asundexian和milvexian為小分子藥物。
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容