一、關于在2025年部分法定節假日前后增加受理靠前服務的通知
https://www.cde.org.cn/main/news/viewInfoCommon/a4a04e60de18f3b66176c7bdff9fb2f3為進一步鼓勵藥物研發創新,加快新藥好藥上市,加大為民服務力度,降低春節、國慶等法定節假日對受理靠前服務的影響,我中心將在2025年春節前增加1次受理靠前服務,時間為1月26日,在國慶節前后增加2次受理靠前服務,時間為9月28日和10月11日。具體辦理流程及要求等仍按照《關于對創新藥以及經溝通交流確認可納入優先審評審批程序和附條件批準程序的品種開展受理靠前服務的通知》執行。二、國家藥監局藥審中心關于發布《放射性治療藥物申報上市臨床風險管理計劃技術指導原則》的通告(2025年第5號)https://www.cde.org.cn/main/news/viewInfoCommon/4e06738459b4547055d86fb2df09db72為指導放射性治療藥物申報上市時如何進行風險管理,藥審中心組織制定了《放射性治療藥物申報上市臨床風險管理計劃技術指導原則》(見附件)。根據《國家藥監局綜合司關于印發藥品技術指導原則發布程序的通知》(藥監綜藥管〔2020〕9號)要求,經國家藥品監督管理局審查同意,現予發布,自發布之日起施行。附件:放射性治療藥物申報上市臨床風險管理計劃技術指導原則

......
一、國家藥監局關于修訂人血白蛋白注射劑說明書的公告(2025年第5號)
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypshmshxdgg/20250113163308103.html根據藥品不良反應評估結果,為進一步保障公眾用藥安全,國家藥監局決定對人血白蛋白注射劑說明書內容進行統一修訂。現將有關事項公告如下:一、上述藥品的上市許可持有人應當依據《藥品注冊管理辦法》等有關規定,按要求修訂說明書(見附件),于2025年4月8日前報國家藥監局藥品審評中心或省級藥品監督管理部門備案。修訂內容涉及藥品標簽的,應當一并進行修訂;說明書及標簽其他內容應當與原批準內容一致。在備案之日起生產的藥品,不得繼續使用原藥品說明書。藥品上市許可持有人應當在備案后9個月內對已出廠的藥品說明書及標簽予以更換,或者以其他適當形式將更新信息告知患者。
二、 藥品上市許可持有人應當對新增不良反應發生機制開展深入研究,采取有效措施做好藥品使用和安全性問題的宣傳培訓,指導醫師、藥師或者患者合理用藥。三、 臨床醫師、藥師應當仔細閱讀上述藥品說明書的修訂內容,在選擇用藥時,應當根據新修訂說明書進行充分的獲益/風險分析。
四、 患者用藥前應當仔細閱讀藥品說明書,使用處方藥的,應當嚴格遵醫囑用藥。
五、 省級藥品監督管理部門應當督促行政區域內上述藥品的上市許可持有人,按要求做好相應說明書修訂和標簽、說明書更換及說明書更新信息的告知工作,對違法違規行為依法嚴厲查處。二、國家藥監局關于解郁安神膠囊和解郁安神顆粒轉換為非處方藥的公告(2025年第3號)https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250115093122185.html根據《處方藥與非處方藥分類管理辦法(試行)》(原國家藥品監督管理局令第10號)規定,經國家藥品監督管理局組織論證和審核,解郁安神膠囊和解郁安神顆粒由處方藥轉換為非處方藥。品種名單(見附件1)及非處方藥說明書范本(見附件2)一并發布。
請相關藥品上市許可持有人于2025年9月30日前,依據《藥品注冊管理辦法》(國家市場監督管理總局令第27號)等有關規定,就修訂說明書事項向省級藥品監督管理部門備案,并將說明書修訂的內容及時通知相關醫療機構、藥品經營企業等單位。非處方藥說明書范本規定內容之外的說明書其他內容按原批準證明文件執行。藥品標簽涉及相關內容的,應當一并修訂。自補充申請備案之日起生產的藥品,不得繼續使用原藥品說明書。雙跨品種的處方藥說明書可繼續使用。
特此公告。
附件:1.品種名單
2.非處方藥說明書范本三、國家藥監局關于同意成都市藥品檢驗研究院作為锝標記及正電子類放射性藥品檢驗機構的通告(2025年第5號)https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20250115160631171.html根據《放射性藥品管理辦法》《國家藥監局關于發布锝標記及正電子類放射性藥品檢驗機構評定程序的公告》(2024年 第21號)有關規定,經組織考核評審,成都市藥品檢驗研究院基本符合锝標記及正電子類放射性藥品檢驗機構的條件。現將有關事項通告如下:一、國家藥監局同意成都市藥品檢驗研究院為锝標記及正電子類放射性藥品檢驗機構,成都市藥品檢驗研究院應按《國家藥監局關于進一步加強放射性藥品管理有關事宜的通告》(2022年 第5號)要求,開展锝標記及正電子類放射性藥品的檢驗工作。二、成都市藥品檢驗研究院承擔四川省行政區域內及中國食品藥品檢定研究院委派的锝標記及正電子類放射性藥品的檢驗工作,其出具的檢驗報告可用于企業生產許可及醫療機構備案。三、成都市藥品檢驗研究院應持續加強能力建設,在中國食品藥品檢定研究院的指導下,不斷提高管理能力和技術水平,保障锝標記及正電子類放射性藥品檢驗工作順利開展。成都市藥品檢驗研究院應定期向中國食品藥品檢定研究院、四川省藥品監督管理局報告檢驗情況。
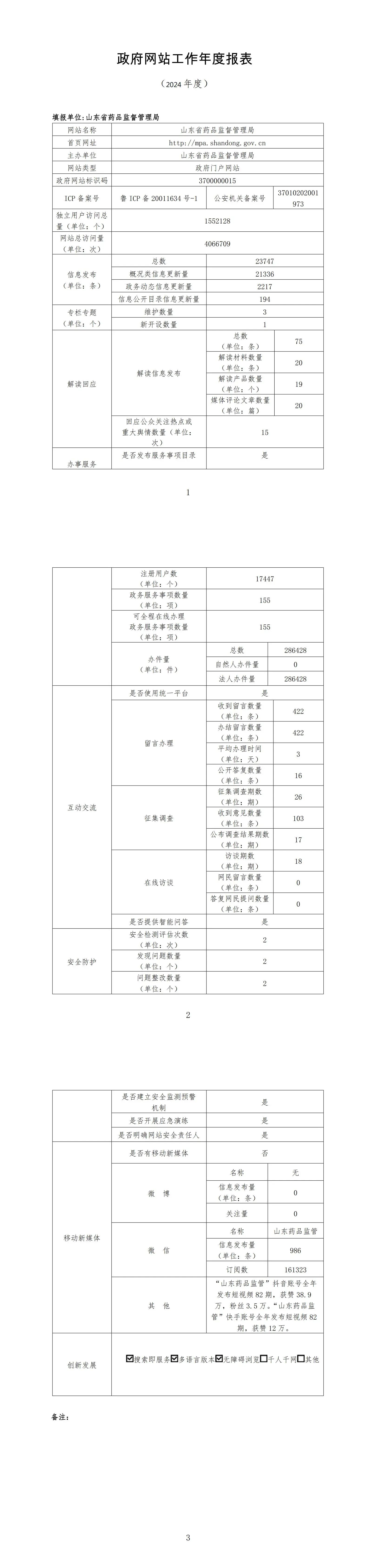
特此通告。https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20250117152300120.html(一)山東省藥品監督管理局政府網站工作年度報表 (2024年度)http://mpa.shandong.gov.cn/art/2025/1/13/art_101747_10408480.html
(二)關于認真執行國家藥品標準有關修訂件、頒布件的通知(2025年1月13日更新)http://mpa.shandong.gov.cn/art/2025/1/13/art_101747_7687320.html為加強藥品監督管理,保證藥品質量,國家食品藥品監督管理局陸續頒布了有關品種的《國家藥品標準修訂件》、《國家藥品標準補充頒布件》(以下簡稱《藥品標準》)。為做好我省藥品標準執行工作,現將有關事宜通知如下:一、省局網站近期將設立“國家藥品標準”專欄,將陸續轉載我局收到的《藥品標準》,請相關單位實時關注,省局不再另行書面通知。二、請及時通知轄區內藥品檢驗機構、藥品生產企業等相關單位按照新頒布的有關《藥品標準》的要求認真執行。三、各市局要高度重視,對轄區內藥品檢驗機構、藥品生產企業等相關單位執行情況進行監督檢查,督促其貫徹落實,確保藥品質量安全。執行中遇到的相關問題,請及時反饋至省局藥品注冊處。(三)山東省藥品監督管理局關于公開征求《山東省實施中藥材生產質量管理規范指導手冊(征求意見稿)》意見的通知http://mpa.shandong.gov.cn/art/2025/1/14/art_101797_10408838.html為深入貫徹落實國家藥監局、農業農村部、國家林草局、國家中醫藥局聯合發布的《中藥材生產質量管理規范》,指導幫助我省企業建立符合中藥材生產質量管理規范要求的質量管理體系,我局組織起草了《山東省實施中藥材生產質量管理規范指導手冊》(征求意見稿),供企業參考使用,現公開征求意見。請將有關意見于2025年2月13日前反饋至郵箱ypshengchanchu@shandong.cn。附件:山東省實施中藥材生產質量管理規范指導手冊(征求意見稿)(一)關于江蘇省藥品監督管理局審評核查南京分中心增項賦權有關事項的公告(2025年 第1號)http://da.jiangsu.gov.cn/art/2025/1/13/art_84622_11471603.html為貫徹落實省政府關于推動醫藥產業高質量發展的部署要求,根據《江蘇省藥品監督管理局審評核查分中心考核與賦權實施辦法(試行)》,現決定自2025年1月20日起向江蘇省藥品監督管理局審評核查南京分中心賦權三類審評事項16項、三類核查事項34項(詳見附件)。附件:江蘇省藥品監督管理局審評核查南京分中心增項賦權事項清單.pdf(一)浙江省藥品監督管理局關于開展優化藥品補充申請審評審批程序改革試點工作的公告https://mpa.zj.gov.cn/art/2025/1/14/art_1228989285_58939256.html經國家藥品監督管理局同意,浙江省獲批開展優化藥品補充申請審評審批程序改革試點工作。為貫徹落實國務院關于全面深化藥品醫療器械監管改革促進醫藥產業高質量發展的有關部署,根據省委省政府關于因地制宜發展新質生產力打造現代化產業體系的有關決策,持續深化藥品審評審批制度改革,提升藥品審評審批效能,切實做好試點工作,現將有關事項公告如下:一、改革目標
按照《國家藥監局關于印發優化藥品補充申請審評審批程序改革試點工作方案的通知》(國藥監藥注〔2024〕10號)要求,遵循“提前介入、一企一策、全程指導、研審聯動”的原則,為浙江省內化學原料藥登記人/藥品上市許可持有人(以下簡稱登記人/持有人)藥品重大變更補充申請申報前提供前置指導、核查、檢驗和立卷服務,推動需要核查檢驗的補充申請審評時限由200個工作日縮短為60個工作日。二、前置服務范圍
前置服務范圍為化學藥品(包括原料藥)上市后藥學重大變更(藥學重大變更需開展臨床研究的,變更原料藥、輔料、藥包材供應商且變更后產品登記狀態為“I”的,以及一致性評價申請不屬于試點前置服務范圍)。三、前置服務部門
浙江省藥品化妝品審評中心(以下簡稱省藥化審評中心)承擔試點前置服務工作,負責資料接收、前置指導、啟動核查檢驗、前置核查、前置立卷等工作。浙江省食品藥品檢驗研究院(以下簡稱省食藥檢院)負責開展前置檢驗工作。四、前置服務申請辦理流程
登記人/持有人完成上市后變更研究工作后,可在國家藥品監督管理局藥品審評中心(以下簡稱藥審中心)“申請人之窗”前置服務模塊提出前置服務申請,同時將光盤資料郵寄至省藥化審評中心。首次提交變更研究資料可暫不提交完整的穩定性研究資料,登記人/持有人申請前置服務與穩定性研究可平行開展。省藥化審評中心對資料進行初步審核,申請事項屬于試點范圍的,予以接收;不屬于試點范圍的,不予接收并通過“申請人之窗”前置服務模塊告知登記人/持有人。省藥化審評中心參照上市后變更相關技術指導原則等現行技術要求開展資料審查。經審查存在一般性缺陷,需要補充資料的,通過“申請人之窗”前置服務模塊一次性告知登記人/持有人需要補充資料的內容。登記人/持有人應在20個工作日內完成補充研究并重新提交全套完整的資料。經資料審查不存在實質性缺陷或其他可能影響核查檢驗工作缺陷的,省藥化審評中心按照《藥品補充申請試點前置核查檢驗啟動工作程序(試行)》決定是否啟動前置核查和檢驗。如需啟動,向登記人/持有人發出前置核查和前置檢驗通知書,同步啟動核查和抽樣程序,并抄告所在地市場監督管理局(以下簡稱市局)。登記人/持有人在收到前置檢驗通知書后應及時備好樣品,在2個工作日內與所在地市局聯系抽樣,5個工作日內送樣至省食藥檢院。原則上每個補充申請前置服務事項只提供一次前置檢驗服務。登記人/持有人應在前置服務申請接收之日起55個工作日內完成變更指導原則要求的穩定性研究,并將包含穩定性研究資料的全套資料以光盤形式提交至省藥化審評中心。省藥化審評中心形成綜合立卷報告后,通過“申請人之窗”前置服務模塊告知登記人/持有人立卷審查結論。登記人/持有人通過“申請人之窗”前置服務模塊收到立卷審查通過的結論后,可以向藥審中心正式提出補充申請,正式申報資料應與前置服務最終版資料保持一致。經資料審查存在實質性缺陷或影響核查檢驗工作相關缺陷的、登記人/持有人未在規定時限內補充資料的,省藥化審評中心在“申請人之窗”前置服務模塊終止前置服務申請,登記人/持有人可以在完善研究后再次提出前置服務申請。登記人/持有人根據穩定性研究情況決定不再進行此次變更的,可以在“申請人之窗”前置服務模塊主動終止前置服務申請。五、前置服務地址及聯系方式
1.前置指導、前置核查和立卷服務機構(省藥化審評中心)。咨詢電話:0571-81053242;資料郵寄地址:杭州市西湖區文三路140號省行政中心三號院8號樓1207室前置服務組(收),聯系電話:0571-81053257,郵編:310061。2.前置檢驗機構(省食藥檢院)。送樣地址:杭州市濱江區平樂街325號,聯系電話:0571-87180311。(一)上海市藥品監督管理局關于延續階段性降低上海市藥品、醫療器械產品注冊收費標準的公告https://yjj.sh.gov.cn/zh/20250116/f0193785983a42b09c735df9128151a6.html
為持續優化營商環境,著力減輕企業負擔,根據《關于階段性降低國產藥品注冊費、境內第二類醫療器械產品注冊費收費標準的通知》(滬發改價調﹝2024﹞63號),上海市藥品監督管理局繼續執行《關于階段性降低上海市藥品、醫療器械產品注冊收費標準的公告》(滬藥監公告﹝2024﹞1號),有效期至2025年12月31日。(二)《上海市藥品監管部門規范涉企行政檢查實施方案》政策解讀https://yjj.sh.gov.cn/zcjd/20250114/86ebd192ec5347039de0919d1c1a0b5c.html2024年12月31日,市藥品監管局發布《上海市藥品監管部門規范涉企行政檢查實施方案》(以下簡稱《實施方案》)。行政檢查是行政執法主體履行行政管理職責的重要方式,對引導規范企業合法經營、預防糾正違法行為具有重要作用,但是在實踐中,“隨意檢查、重復檢查、多頭檢查”等問題仍然不同程度存在。2024年12月23日,國務院常務會議審議通過《關于嚴格規范涉企行政檢查的意見》,要求著力提高依法行政水平,嚴格規范涉企行政檢查。根據市委、市政府的工作部署,為推動全面提升涉企行政檢查質量和效能,市藥品監管局結合藥品監管工作實際和特點,對照本市規范涉企檢查要求,組織制定藥品監管領域《實施方案》。在嚴守藥品安全底線、實現有效監管的基礎上,減少現場檢查對象、提升檢查針對性,減少現場檢查頻次、提升檢查有效性,減少現場檢查內容、提升檢查精準性,減少檢查對企影響、提升檢查規范性,推動藥品監管向服務型監管、預防型監管、數智化治理轉變。用2-3年時間,實現有計劃的涉企行政現場檢查次數明顯下降,涉企行政檢查質效和企業感受度雙提升。《實施方案》中所稱行政檢查是指本市各級藥品監管部門依照法定職權,對檢查對象遵守法律、法規、規章和執行行政決定的情況進行強制性了解、核查的行為。不包括依申請開展的行政許可相關檢查,即生產許可檢查、經營許可檢查、產品注冊核查、許可變更檢查等。檢查對象是指從事經營活動的個體工商戶、法人及非法人組織等經營主體。經營主體以外的其他檢查對象,例如對醫療機構、養老機構、學校等單位實施的檢查參照《實施方案》管理。通過實施“兩庫一碼一備案、一標準一制度一指引、聯合協同、技術賦能”等九項任務,切實提升涉企行政檢查質效,實現檢查減量提質不擾企。一是建設行政檢查對象庫和行政檢查事項庫(“兩庫”)。梳理建立藥品監管行政檢查對象庫,全量、統一歸集到本市行政檢查對象庫,并實施定期動態更新。以權責清單為基礎,梳理藥品監管領域行政檢查事項,形成行政檢查事項庫。二是推行分級分類檢查制度(“一制度”)。編制分類分級標準,按照“產品 體系 信用”對檢查對象分級,并探索制定“無感監管”檢查對象清單。對行政檢查事項按風險進行高中低三類分類,探索制定“無事不擾”的事項清單。三是實行檢查計劃備案審查(“一備案”)。對除觸發式檢查之外的所有其他檢查實行先備案審查后實施檢查,即先制定計劃,經備案審查通過后,獲取計劃編碼,作為實施檢查的必要前提。檢查計劃的制定要做到應并盡并、科學統籌,同時各級藥品監管部門制定的年度檢查計劃,應當于3月底前向社會公布。四是推廣使用“檢查碼”(“一碼”)。以“無碼不檢查、檢查必亮碼”為原則,藥品監管執法人員應在對企業進行現場檢查前申請“檢查碼”,并按相關要求向檢查對象推送“檢查碼”。檢查結束后,企業可以通過“檢查碼”查看本次檢查結果并進行評價。五是編制檢查標準(“一標準”)。制定藥品、醫療器械和化妝品各業務領域的監管風險點和檢查要點,統一本業務領域的檢查內容和檢查標準,編制簡潔明了的檢查指南并對外公開。六是加強合規經營指引(“一指引”)。聚焦重點領域、重點環節、重點事項等組織編制合規經營指引,及時對相關企業進行預警、提醒、敦促。深化服務型監管理念,將服務指導貫穿檢查全過程,在行政檢查過程中發現違法違規隱患的,應當開展合規指導,幫助企業提高合規經營水平。七是開展跨部門聯合檢查(“聯合協同”)。在跨部門綜合監管重點行業領域與“一業一證”改革業態,制定跨部門聯合檢查計劃。依托檢查碼系統撮合功能開展多種形式的聯合檢查。如企業不歡迎聯合檢查,匯總形成不鼓勵開展聯合檢查的檢查對象名單。八是強化數據與技術賦能(“技術賦能”)。實施行政檢查產生的數據,應當錄入上海市藥械化行政檢查系統,并按照《上海市統一綜合執法系統管理暫行辦法》等規定,歸集至上海市統一綜合執法系統。強化信息技術應用,建立非現場監管業務流程、問題處置流程,加強檢查信息共享。一是提升檢查質量。將行政檢查規范納入行政執法培訓內容,開展分類分級分層培訓。開展行政檢查質效評估,以檢查計劃統籌、檢查問題發現率、合規指導等作為質量評估的依據。將各單位(部門)落實規范涉企行政檢查工作情況納入執法監督范圍。二是加強宣傳指導。加大規范涉企行政檢查相關工作的宣傳力度,及時總結推廣行政檢查先進經驗和典型做法。落實“誰執法誰普法”普法責任制要求,在行政檢查過程中充分釋法說理。三是激勵擔當作為。加強基層創新經驗總結,并及時做好復制推廣。對監管不力、執法缺位、推諉扯皮、徇私監管的,依法依規依紀嚴肅追責問責。對按照本實施方案組織實施檢查,且已認真履行行政檢查職責的,按照相關規定,不追究相關行政執法人員行政執法責任。一是對于執法人員來說,使用“檢查碼”的例外情形有哪些?答:使用“檢查碼”的例外情形主要包括:對尚未納入檢查對象庫的不特定對象的首次摸底;同一檢查任務需要開展多次現場檢查的,可以對原“檢查碼”進行更新,不再重復申請“檢查碼”;對于發生涉及藥品安全的突發緊急事故或偶遇系統故障等其他無法及時申領“檢查碼”的情況,執法人員可先主動亮證實施行政檢查,于檢查后3個工作日內補充申請“檢查碼”并補錄檢查情況。二是對于企業來說,是否必須掃描“檢查碼”以及由誰掃描“檢查碼”?答:掃描“檢查碼”是企業的權利,而非義務,企業可以自行決定是否掃描執法人員出示的“檢查碼”或者是否作出評價。只有企業法定代表人及獲得授權的工作人員可以使用“隨申辦”移動端進行掃碼查看結果并進行評價。三是如果遇到執法人員開展檢查沒有出示“檢查碼”,企業可以拒絕接受檢查嗎?答:不能。“無碼不檢查”是對執法人員提出的法律規定以外的更高要求。如果企業遇到執法人員開展檢查時沒有出示“檢查碼”,企業可以在接受檢查后,向其所在單位或上級執法部門進行反映。https://yjj.beijing.gov.cn/hudong/xinxiang/yjj/sindex/bjah-index-dept!detail.action?originalId=AH25011601466
(一)廣東省藥品監督管理局關于開展優化藥品補充申請審評審批程序改革試點工作的通告http://mpa.gd.gov.cn/zwgk/gzwj/content/post_4655756.html
為貫徹落實國務院全面深化藥品醫療器械監管改革促進醫藥產業高質量發展及省政府關于進一步推動廣東生物醫藥產業高質量發展行動方案的工作部署,持續深化藥品審評審批制度改革,優化藥品補充申請審評審批程序,經國家藥品監督管理局同意,廣東省獲批開展優化藥品補充申請審評審批程序改革試點工作。現將有關事項通告如下:
省藥品監管局按照“提前介入、一企一策、全程指導、研審聯動”的原則,為轄區內藥品上市許可持有人和化學原料藥登記人(以下簡稱持有人)藥品重大變更補充申請申報提供前置指導、核查、檢驗和立卷服務等前置服務,推動需要核查檢驗的補充申請審評時限由200個工作日縮短為60個工作日。前置服務范圍為化學藥品(包括原料藥)上市后藥學重大變更。藥學重大變更需開展臨床研究的,變更原料藥、輔料、藥包材供應商且變更后產品登記狀態為“I”的,以及一致性評價申請不屬于試點前置服務范圍。廣東省藥品監督管理局審評認證中心(以下簡稱省局審評認證中心)承擔試點前置服務,負責資料接收、前置指導、立卷、啟動核查檢驗、開展前置核查等工作。廣東省藥品檢驗所(以下簡稱省藥檢所)承擔前置檢驗工作。持有人完成上市后變更研究工作后,可在國家藥監局藥審中心“申請人之窗”前置服務模塊提出前置服務申請,同時將光盤資料郵寄至省局審評認證中心。首次提交申報資料可暫不提交完整的穩定性研究資料,前置服務與穩定性研究可平行開展。申請事項如不屬于試點前置服務范圍的,省局審評認證中心不予接收并通過“申請人之窗”前置服務模塊告知持有人。省局審評認證中心參照藥品上市后變更相關技術指導原則等要求開展資料審查。經審查認為存在一般性缺陷,需要補充資料的,省局審評認證中心通過“申請人之窗”前置服務模塊一次性告知持有人需要補充資料的內容。持有人應在20個工作日內完成補充研究并重新提交全套完整的資料(除穩定性研究資料外)。申報資料經初步審查不存在實質性缺陷或其他影響核查、檢驗開展缺陷的,省局審評認證中心按照《藥品補充申請試點前置核查檢驗啟動工作程序(試行)》決定是否啟動前置核查和檢驗,并向持有人發出前置核查、檢驗通知書。持有人應在收到檢驗通知書后,2個工作日內與相關地級以上市藥品監督管理部門聯系抽樣,5個工作日內送至省藥檢所檢驗。持有人應在前置服務申請接收之日起55個工作日內完成變更指導原則要求的穩定性研究,并將包含穩定性研究資料的全套資料以光盤形式提交省局審評認證中心。省局審評認證中心形成綜合立卷報告后,通過“申請人之窗”前置服務模塊告知持有人立卷審查結論。持有人通過“申請人之窗”前置服務模塊收到立卷審查通過的結論后,可以向國家藥監局藥審中心正式提出補充申請,申報資料應與前置服務最終版資料(如SM3值等)保持一致。持有人根據穩定性研究情況等決定不再進行此次變更的,可以在“申請人之窗”前置服務模塊主動終止前置服務申請。經資料審查存在實質性缺陷或影響核査檢驗工作相關缺陷的、持有人未在規定時限內補充資料的,省局審評認證中心可在“申請人之窗”前置服務模塊終止前置服務。持有人可以在完善研究后再次提出前置服務申請。為順利推進前置服務試點工作,持有人完成上市后變更研究工作后(除穩定性研究外),在補充申請前置服務申請前可通過省局審評認證中心“審評檢查溝通咨詢與預約通道”(網址:http://gdcec.gd.gov.cn/zxyyxt/app/web/#/260/index,或掃描下方二維碼)進行咨詢。1、資料接收、前置指導、前置核查、立卷服務機構(省局審評認證中心):廣州市越秀區東風東路753號之二藥品六組,聯系電話:020-37886285。2、前置檢驗機構(省藥檢所):廣州市黃埔區神舟路766號,聯系電話:020-32447915。(二)廣東省藥品監督管理局關于啟用出口歐盟原料藥證明文件許可模塊的通告http://mpa.gd.gov.cn/zwfw/ywlcsm/yaopin/content/post_4654446.html為進一步促進產業發展、減少企業辦事成本,我局已在“廣東省智慧食藥監”系統中添加出口歐盟原料藥證明文件許可模塊并正式啟用,企業可通過“廣東省智慧食藥監”系統相應業務通道進行申請,不再受理紙質申請材料。相關受理標準、辦理流程、申請材料等要求可查詢“廣東政務服務網”-“廣東省藥品監督管理局網上服務窗口”(https://www.gdzwfw.gov.cn/portal/v2/branch-hall?orgCode=MB2D03442)相應業務辦事指南。
(一)遼寧省藥品監督管理局關于公開征求《關于藥品上市后生產場地變更優先審評審批的公告(征求意見稿)》意見的公告https://ypjg.ln.gov.cn/ypjg/gzhd/yjzj/2025011716251341455/index.shtml為持續深化藥品審評審批制度改革,落實《省委辦公廳 省政府辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的實施意見》,進一步聚焦人民群眾用藥需求及企業訴求,提高我省創新、短缺、急需類藥品上市后生產場地變更審評審批效率,推動我省醫藥產業創新高質量發展,省藥監局結合我省實際,起草了《遼寧省藥品監督管理局關于藥品上市后生產場地變更優先審評審批的公告(征求意見稿)》,現向社會公開征求意見。公開征求意見的時間是2025年1月17日—1月25日。有關單位和個人可將意見反饋至xzspc1@ln.gov.cn,請在電子郵件主題注明“文件名稱-意見建議反饋”。附件:1.遼寧省藥品監督管理局關于藥品上市后生產場地變更優先審評審批的公告(征求意見稿)
一、關于發布《細胞治療產品生產檢查指南》的通告
https://www.cfdi.org.cn/cfdi/resource/news/16292.html為指導檢查員開展細胞治療產品生產環節檢查工作,進一步加強細胞治療產品生產質量管理,國家藥監局核查中心組織制定了《細胞治療產品生產檢查指南》,經國家藥品監督管理局同意,現予發布,請各級藥品檢查機構參照執行。https://www.cfdi.org.cn/cfdi/resource/news/16299.html為指導和規范藥品上市許可持有人、藥品生產企業(含原料藥登記人)等對藥品生產設備及部件清潔驗證的科學管理,有效降低藥品生產過程中污染與交叉污染風險,核查中心組織制定了《清潔驗證技術指南》。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容