
2025-01-06 00:00:00來源:微譜生物科技瀏覽量:1321
藥品標準是藥品質(zhì)量和安全的標尺,藥典是國家藥品標準體系的核心。日前,第十二屆藥典委員會執(zhí)行委員會全體會議在京召開,審議通過2025年版《中國藥典(草案)》。行業(yè)翹首以待的新版藥典終于走進公布倒計時。
雖然新版藥典尚未正式公布,但我們已能從歷次修訂公示中初窺其貌。它會有什么新變化?哪些內(nèi)容需要行業(yè)重點關(guān)注?聚焦生物制品領(lǐng)域,本期的專家解讀將為您帶來2025版藥典《生物制品生產(chǎn)用動物細胞基質(zhì)制備及質(zhì)量控制》微譜系列解讀的首篇文章。全文干貨。
1. 按照工藝與來源對細胞基質(zhì)進行分類的編寫邏輯
對比2020版,2025版藥典《生物制品生產(chǎn)用動物細胞基質(zhì)制備及質(zhì)量控制》更強調(diào)按照工藝與來源對細胞基質(zhì)進行分類的編寫邏輯。
第一部分:按照細胞基質(zhì)類型動物或人源的連續(xù)傳代細胞系(如CHO、HEK293、VERO、HELA等)對生產(chǎn)用細胞基質(zhì)進行總的要求;
第二部分:按照二倍體細胞株(如WI38、MRC-5、2BS、KMB17或者MSC、IPSC、NK、TIL、PBMC等)對新建人二倍體細胞株進行要求;
第三部分:按照原代細胞(如MDCK等病毒性疫苗、藥學篩選用途原代細胞)展開對原代細胞的要求。
需要注意的是,此制備與質(zhì)量控制要求不包括細胞治療產(chǎn)品制劑,但可作為參考。

圖1:2025版與2020版藥典修訂對比?
圖源:國家藥典委員會官網(wǎng)
2. 根據(jù)實際工藝開發(fā)歷程對全生產(chǎn)周期進行規(guī)定
歷經(jīng)三輪修訂與公示,2025版藥典《生物制品生產(chǎn)用動物細胞基質(zhì)制備及質(zhì)量控制》的最終公示草案中對生產(chǎn)用細胞基質(zhì)總的要求,
包括從細胞系/細胞株歷史來源與培養(yǎng)資料、細胞培養(yǎng)操作要求直至建立細胞系與凍存、細胞庫建庫與管理、細胞檢定要求到生產(chǎn)用細胞的培養(yǎng)要求,應(yīng)用邏輯更加清晰明確。

圖2:2025版藥典細胞庫檢定要求歷經(jīng)三輪修訂與公示
圖源:國家藥典委員會官網(wǎng)
3. 在全生產(chǎn)周期的管理中,根據(jù)風險評估制定檢定策略
對細胞類型與培養(yǎng)過程進行風險評估,如是否屬于生產(chǎn)對照細胞、新建細胞系、穩(wěn)轉(zhuǎn)細胞株、是否引入外源病毒因子等,制定合適的檢測方案,其中包括:細胞鑒別試驗、細菌真菌檢查、分枝桿菌檢查、支原體/螺原體檢查、細胞內(nèi)外源病毒因子檢查(包括:體外培養(yǎng)法檢測、動物體內(nèi)接種法檢測、逆轉(zhuǎn)錄病毒檢測、種屬特異性病毒檢測、牛源病毒檢測、豬源病毒檢測、其他特定病毒檢測、分子生物學方法NAT與NGS)、成瘤性檢查、致瘤性檢查、穩(wěn)定性等。
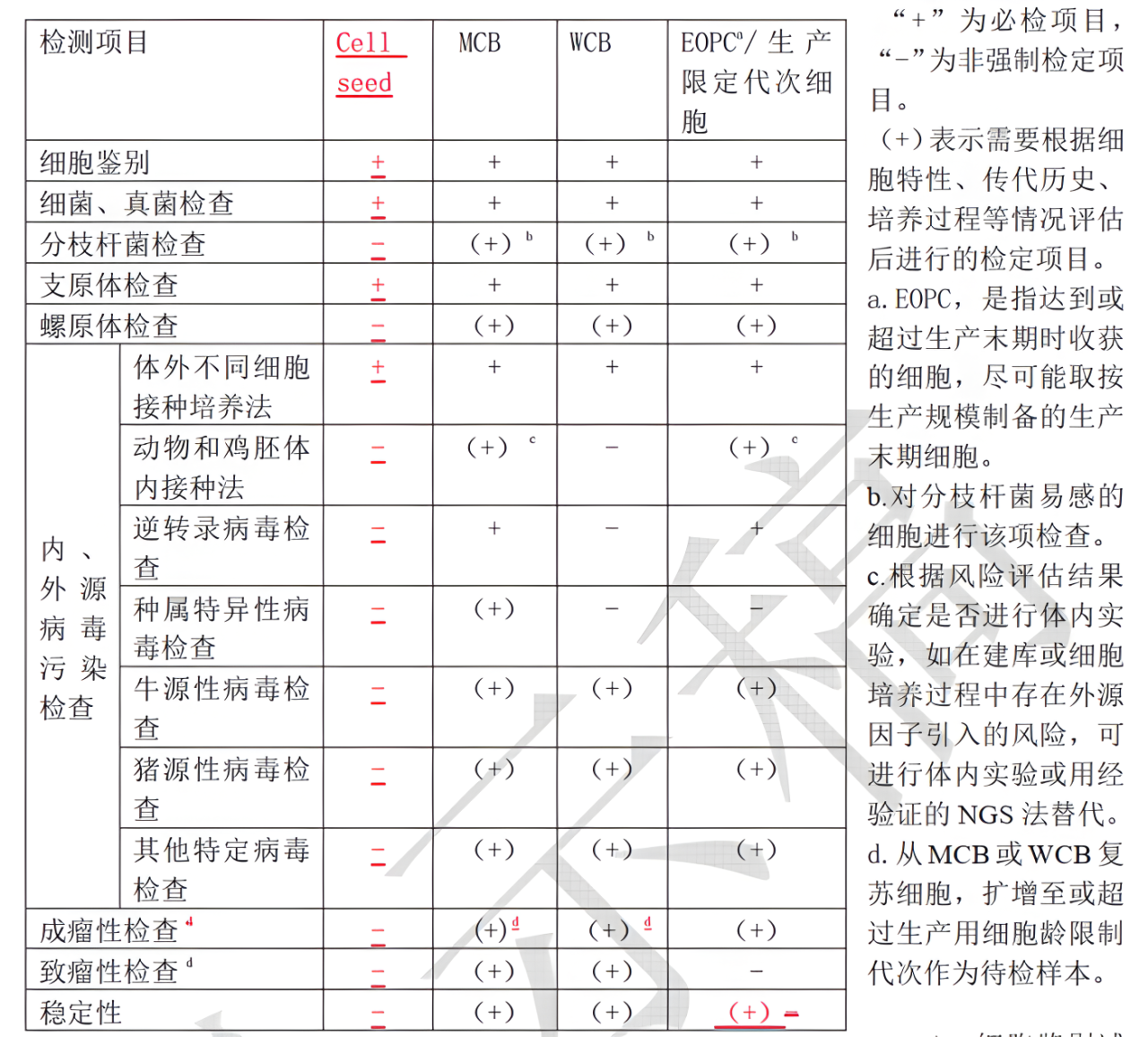
4. 根據(jù)新增細胞庫類型及方法對于質(zhì)控要求進行內(nèi)容新增與調(diào)整
為應(yīng)對新增的昆蟲桿狀病毒表達系統(tǒng)應(yīng)用于AAV與蛋白疫苗產(chǎn)品,新增昆蟲細胞檢定內(nèi)容;為應(yīng)對目前多種類的細胞類型鑒別,新增3430通則規(guī)定細胞種屬鑒別方法;為控制病毒安全檢測中的動物體內(nèi)實驗的質(zhì)量,新增3601通則規(guī)定檢定用動物質(zhì)量控制對此部分的動物提出要求;為應(yīng)對病毒類產(chǎn)品的外源病毒檢定要求,調(diào)整3302通則外源病毒因子檢查的要求;將檢定用細胞檢定要求調(diào)整形成單獨章節(jié);根據(jù)邏輯適用性,在檢測內(nèi)容上新增穩(wěn)定性與調(diào)整染色體檢查等內(nèi)容;將連續(xù)傳代細胞系要求與重組細胞的特殊要求融入總體要求。

圖4:通則3430、3601、3302與檢定用細胞庫檢定
圖源:國家藥典委員會官網(wǎng)
總而言之,2025版《中國藥典》細胞庫制備與質(zhì)控要求在邏輯上更加清晰,更加符合生產(chǎn)工藝與開發(fā)工藝的全流程要求,同時還涵蓋了不同申報產(chǎn)品類型的共性要求,這將進一步完善國家標準的科學性、嚴謹性和適用性,加速推進中國在生物制品研究領(lǐng)域的新質(zhì)發(fā)展!