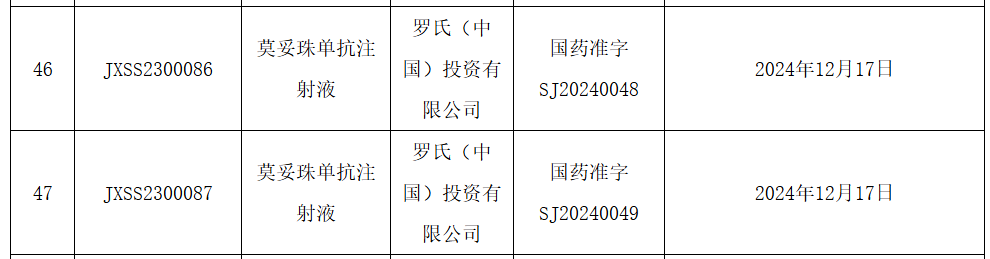
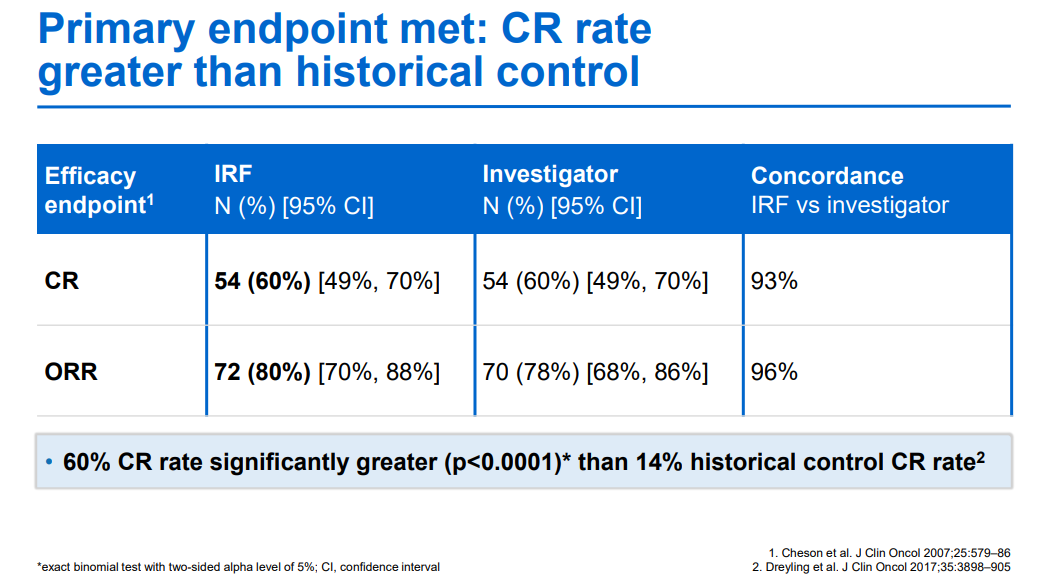
12月23日,NMPA官網顯示,羅氏CD20/CD3雙抗莫妥珠單抗(Mosunetuzumab)的上市申請已獲批準,用于治療既往接受過至少兩種系統性治療的復發或難治性濾泡性淋巴瘤(FL)成人患者。Mosunetuzumab是一款CD20/CD3 T細胞銜接雙特異性抗體,旨在靶向B細胞表面的CD20和T細胞表面的CD3。這種雙重靶向激活并重定向患者現有的T細胞,通過將細胞毒性蛋白釋放到B細胞中消除惡性B細胞。此前基于一項代號為GO29781的多中心、開放標簽I/II期研究積極結果,歐盟委員會和美國FDA已批準該藥物上市,用于治療既往接受過至少兩種系統性治療的復發或難治性FL患者。該項研究中,mosunetuzumab顯示出較高完全緩解(CR)率和長久的臨床療效。中位隨訪18.3個月后,患者的客觀緩解率為80%(n=72/90),CR率為60%(n=54/90),中位緩解持續時間為22.8個月。研究中出現的最常見的不良事件為細胞因子釋放綜合征(44.4%),一般為低級別(1級:25.6%;2級:16.7%),并且在治療結束后消退。
Mosunetuzumab是羅氏在中國進行開發的第2款CD3/CD20雙抗。2023年11月,羅氏的CD3/CD20雙抗格菲妥單抗注射液(商品名:高羅華/Columvi)獲NMPA附條件批準上市,用于治療既往接受過至少兩線系統性治療的復發或難治性彌漫大B細胞淋巴瘤(DLBCL)成人患者。這也是國內獲批的首款CD3/CD20雙抗。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容