摘要:混懸型滴眼劑系指難溶性固體藥物以微粒狀態分散于介質中形成的無菌眼用液體制劑。本文從化學藥品仿制藥混懸型滴眼劑的處方、生產工藝、質量研究、包材和穩定性研究等藥學方面問題進行了初步的探討,匯總了國內外文獻中混懸型滴眼劑開發過程中關鍵研究指標,以助于業界對混懸型滴眼劑仿制藥的開發。
眼用制劑系指直接用于眼部發揮治療作用的無菌制劑,其中滴眼劑系指由原料藥物與適宜輔料制成的供滴入眼內的無菌液體制劑,可分為溶液、混懸液或乳狀液。混懸型滴眼劑系指難溶性固體藥物以微粒狀態分散于分散介質中形成的無菌眼用液體制劑。混懸型滴眼劑中活性成分以微粒狀態分散于分散介質中,相比溶液型滴眼液,藥物顆粒可在角膜前囊滯留,增加了與角膜的接觸時間,有利于提高生物利用度[1] 。目前國內外已上市多種混懸型滴眼劑,如氯替潑諾混懸滴眼液、妥布霉素地塞米松混懸滴眼液、妥布霉素氯替潑諾滴眼液、布林佐胺溴莫尼定滴眼液、夫西地酸滴眼液、鹽酸貝西沙星滴眼液等。2023年2月,國家藥品監督管理局藥品審評中心(CDE)發布了?化學藥品仿制藥溶液型滴眼劑藥學研究技術指導原則?[2] ,闡述了溶液型滴眼劑藥學研究的要求。對于混懸型滴眼劑,原料藥不是以真溶液狀態溶解于分散介質中,相較于溶液型滴眼劑藥學研究要求,混懸型滴眼劑在處方、生產工藝、質量研究、包材和穩定性研究等方面有其特殊性。
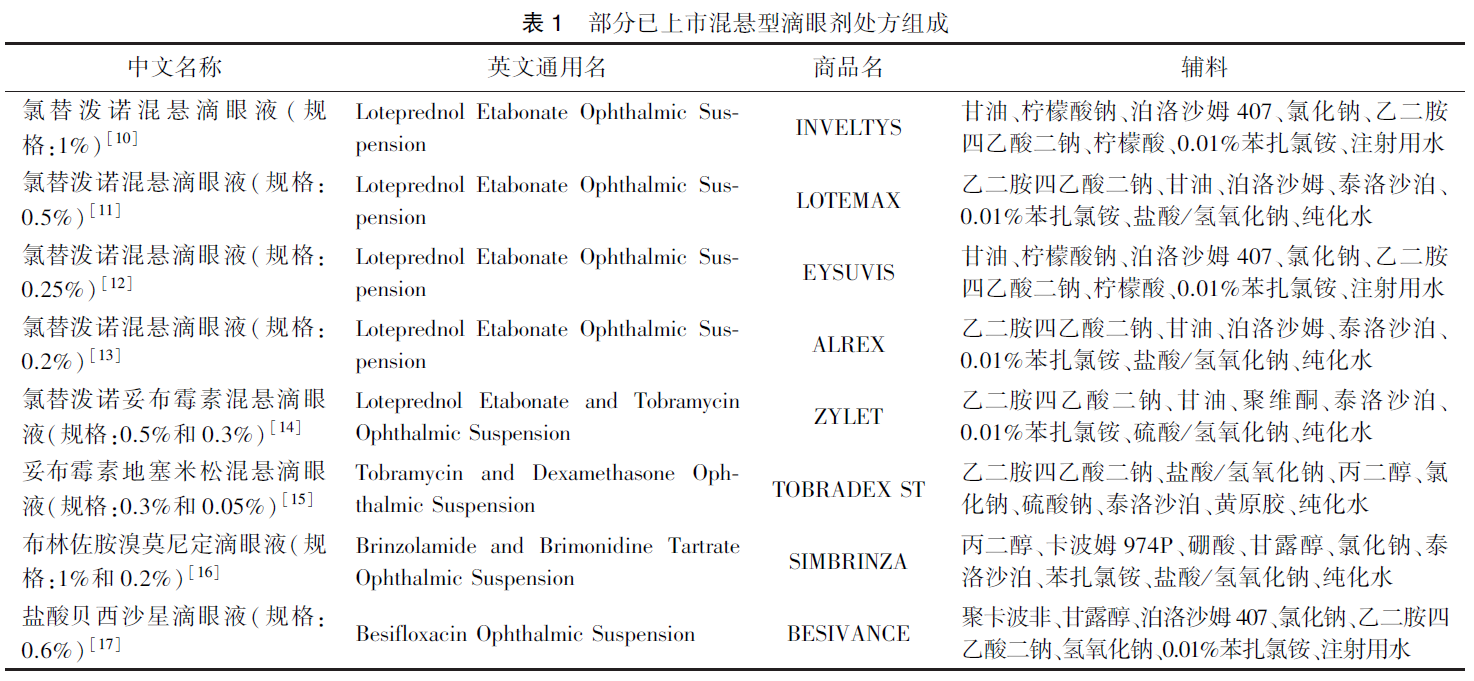
對于溶液型滴眼劑,CDE 發布的?化學藥品仿制藥溶液型滴眼劑藥學研究技術指導原則?中,建議仿制藥處方中輔料種類(Q1)和用量(Q2)應與參比制劑一致,其中輔料的用量相同是指仿制藥輔料用量是參比制劑相應輔料用量的95% ~105%。對于與參比制劑中滲透壓調節劑用量、緩沖劑用量和pH 調節劑不同的處方,需標注不同之處,闡述選擇的理由,并研究證明上述不同不影響產品的質量屬性(如滲透壓摩爾濃度、緩沖容量、pH 值等物理化學特性)、安全性和有效性。對于混懸型滴眼劑,與溶液型滴眼劑一致,FDA各混懸型滴眼劑個例指導原則[3-9] 中,建議仿制藥處方中輔料種類(Q1)和用量(Q2)一致,輔料的用量相同是指仿制藥輔料用量是參比制劑相應輔料用量的95%~105%。通常,已上市的國內外混懸型滴眼劑說明書中公開了輔料的種類。參考FDA 公布的說明書,表1中列舉了部分混懸型滴眼劑中處方組成。從FDA 公布的已上市混懸型滴眼劑處方來看,混懸型滴眼劑中輔料通常包括潤濕劑、助懸劑、滲透壓調節劑、pH 調節劑、抑菌劑等。在混懸型滴眼劑仿制藥的處方開發過程中,應基于參比制劑公開的說明書等信息,確定原料藥及輔料的種類,同時應關注輔料的型號,尤其是助懸劑等關鍵輔料的型號,不同型號的輔料對混懸型滴眼劑質量可能有較大影響。如氯替潑諾混懸滴眼劑采用聚維酮作為助懸劑,而市售聚維酮存在多種型號,一般情況下應采用與參比制劑相同型號的輔料。在對混懸型滴眼劑處方篩選過程中,通常以滲透壓摩爾濃度、粒度等作為考察指標,通過合適的理化手段,對輔料的用量進行篩選和解析,以達到輔料的種類和用量與參比制劑一致。
多劑量滴眼劑一般應加適當的抑菌劑。對于處方中抑菌劑的用量,在參考參比制劑用量基礎上,參照?中國藥典?2020 年版(四部)通則1121“抑菌效力檢查法”,對擬定處方的抑菌效力進行考察,以確保抑菌效力符合藥典抑菌效力檢查法的規定,并在產品整個生命周期符合質量要求。
滴眼劑為無菌制劑,因此滴眼劑的生產也應采用無菌/ 滅菌工藝。不同于溶液型滴眼劑,混懸型滴眼劑的原料藥混懸于溶液中,通常無法通過0.22μm 的濾膜進行過濾除菌。目前,混懸型滴眼劑通常有無菌生產和滅菌生產兩種不同的生產方式:①無菌生產:由于原料藥無法通過濾膜進行過濾除菌,在生產中通常將輔料溶于注射用水,過濾后制備得到輔料溶液,然后將提前處理的無菌原料藥加入輔料溶液中,攪拌混合均質后,無菌條件下灌裝得到成品。②滅菌生產:滅菌生產通常包括兩種不同的生產方式,即濃溶液滅菌方式和稀配后滅菌方式,兩種方式的不同在于滅菌原輔料種類和滅菌體積的不同。對于濃溶液滅菌方式,通常將原料藥與部分輔料分散于部分注射用水中,進行滅菌,其他輔料和注射用水通過濾膜無菌過濾,然后將滅菌后含有原料藥的濃溶液與無菌過濾后的部分輔料溶液混合,均質后,無菌條件下灌裝得到成品。對于稀配后滅菌方式,通常根據原輔料性質,按照一定順序,配制得到最終稀溶液,滅菌后灌裝得到成品。基于以上混懸型滴眼劑的生產工藝,在產品的工藝開發階段,應重點對原料藥的前處理、原輔料加入順序及方式、無菌過濾參數或滅菌工藝參數等進行考察和研究。對于原料藥的前處理,原料藥的粒度是混懸型滴眼劑的關鍵質量屬性,應對原料藥的粒度分布進行考察和控制,可采用激光衍射儀等對原料藥的d(0.1)、d(0.5)和d(0.9)等進行測定和相應的控制。如采用微粉化方式對原料藥進行前處理,應關注微粉化后原料藥的晶型變化。對于無菌原料藥,可選擇采用無菌生產的原料藥或采用輻照等方式對原料藥進行滅菌處理。
對于混懸型滴眼劑的工藝驗證,除連續3 批產品的工藝驗證外,一般還包括除菌過濾驗證,可參考國家藥品監督管理局發布的?除菌過濾技術及應用指南?[18-19] 進行研究和驗證。對于生產中所用的除菌濾芯,建議單次使用。另外,在生產工藝開發中,通常應對藥液與生產組件的相容性進行研究[20] ,以確認生產組件適用于產品的生產。
原料藥應結合擬定的制劑生產工藝對其質量進行控制,如粒度分布、晶型、無菌、微生物限度等。
對于輔料,除進行常規質量控制外,通常應對微生物限度進行控制。
通常滴眼劑的質量屬性包括性狀、鑒別、溶液澄清度與顏色、滲透壓摩爾濃度、pH 值、黏度(如適用)、相對密度、可見異物、有關物質、元素雜質、無菌、抑菌劑含量、抗氧劑含量、含量測定、裝量/ 裝量差異等。對于混懸型滴眼劑,還應關注原料藥粒度和粒度分布、體外釋放、滴出量、表面張力、沉降體積比、再混懸/ 再分散性、可溶性的藥物量、含量均勻度等。部分研究項目討論如下:①原料藥粒度和粒度分布:原料藥粒度和粒度分布是混懸型滴眼劑中關鍵質量屬性,混懸型滴眼劑質量研究通常應包含粒度和粒度分布的研究。氯替潑諾混懸滴眼液(規格:0.5%和0.2%)等FDA 個例指導原則中建議采用3 批自制樣品與3 批參比制劑進行粒度與粒度分布對比,樣品的制備方法和粒度測定方法應進行驗證以確保方法的準確性和可靠性,同時在方法開發過程中應考察在不同稀釋條件下對原料藥粒度和粒度分布測定結果的影響,測定參數為d(0.5)和SPAN[d(0.9)-d(0.1) / d(0.5)],采用群體生物等效性(PBE)研究的分析方法進行d(0.5)和SPAN 數據對比,基于95%置信區間上限判定自制品與參比制劑的生物等效性。②體外釋放:混懸型滴眼劑中原料藥的體外釋放可反映處方和工藝變化,并可能影響藥物的吸收程度。一般情況下,體外釋放方法應盡可能模擬實際臨床的使用場景,并兼顧平臺期,體外釋放方法開發應包括釋放介質種類和體積、取樣時間點、溫度的選擇等。氯替潑諾混懸滴眼液( 規格: 0. 5% 和0.2%)等FDA 個例指導原則中建議采用3 批自制樣品與3 批參比制劑進行體外釋放(IVRT)對比,同時采用恰當的統計方法(如非模型依賴相似因子比較法,f2)對體外釋放數據進行比較分析。③滴出量:人的眼睛對于滴眼液的容量有限,過高的滴出量會造成藥物的浪費,過低的滴出量可能影響藥物的療效。FDA?局部用滴眼劑的質量考慮?草案[21] 中推薦仿制藥每滴的滴出量應在參比制劑滴出量的±10%范圍內,且每滴的滴出量應為20~70 μL 范圍內。④可溶性的藥物量:通常混懸型滴眼劑中可能會有微量或少量的原料藥溶于溶液中,可溶性的藥物量除可比較自制品與參比制劑質量外,還可反映藥物處方、工藝設計的合理性。氯替潑諾混懸滴眼液(1%規格和0.25%規格)等FDA 個例指導原則中建議對可溶性藥物量進行對比研究。
⑤再混懸/ 再分散性、含量均勻度:再混懸/ 再分散性是混懸型滴眼劑重要質量指標,在質量研究中,應結合參比制劑說明書使用方法,如使用前是否需搖勻等,對再混懸/ 再分散性等特性進行對比研究。同時FDA?局部用滴眼劑的質量考慮?草案中建議對多劑量混懸型滴眼劑含量均勻度進行測定,通常應對滴眼劑瓶上部、中部和底部藥物的含量進行測定,以確證原料藥是否均一地分散且在整個有效期內可被均一地遞送。
混懸型滴眼劑仿制藥,應根據參比制劑所用包材和產品特點選擇合適的包裝材料。原則上,所選擇的內包材在對產品保護性、功能性方面,應不低于參比制劑所用包材。同時應考察產品與包材的相容性,并對包材的密封性進行研究。包材的密封性可參考?化學藥品注射劑包裝系統密封性研究技術指南(試行)?[20] 開展研究。對于穩定性,應結合包材的特點(如半透性包材等)設計相關的穩定性試驗,在穩定性考察期間,除一般質量研究項目外,還應對原料藥粒度與粒度分布、沉降體積比、再混懸/ 再分散性、含量均勻度、抑菌劑含量、抗氧劑含量、失水率等進行考察,必要時應考慮對原料藥體外釋放進行考察。穩定性試驗樣品通常應包括直立放置和倒置(或平放)兩種放置方式。對于混懸型滴眼劑,FDA?局部用滴眼劑的質量考慮?草案中要求,應進行冷凍/ 解凍熱循環研究,以評估運輸和處理過程中可能遇到的任何高溫和低溫變化的影響,這些變化可能影響藥品的質量。FDA 建議該研究由3 個循環組成,溫度在冷凍(-20℃至0 ℃)和環境溫度(25 ℃至35 ℃)之間循環,累計最少3 d。在整個研究過程中,以及在預定的周期數結束時,應對樣品所有質量研究項目進行分析,并與參比制劑進行比較。
對于多劑量滴眼劑,還應考察其使用中的穩定性。
混懸型滴眼劑作為較復雜的滴眼劑型,其仿制藥的開發除遵循一般滴眼劑的開發路徑外,還需關注其特殊性,如粒度和粒度分布、含量均勻性等。
目前,國內外監管機構暫未發布專門的關于混懸型滴眼劑研究的指導原則,仿制藥的開發存在一定的難度,國內上市的混懸型滴眼劑仿制藥較少,本文對混懸型滴眼劑仿制藥開發中相關的藥學問題進行了探討,以供業界參考。
[1] 易婷,趙雁,陶濤. 混懸型滴眼劑的研究進展[J]. 中國醫藥工業雜志,2020,51(6):679-686.
[2] 國家藥品監督管理局藥品審評中心.化學藥品仿制藥溶液型滴眼劑藥學研究技術指導原則[EB/ OL].(2023-02-16)[2024-05-16].https:/ / www.cde.org.cn/ main/ news/viewInfoCommon/4a37370c92e2711fa80a3689700d7991.
[3] FDA.Draft Guidance on Loteprednol Etabonate[EB/ OL].(2019-09)[2024-05-16].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ psg/ PSG_210565.pdf.
[4] FDA.Draft Guidance on Loteprednol Etabonate[EB/ OL].(2024-02)[2024-05-16].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ psg/ PSG_020583.pdf.
[5] FDA.Draft Guidance on Loteprednol Etabonate[EB/ OL].(2022-08)[2024-05-16].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ psg/ PSG_210933.pdf.
[6] FDA.Draft Guidance on Loteprednol Etabonate[EB/ OL].(2024-02)[2024-05-16].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ psg/ PSG_020803.pdf.
[7] FDA.Draft Guidance on Loteprednol Etabonate;Tobramycin[EB/ OL]. ( 2024 - 02) [ 2024 - 05 - 16]. https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ psg/ PSG_050804.pdf.
[8] FDA.Draft Guidance on Dexamethasone;Tobramycin[EB/ OL].(2024-02)[2024-05-16].https:/ / www.accessdata.fda.gov/drugsatfda_docs/ psg/ PSG_050818.pdf.
[9] FDA.Draft Guidance on Besifloxacin hydrochloride[EB/ OL].(2020-02)[2024-05-16].https:/ / www.accessdata.fda.gov/drugsatfda_docs/ psg/ PSG_050818.pdf.
[10] FDA.Labels for NDA 210565[EB/ OL].2020-04) [2024-05- 16].https:/ / www.accessdata.fda.gov/ drugsatfda_docs/ label/2020/210565s003lbl.pdf.
[11] FDA. Labels for NDA 020583 [ EB/ OL]. ( 1998 - 03)[ 2024 - 05 - 16]. https:/ / www. accessdata. fda. gov/drugsatfda_docs/ label/1998/20583lbl.pdf.
[12] FDA. Labels for NDA 210933 [ EB/ OL]. ( 2020 - 10)[ 2024 - 05 - 16]. https:/ / www. accessdata. fda. gov/drugsatfda_docs/ label/2020/210933s000lbl.pdf.
[13] FDA. Labels for NDA 020803 [ EB/ OL]. ( 1998 - 03)[ 2024 - 05 - 16]. https:/ / www. accessdata. fda. gov/drugsatfda_docs/ label/1998/20803lbl.pdf.
[14] FDA. Labels for NDA 050804 [ EB/ OL]. ( 2021 - 10)[ 2024 - 05 - 16]. https:/ / www. accessdata. fda. gov/drugsatfda_docs/ label/2021/050804s026lbl.pdf.
[15] FDA. Labels for NDA 050818 [ EB/ OL]. ( 2022 - 08)[ 2024 - 05 - 16]. https:/ / www. accessdata. fda. gov/drugsatfda_docs/ label/2022/050818s007s008s009lbl.pdf.
[16] FDA. Labels for NDA 022308 [ EB/ OL]. ( 2018 - 03)[ 2024 - 05 - 16]. https:/ / www. accessdata. fda. gov/drugsatfda_docs/ label/2018/022308s013lbl.pdf.
[17] FDA.Quality Considerations for Topical Ophthalmic DrugProducts[EB/ OL].(2023-12) [2024-05-16].https:/ /www. fda. gov/ regulatory - information/ search - fda -guidance - documents/ quality - considerations - topical -ophthalmic-drug-products.
[18] 國家藥品監督管理局.國家藥品監督管理局關于發布除菌過濾技術及應用指南等3 個指南的通告[EB/ OL].(2018-07-31)[2024-06-16].https:/ / www.nmpa.Gov.cn/ xxgk/ ggtg/ypggtg/ ypqtggtg/20180911170301439.html.
[19] 國家藥品監督管理局.無菌工藝模擬試驗指南( 無菌制劑) [ EB/ OL]. ( 2018 - 07 - 31) [ 2024 - 06 - 16].https:/ / www. nmpa. gov. cn/ xxgk/ ggtg/ ypggtg/ ypqtggtg/20180911170301439.html.
[20] 國家藥品監督管理局藥品審評中心.國家藥監局藥審中心關于發布?化學藥品注射劑包裝系統密封性研究技術指南(試行)? 和?化學藥品注射劑生產所用的塑料組件系統相容性研究技術指南( 試行)? 的通告[EB/ OL].( 2020- 10- 21) [ 2024- 06- 16]. https:/ /www. cde. org. cn/ main/ news/ viewInfoCommon/8a4f9f16844fbed617f8e8ed59485c1d.
[21] FDA. Quality Considerations for Topical Ophthalmic DrugProducts. [ EB/ OL]. ( 2023 - 12) [ 2024 - 05 - 16].https:/ / www.fda.gov/ regulatory-information/ search-fda-guidance-documents/ quality-considerations-topicalophthalmic-drug-products.
(收稿日期:2024-05-23)
------------THE END------------
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容