
2024-11-26 17:07:01來源:肽研社瀏覽量:527
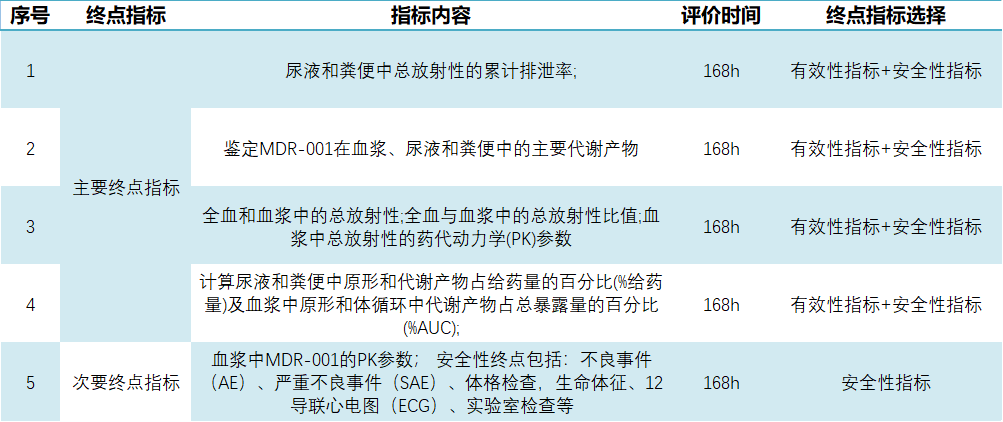
據藥物臨床試驗登記與信息公示平臺顯示,2024-11-26,杭州德睿智藥正式開展一項關于MDR-001片的I期臨床試驗(CTR20244449),旨在評估MDR-001單次口服給藥在健康成年男性受試者中的物質平衡。該研究倫理審查早于今年11月13日獲蘇州大學附屬第一醫院同意。 圖1. 臨床試驗截圖 關于試驗 此次德睿智藥獲批的臨床試驗預計入組人數10人,在空腹狀態下接受120 mg(約150 μCi)MDR-001口服制劑,確保10 min內服下全部藥物,持續用藥7天。 本次臨床試驗主要終點為測量在168h后尿液和糞便中總放射性的累計排泄率、MDR-001在血漿、尿液和糞便中的主要代謝產物、全血和血漿中的總放射性以及 血漿中總放射性的藥代動力學(PK)參數等。 次要終點為測量血漿中MDR-001的PK參數;安全性終點包括:不良事件(AE)、嚴重不良事件(SAE)、體格檢查,生命體征、12導聯心電圖(ECG)、實驗室檢查等。 表1.試驗主要及次要終點指標 關于MDR-001 MDR-001是德睿智藥自主研發的β-arrestin 2高選擇性GLP-1小分子激動劑,其保留了β-arrestin招募帶來的胰島細胞修復和保護功能,又避免β-arrestin 1招募帶來的副作用,如胰島素分泌受限及介導的內吞脫敏。 據MDR-001的臨床前研究顯示,其表現出優異的體內外藥效和成藥性優勢(包括PK和安全窗大幅提高)。目前MDR-001已高效推進至IIb期臨床研究,多款腫瘤 及代謝類藥物正在進行IND-Enabling研究。 | 引用資料 [1] 中國藥物臨床試驗與信息公示平臺官網. Fromhttp://www.chinadrugtrials.org.cn/index.html. - END -
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容