
2024-09-25 17:40:52來源:MAH研究院瀏覽量:511
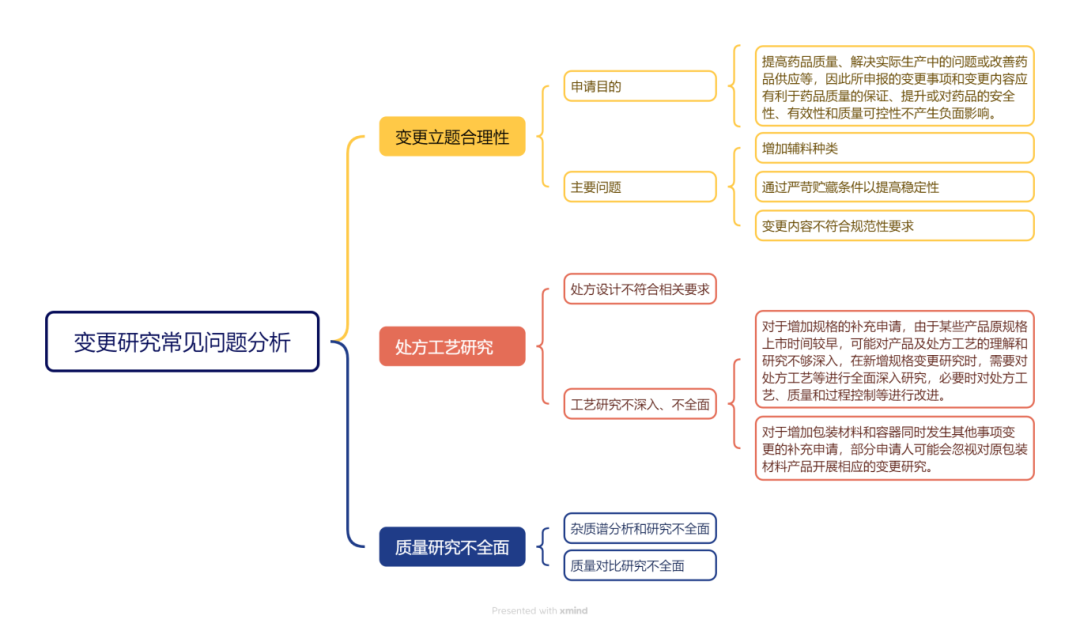
本期閱讀的文獻來源于《中國新藥雜志》2024年第33卷第16期《已上市化學藥品補充申請藥學申報資料和變更研究常見問題分析》,作者吳小飛,劉丹杏,張歆,王宏亮,白玉(國家藥品監督管理局藥品審評中心)。 2017年8月 《已上市化學藥品生產工藝變更 研究技術指導原則的通告》( 2017 年第 140 號) 2017年11月 《藥品注冊受理審查指南( 試行) 的通告》( 2017 年第 194 號) 附件 6 2021年2月10日 《已上市化學藥品變更事項及申報資料要求的通告》( 2021 年 第 15 號) 《化學藥品變 更受理審查指南( 試行) 》( 2021 年第 17 號) 對化學藥品變更事項及申報資料進行 了相關要求,其中對于 5 號藥學研究資料,需要按照 國家藥品監管部門公布的已上市化學藥品藥學變更 等相關技術指導原則開展研究,根據相關技術指導 原則對各類變更事項的具體要求分別提供部分或全 部藥學研究試驗資料和文獻資料以及必要的原注冊 申請相關資料 要求按照《藥品注冊管理辦法》、《藥品上市后變更管理 辦法( 試行) 》及《已上市化學藥品變更事項及申報 資料要求》等規定,提供符合要求的申報資料,目錄 及項目編號不能改變,對應項目無相關信息或研究 資料時項目編號和名稱也應保留,可在項下注明 “不適用”并說明理由。上述內容為目前對已上市 化學藥品補充申請申報資料的總體要求。 在變更風險分析的基礎上,開展相應的研究與驗證,評估變更對安全性、有效性或質量可控性產生影響。 首先需要說明為什么要變更、變更了哪些事項和內容,接著評價變更的合理性以及評估變更對藥品安全性、有效性和質量可控性產生影響的可能性,確定變更風險等級,再按照《已上市 化學藥品藥學變更研究技術指導原則( 試行) 》的要求,根據變更具體情形并結合品種特點開展相關變 更研究和驗證,最后對研究結果進行分析總結,確定變更實施的可行性。 包括品種概述、立題合理性、變更內容及變更理由、變更研究。 ① 品種概述的內容主要包括同品種上市背景信息、申報品種獲準上市的信息和變更事項的簡述。 ② 立題合理性部分主要是申請人根據同品種上市背景信息及本品種最新的研究進展,對該化合物、劑型、規格的立題合理性進行自我評價。 ③ 變更內容及變更理由部分主要是寫明此次補充申請涉及變更內容和原因,說明是否有關聯變更以及關聯變更的具體事項和理由,建議以列表方式體現變更前、變更后、主要變化及原因等信息。 ④ 變更研究部分是藥學研究資料的核心內容,首先需進行變更的合理性評價和風險分析,即申請人根據《已上市化學藥品藥學變更研究技術指導原則( 試行) 》,基于具體問題具體分析的原則對變更內容進行風險分析,評估變更對藥品安全性、有效性和質量可控性產生影響的可能性,確定變更的合理性以及變更風險等級; 其次為變更研究具體內容,應全面呈現針對此次變更設計并開展的相應研究工作,并在變更研究的基礎上對研究結果進行充分分析,全面評估、驗證變更事項對藥品安全性、有效性和質量可控性的影響,包括化學、物理學、微生物學、生物學、生物等效性、穩定性等各方面,確定變更實施的可行性。藥學申報資料相關政策文件 序號 文件 重點關注 01 2007年7月
《藥品注冊管理辦法》附件4 規定了藥品補充申請注冊事 項及申報資料要求,其中對于藥學研究資料是根據 注冊事項的不同要求,按照所附申報資料項目表要 求提供相應的藥學研究試驗資料 02 2014年6月
《常見變更事項的主要研究信息匯總模板》包括原 料藥生產工藝變更主要研究信息匯總模板、口服固 體制劑處方工藝變更主要研究信息匯總模板、注射 劑處方工藝變更主要研究信息匯總模板、注冊標準 變更主要研究信息匯總模板、規格變更主要研究信 息匯總模板、注射劑包裝材料和容器變更主要研究 信息匯總模板等 03 細化生產工藝變更部分,主要闡述化學原 料藥和制劑生產工藝變更時應進行的相關研究驗證 工作,并對提交的藥學申報資料等信息提出了相關 要求。 04 要求補充申請按照《藥品注冊管 理辦法》及原國家食品藥品監督管理總局 2016 年第 80 號通告的規定,提供符合要求的申報資料 05 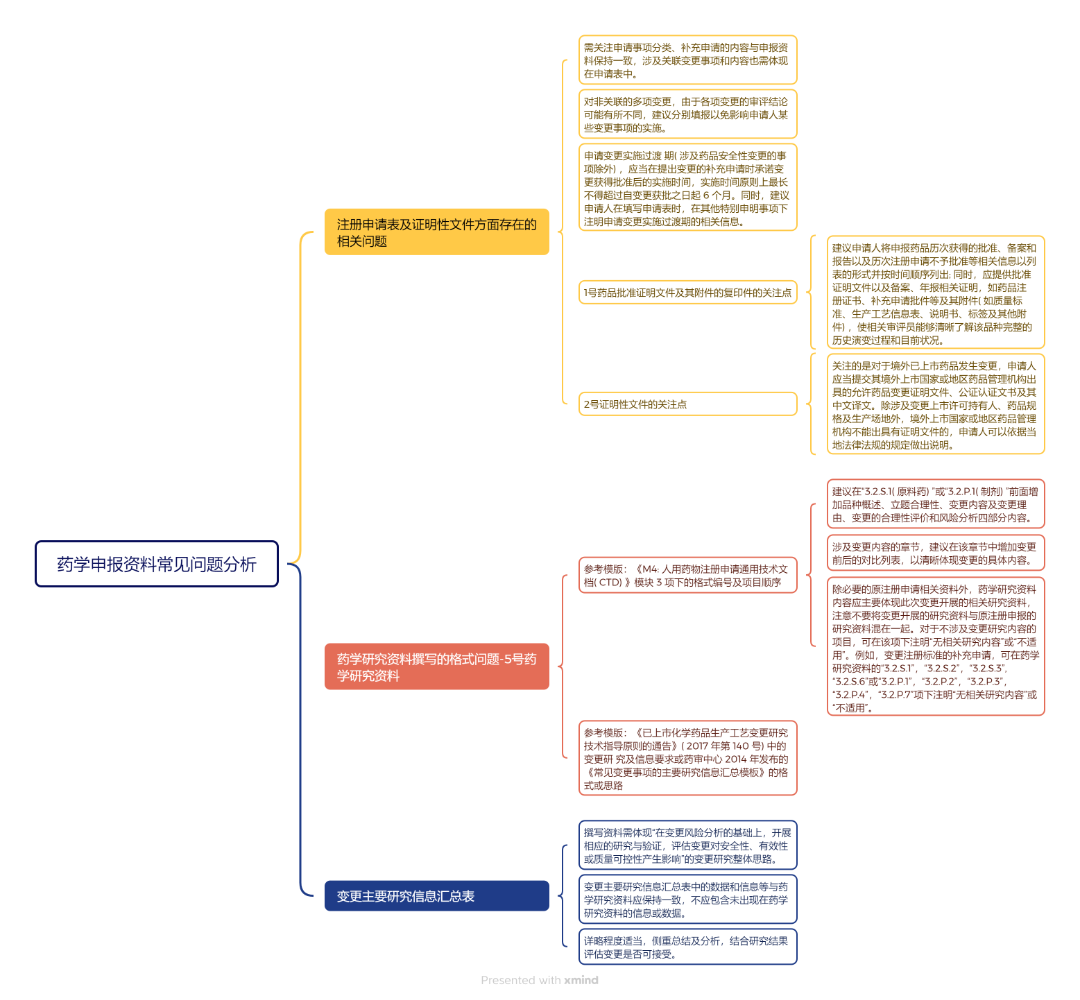
以下為全文:






聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容