
2024-08-26 09:31:36來源:鼎泰瀏覽量:402
在前幾期文章中,鼎泰團隊先后對已上市的前 4 款 siRNA 藥物進行了較為全面的復盤和分析,分別為 Patisiran(Onpattro?,點擊查看原文)、Givosiran(Givlaari?,點擊查看原文)、Lumasiran(Oxlumo?,點擊查看原文)及 Inclisiran(Leqvio?,點擊查看原文)。通過這些內容,我們深入探討了這 4 款 siRNA 藥物的臨床開發(fā)路徑、上市歷程和非臨床支持臨床轉化的關鍵環(huán)節(jié),為 siRNA 藥物臨床研究的設計、結果解讀、監(jiān)管互動的時間節(jié)點規(guī)劃,以及藥政策略制定提供了重要的參考和啟發(fā)。
作為一種有潛力的治療策略,siRNA 藥物受到了業(yè)界的廣泛關注。鼎泰團隊本次分享的是第 5 款獲批上市的 siRNA 藥物 Vutrisiran,同時也是由 Alnylam 研發(fā)上市的第二款針對轉甲狀腺素運載蛋白淀粉樣變性(hATTR-PN)的藥物。Vutrisiran 于 2022 年 6 月由 FDA 首次批準上市,此時距第 1 款治療 hATTR-PN 的藥物 Patisiran 上市(2018 年 8 月由 FDA 批準上市)不到 4 年,足以表明 Alnylam 在 hATTR-PN 領域很早就展開了深遠的布局和迭代開發(fā)。
海日生殘夜,江春入舊年。Vutrisiran 在臨床開發(fā)中展現(xiàn)出顯著的潛力,僅通過 1 項 I 期臨床研究和 1 項 III 期臨床研究(代號 HELIOS-A,中文赫利俄斯,古希臘神話中真正駕著太陽車的太陽神)即支持其上市。這一過程充分體現(xiàn)了其對產品迭代的深刻理解,對前期包括 Patisiran 在內的臨床數(shù)據(jù)和藥政策略的熟練運用,以及臨床路徑的合理優(yōu)化。
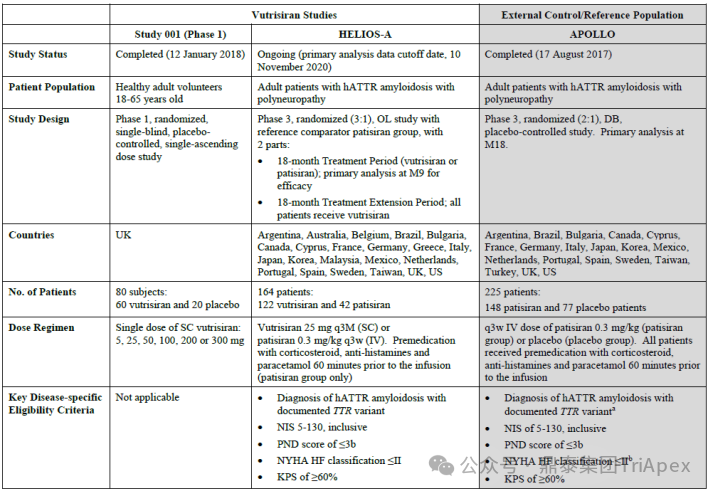
支持 Vutrisiran 上市的兩項臨床研究
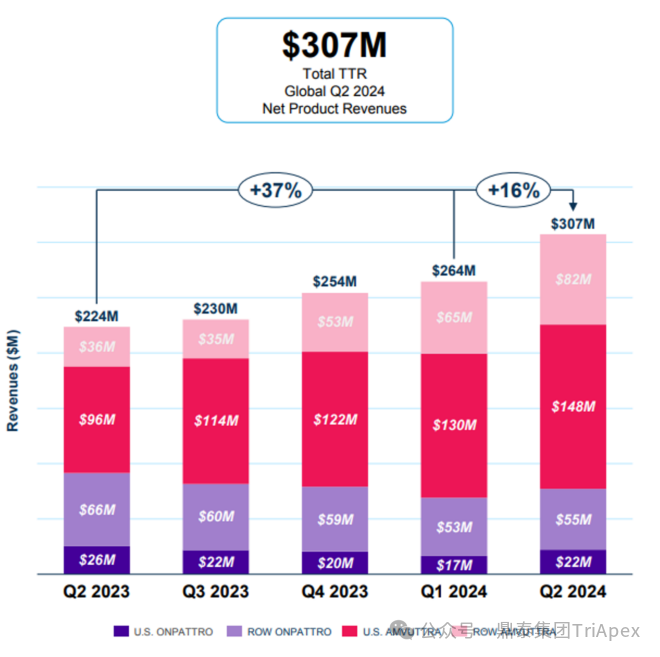
Vutrisiran 上市以來的銷售表現(xiàn) 自 Vutrisiran 上市以來,銷售勢頭強勁。根據(jù) Alnylam 公司 2024 年 8 月 1 日披露的半年報:Amvuttra 2024 H1 銷售額 4.25 億美元,同比增長 81.8%;2024 Q2 銷售額 2.3 億美元,同比增長 74%。與此同時,Alnylam 的第一代 hATTR 治療藥物 Patisiran 在 2023 年收入約 3.54 億美元,同比下降 36%。這一變化主要就是由于患者轉向了 Vutrisiran,進一步印證了迭代產品 Vutrisiran 所具有的臨床優(yōu)勢。
在本期文章中,我們將進一步探討 Vutrisiran 的臨床開發(fā)路徑,深入分析其從非臨床研究到臨床應用的轉化過程,并總結其產品迭代的研發(fā)思路。作為在寡核苷酸藥物研發(fā)領域深度賦能的 CRO,鼎泰團隊將通過本期內容詳細探討其成功的關鍵因素,為未來類似藥物的非臨床研發(fā)、臨床轉化及上市提供寶貴的見解。此外,為了更好地支持當前研發(fā)火熱的 siRNA 藥物更好地進入首次人體試驗(FIH),專門總結了已上市 siRNA 藥物臨床起始劑量設計的基本思路,以期為眾多即將進入臨床試驗的 siRNA 產品的臨床研發(fā)提供有益的借鑒。
Patisiran 及 Vutrisiran 產品外包裝
全文共:11925 字 36 圖
預計閱讀時長:30 分鐘
★ 文章導覽 ★
1 | Vutrisiran 研發(fā)背景 關鍵詞:轉甲狀腺素運載蛋白淀粉樣變性 |
2 | Vutrisiran 臨床開發(fā)路徑 關鍵詞:臨床起始劑量、2項臨床試驗 |
3 | 監(jiān)管互動里程碑 關鍵詞:EOP2、Pre-NDA |
4 | 免疫原性檢測 |
5 | 非臨床與臨床試驗相關性分析 關鍵詞:非臨床研究毒性發(fā)現(xiàn)與臨床研究相關性、已上市 siRNA 藥物臨床起始劑量設計 |
6 | 小結 |
01
Vutrisiran 研發(fā)背景
1.1 疾病背景
轉甲狀腺素蛋白淀粉樣變性多發(fā)性神經(jīng)病(transthyretin amyloid polyneuropathy,ATTR-PN)又稱轉甲狀腺素蛋白相關家族性淀粉樣變性多發(fā)性神經(jīng)病(transthyretin familial amyloid polyneuropathy,TTR-FAP),是由編碼轉甲狀腺素蛋白的TTR基因致病變異導致的一種罕見的常染色體顯性遺傳性、以周圍神經(jīng)損害為主的多系統(tǒng)疾病。TTR 蛋白主要在肝臟中產生,通常是維生素 A 的載體。關于該疾病的病因學和流行病學詳見 Patisiran(點擊查看鏈接)
1.2 siRNA-TTR 產品開發(fā)背景和迭代開發(fā)策略
Alnylam 的管線布局主要分為 5 大類:基因遺傳病、心血管代謝疾病、傳染病、中樞神經(jīng)系統(tǒng)(CNS)、眼科疾病。ATTR-PN 是 Alnylam 最早開發(fā)成藥的疾病,也是目前 Alnylam 上市產品最多、產品開發(fā)效率較高的方向,可以說是 Alnylam 探索新技術的“試金石”。
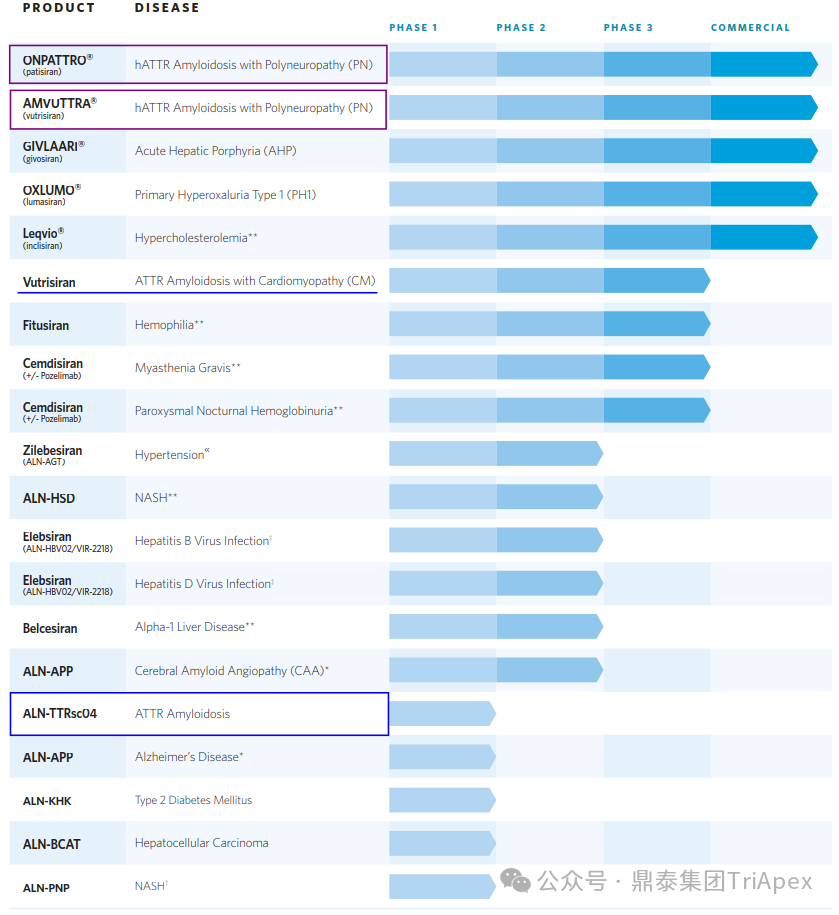
Alnylam 部分產品管線[1]
Patisiran 是 Alnylam 上市的第一款采用 LNP 遞送技術的 siRNA 藥物,適應癥為 hATTR-PN,臨床給藥途徑為 IV,Q3W,推薦劑量為 0.3mg/kg。值得注意的是,Patisiran 用藥前需要給予皮質類固醇等來減少與 LNP 相關的炎癥反應。Alnylam 在后續(xù)的管線開發(fā)中放棄了 LNP 遞送技術,轉而開發(fā) GalNAc 遞送技術。在此基礎上,Alnylam 迭代開發(fā)了 Vutrisiran,是第二款針對 hATTR-PN 的藥物,采用了 GalNAc 共軛遞送平臺,提高了 siRNA 的藥效及穩(wěn)定性。

Patisiran 化學結構示意圖
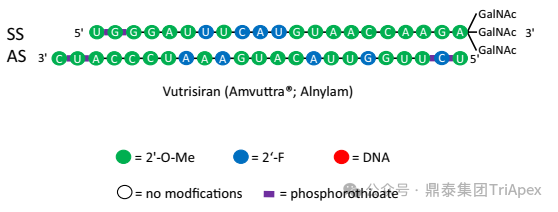
Vutrisiran 化學結構示意圖
該產品臨床給藥途徑采用 SC,相對于 Patisiran,給藥頻率延長至 Q3M,推薦劑量降低為 25 mg。此外,Alnylam 有計劃后續(xù)將給藥頻率進一步降低,達到每半年給藥一次。Vutrisiran 上市以后,Alnylam 仍針對 ATTR 繼續(xù)進行迭代產品的開發(fā)。如處于臨床階段的 ALN-TTRsc04 采用了更新一代的 IKARIA 平臺技術,有望達到更高的給藥劑量,實現(xiàn)皮下注射每年給藥一次,并將血清 TTR 水平的下調維持在 90% 以上。

Alnylam 針對 ATTR 疾病領域的技術迭代(Alnylam 公開資料)
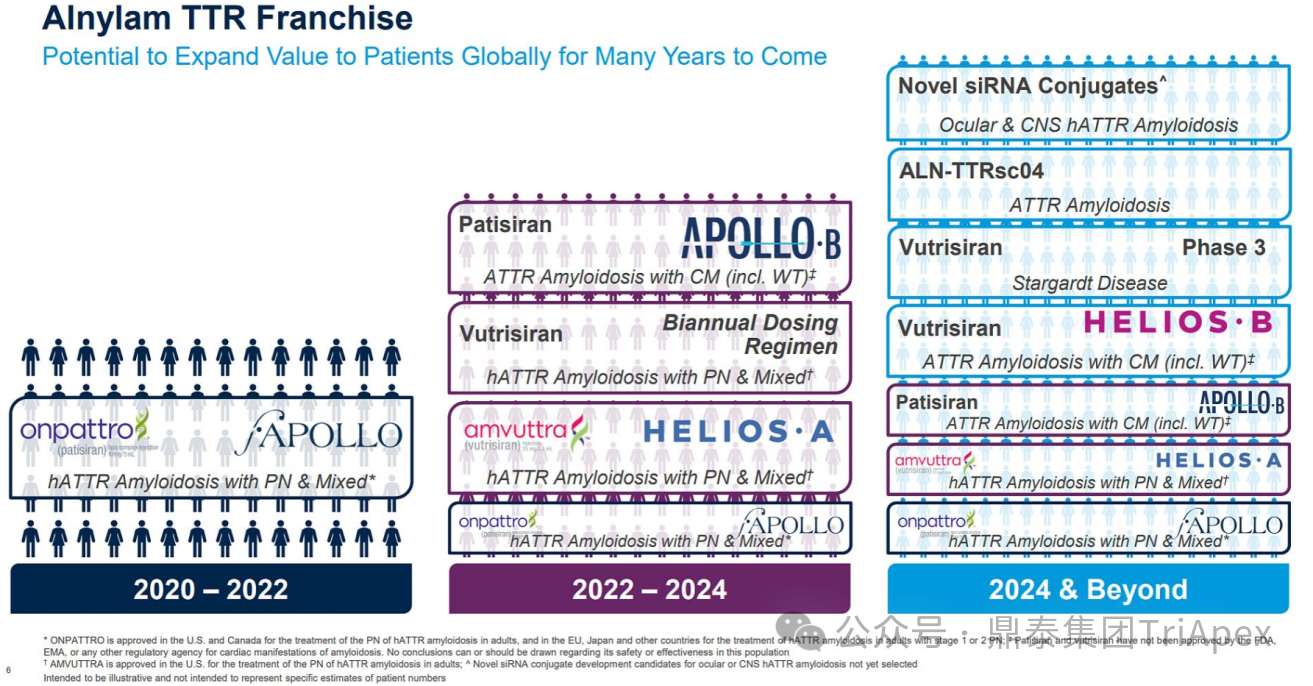
Alnylam 針對 ATTR 疾病領域的臨床試驗布局(Alnylam 公開資料)
1.3 產品上市關鍵里程碑
2016 年 06 月 07 日,由 Alnylam 在英國開展臨床 I 期試驗,用于治療淀粉樣變性(NCT02797847)。
2019 年 02 月 14 日,在阿根廷、澳大利亞和比利時等國家和地區(qū)開展III期臨床試驗,用于治療家族性淀粉樣變性和 ATTR-PN(NCT04153149; NCT03759379)。
2022 年 06 月 13 日,Vutrisiran 獲得美國食品藥品管理局 FDA 批準(NDA215515),由 Alnylam Pharmaceuticals Inc 銷售,商品名為 Amvuttra?。
2022 年 09 月 15 日,Vutrisiran 獲得歐洲藥品管理局 EMA 批準(EMEA/H/C/005852),由 Alnylam Netherlands Bv 銷售,商品名為 Amvuttra?。
2022 年 09 月 26 日,Vutrisiran 獲得日本醫(yī)藥品與醫(yī)療器械局 PMDA 批準(30400AMX00432000),由 Alnylam Japan Kk 銷售,商品名為 アムヴトラ皮下注25mgシリンジ?。

02
Vutrisiran 臨床開發(fā)路徑
Vutrisiran 從首次 IND 申請到獲批上市歷時約 6 年時間,支持 Vutrisiran 首次 NDA 批準的主要臨床試驗包含 1 項 Ⅰ 期試驗和 1 項 Ⅲ 期臨床試驗。
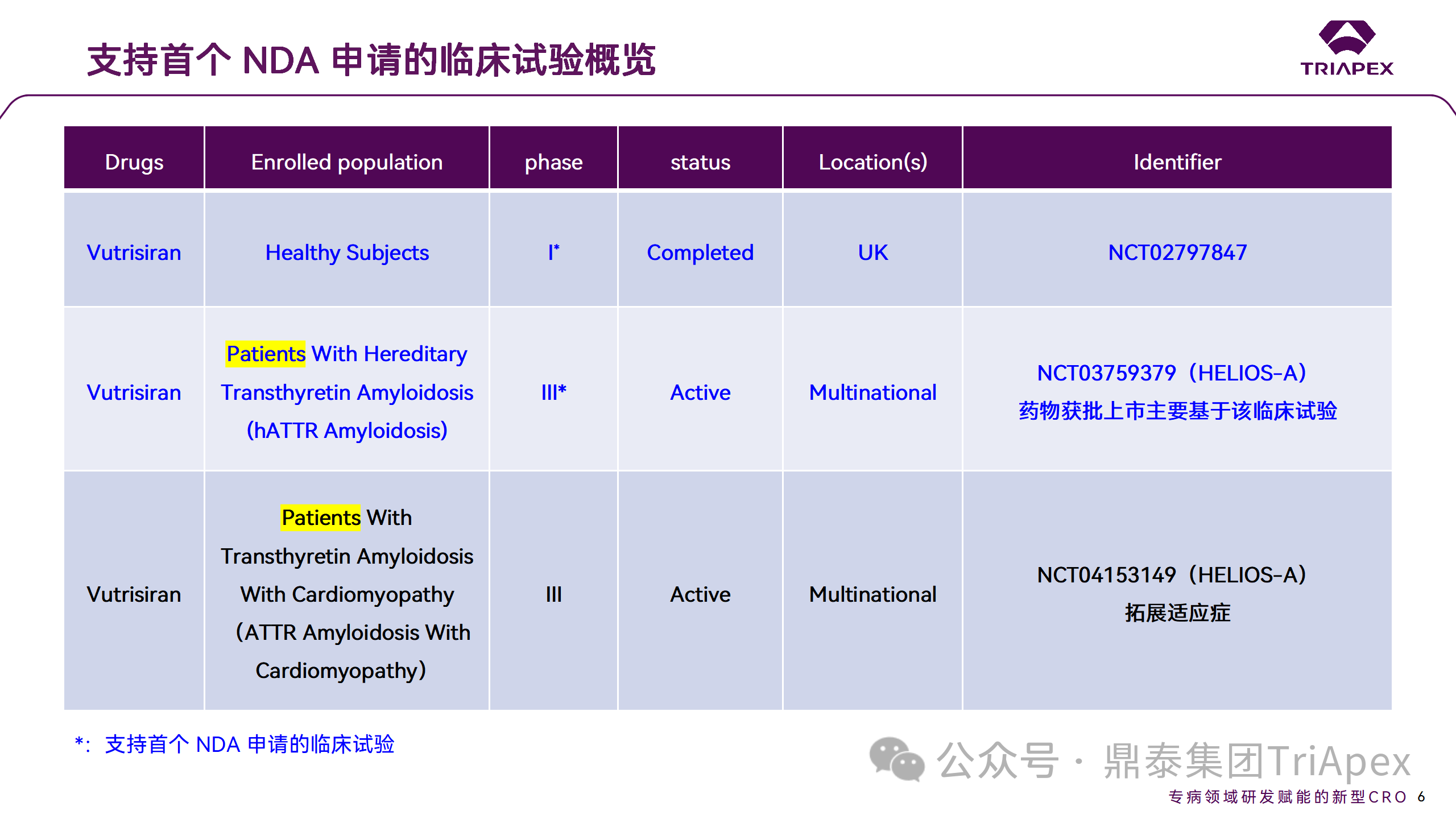
◆ I 期臨床試驗(NCT02797847)
主要目的是評估 Vutrisiran 在健康受試者中的安全性、耐受性、藥代動力學以及藥效學特征。
◆ Ⅲ期臨床試驗(NCT03759379,HELIOS-A)
主要目的是評估 Vutrisiran 對遺傳性甲狀腺轉蛋白淀粉樣變性患者的療效和安全性。在 18 個月的治療期間,參與者將接受 Vutrisiran 皮下注射(Q3W)或 Patisiran 靜脈注射(Q3W)。
該研究使用 APOLLO 研究(NCT01960348,Patisiran 的臨床 Ⅲ 期研究,詳見第一期)的安慰劑組作為 18 個月治療期間的外部對照組。在 18 個月的治療期之后,所有受試者將隨機接受每 6 個月一次(Q6M)或在隨機治療延長(RTE)期接受 Q3M 的藥物注射治療。該研究預計 2026 年 10月完成,此次 Vutrisiran 的獲批是基于該研究 9 個月的積極結果。
◆ Ⅲ期臨床試驗(NCT04153149,HELIOS-B)
主要目的是評估 Vutrisiran 25 mg (SC,Q3M) 與安慰劑相比在伴有心肌病的 ATTR 淀粉樣變性患者中的療效和安全性,將用藥適應癥拓展到心肌病人群中。該研究預計 2026 年底完成。
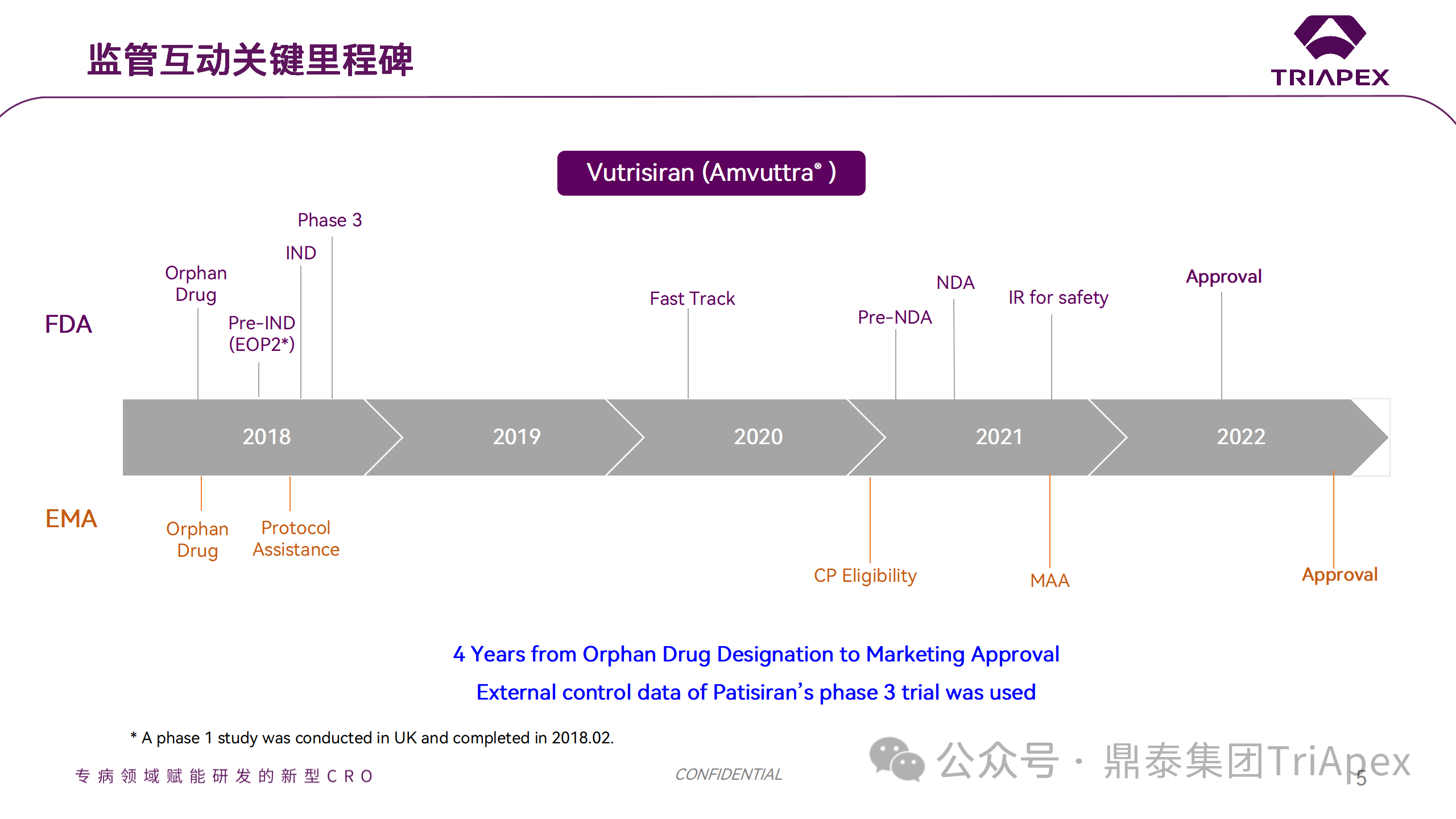
Vutrisiran 臨床開發(fā)過程中的里程碑事件
2.1 Ⅰ 期臨床試驗(NCT02797847)
這是一項 Ⅰ 期、隨機、單盲、安慰劑對照、單次遞增劑量試驗,旨在探索藥物 Vutrisiran(5-300 mg)在健康志愿者中(n = 80)的安全性、耐受性、藥代動力學和藥效學特征,同時為 Ⅲ 期臨床試驗的劑量設計提供依據(jù)。
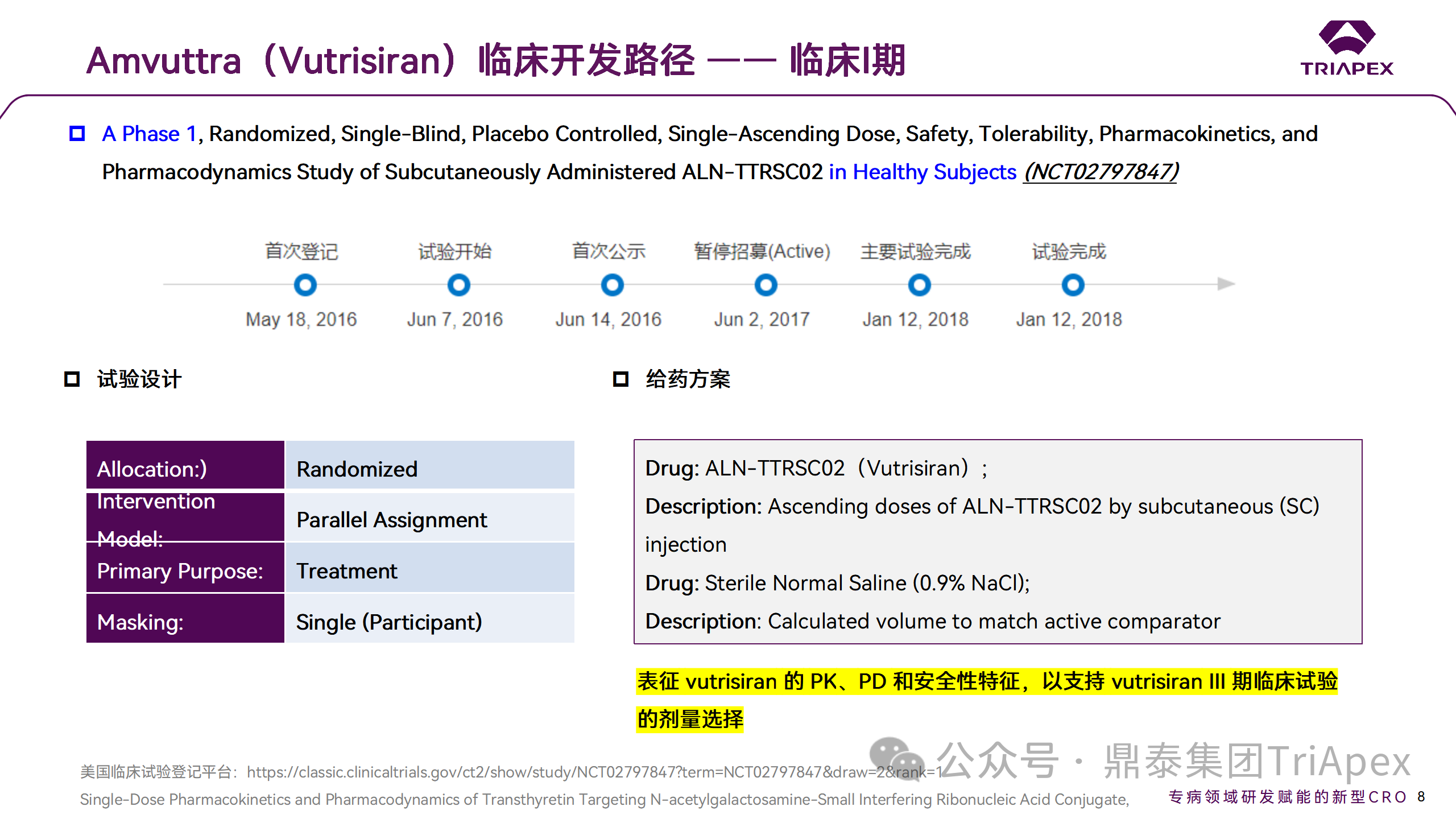
Ⅰ 期臨床試驗設計
該項 I 期臨床試驗的方案 (ALN-TTRSC02-001;NCT02797847)經(jīng)相關獨立倫理委員會及機構審查委員會批準。在英國臨床研究中心開展試驗。健康受試者(年齡 18-65 歲的男性或女性)單次皮下注射給予 Vutrisiran 或安慰劑(生理鹽水,0.9%)。
該研究起始劑量的選擇主要基于從體內非臨床研究(未發(fā)表的數(shù)據(jù))計算的安全系數(shù)[2]。被納入遞增劑量組的受試者分別接受 25、50、100、200 或 300 mg Vutrisiran,研究隊列的進展和劑量遞增規(guī)則基于臨床毒性發(fā)現(xiàn)(如與 Vutrisiran 相關的具有臨床意義的 AE)。在最初招募的 5 個隊列的基礎上,通過方案修訂,又招募了 5 個額外的隊列:5、25、50 mg,以及 2 個日本受試者隊列 (25 和 50mg),以更好地表征上述劑量下的安全性和有效性,額外的隊列開始給藥時,先前隊列中已顯示了可耐受的劑量水平(最高 50mg)。


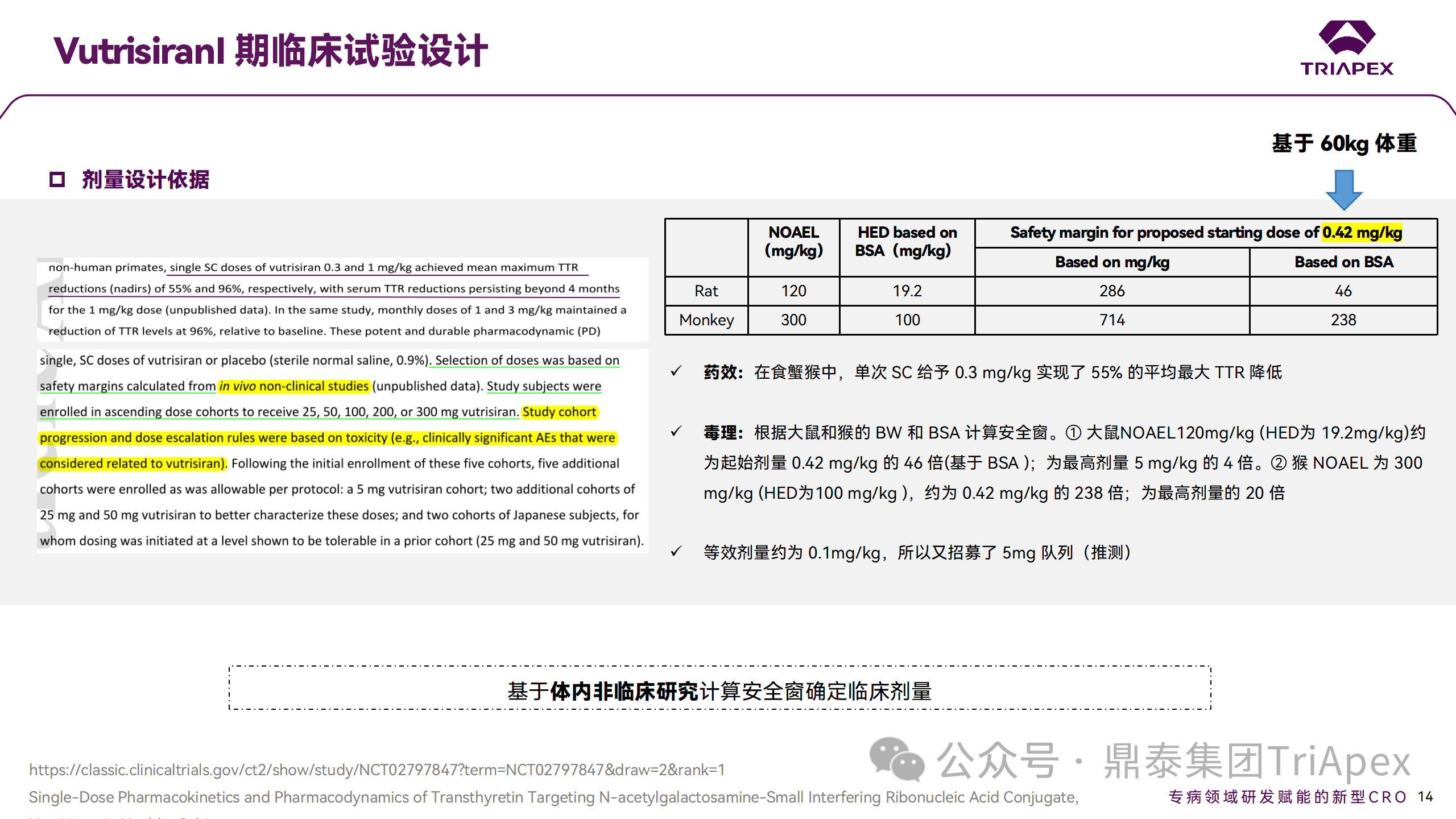
2.1.1 臨床Ⅰ期試驗起始劑量設計依據(jù)
Vutrisiran 的臨床 Ⅰ 期試驗起始劑量是基于大鼠及食蟹猴的非臨床研究,根據(jù) BW 和 BSA 計算安全系數(shù)換算而來。在安全窗下推薦的臨床起始劑量為 0.42mg/kg,按人體平均體重 60kg 計算,將首次人體試驗的起始劑量設定為 25mg。關于后續(xù)額外招募的 5mg隊列,推測是由于等效劑量約為 0.1mg/kg。
2.1.2 主要研究結果
在健康志愿者中得到的數(shù)據(jù)表明,Vutrisiran 經(jīng)皮下注射后能夠被迅速吸收,強效并持久地抑制 TTR 蛋白的表達,并且在很寬的劑量范圍內具有可接受的安全性。
皮下注射 Vutrisiran 后,10min 即可檢測到血漿濃度,3-5h 達到最大濃度。但由于肝臟的攝取,Vutrisiran 的血漿濃度迅速下降,并且在 48h后低于定量下限。但是 Vutrisiran 對 TTR 降低的影響是持久的,單劑量的 Vutrisiran 會導致持續(xù)數(shù)月的 TTR 表達降低。
在一項非臨床研究中,使用其他類似于 Vutrisiran 的 GalNAc-siRNA 的小鼠數(shù)據(jù)顯示,在 SC 給藥后 4-24h 觀察到肝臟中 siRNA 的峰值濃度,但在給藥后 3-7 天觀察到最大 RISC 負載的 siRNA 濃度和靶 mRNA 的沉默(與人類相比,大鼠達到最大 PD 效應的時間更短,這歸因于大鼠更快的代謝周期和清除,符合異速放大原理)。在這項研究中,健康志愿者經(jīng)皮下給藥后,15-25% 的 Vutrisiran 通過尿液排出體外,其余的藥物進入肝臟。這一百分比與大鼠的非臨床研究一致,該研究顯示有超過 77% 的 GalNAc-siRNA 偶聯(lián)物位于肝臟中。
降低 TTR 作為 hATTR-PN 治療策略已通過 Patisiran 得到驗證。在健康受試者中,單次 SC Vutrisiran 25mg 可導致持續(xù)約 90 天的 TTR 降低 80%。Vutrisiran 25mg Q3M 給藥方案預計可實現(xiàn) 88-90% 的 TTR 降低,這與 Patisiran III 期試驗(APOLLO)中 Q3M 給藥后的 TTR 降低(83-84%)相似。綜上所述,預計 Vutrisiran 25mg Q3M 給藥方案可帶來類似于 APOLLO 研究中觀察到的臨床獲益。試驗觀察到的積極的藥代動力學、藥效學和安全性結果支持了 Vutrisiran 的后續(xù)臨床開發(fā)。
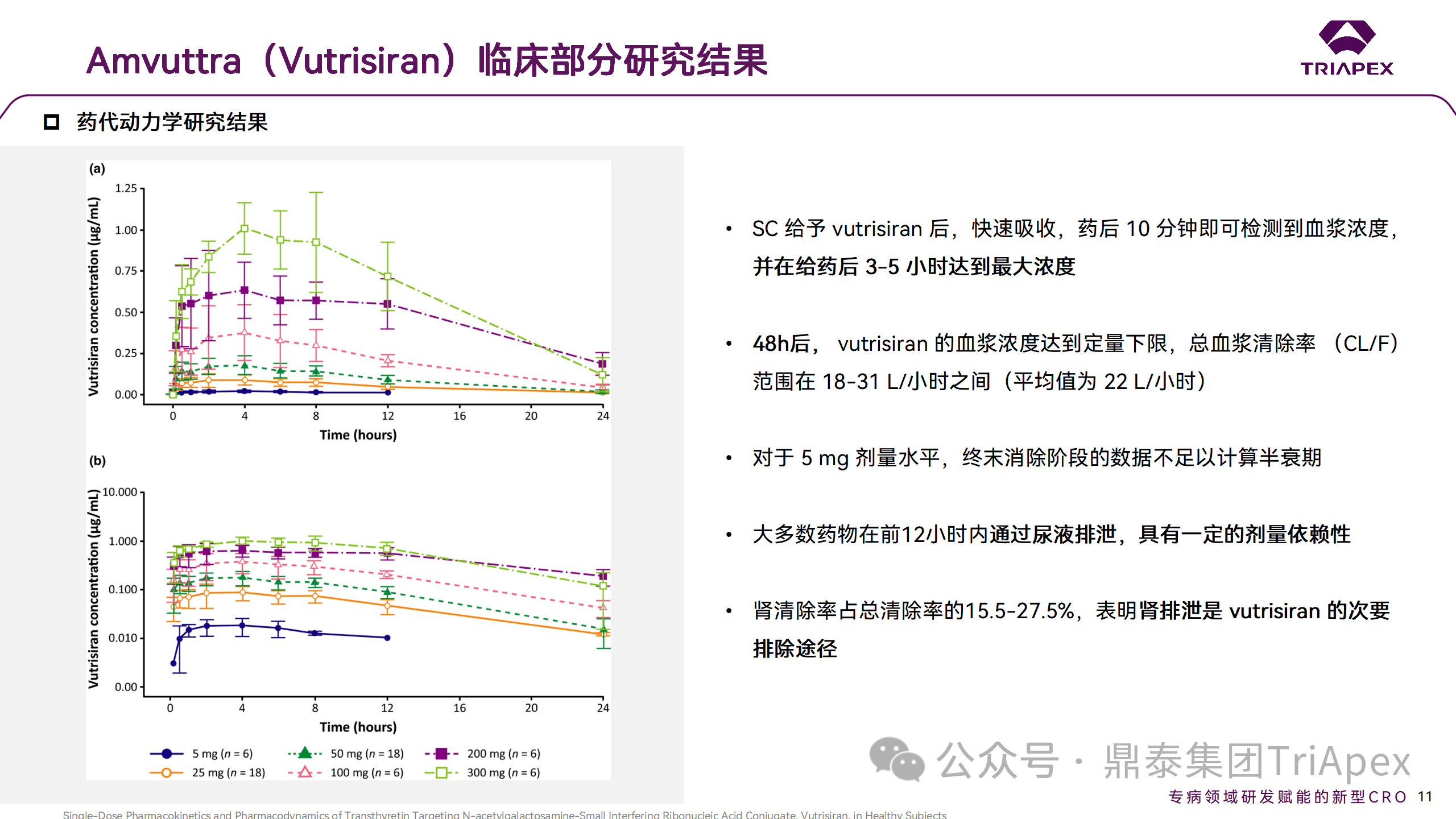
臨床藥代動力學研究結果
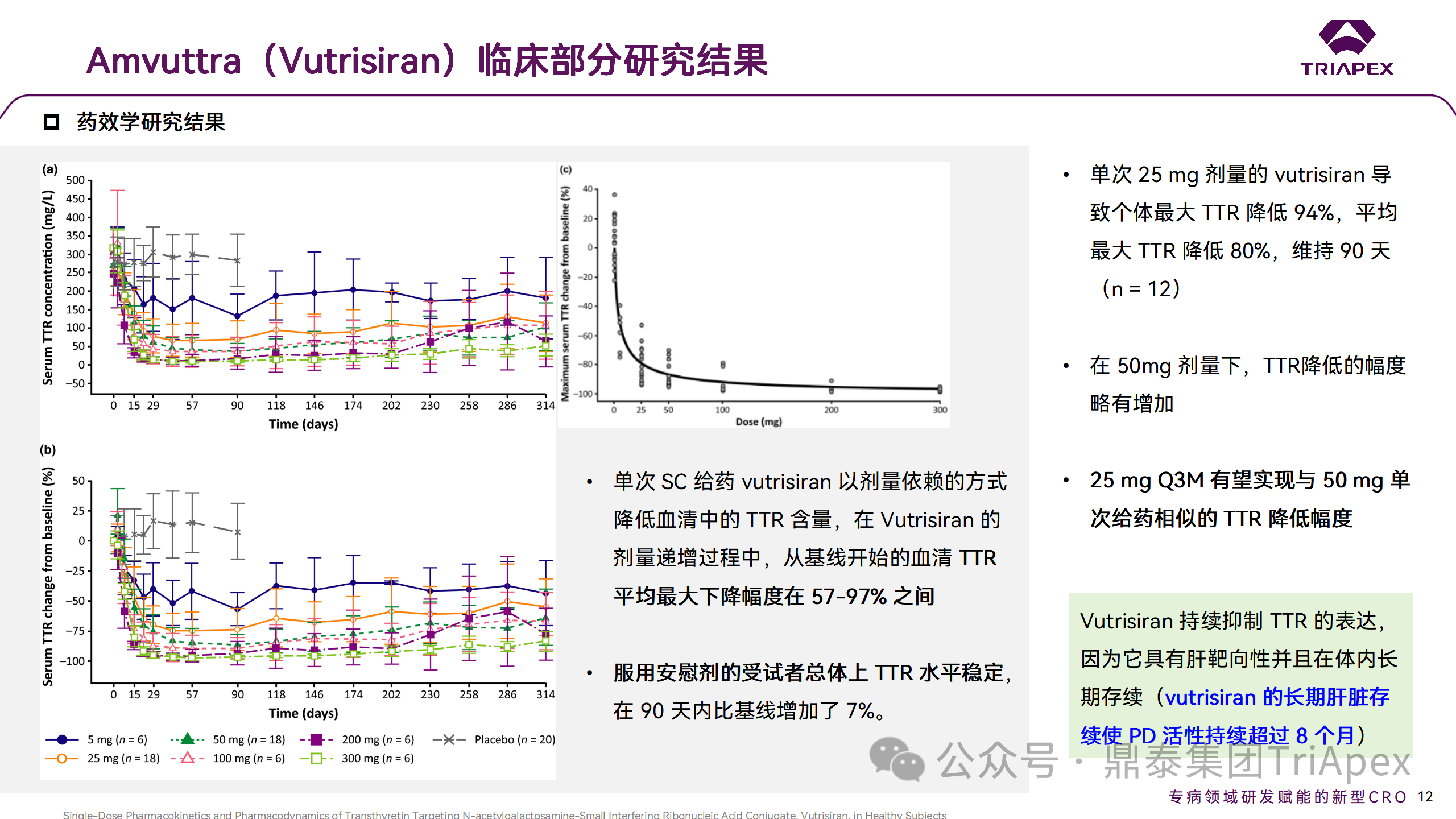
臨床藥效學研究結果
2.2 Ⅲ 期臨床試驗(NCT03759379)
HELIOS-A 研究是一項開放標簽、國際多中心III期臨床試驗,旨在評估 Vutrisiran 治療的有效性和安全性,研究方案和修訂得到了審查委員會或獨立倫理委員會的批準。入選了 164 例患有多發(fā)性神經(jīng)病的 hATTR 淀粉樣變性患者,按照 3:1 的比例隨機分為:
Vutrisiran 治療組(25mg,SC,Q3M),n=122例
Patisiran 治療組(0.3mg/kg,IV,Q3W),n=44例
來自 APOLLO 研究的外部安慰劑對照組,n=77例
治療 18 個月。研究的主要終點為與 APOLLO 研究的安慰劑外部對照組比較,Vutrisiran 治療組9 個月時評估 mNIS+7 評分(改良神經(jīng)病變損傷評分,量化肌無力、肌肉牽拉反射、感覺喪失和自主神經(jīng)損傷的評估)較基線的變化值。

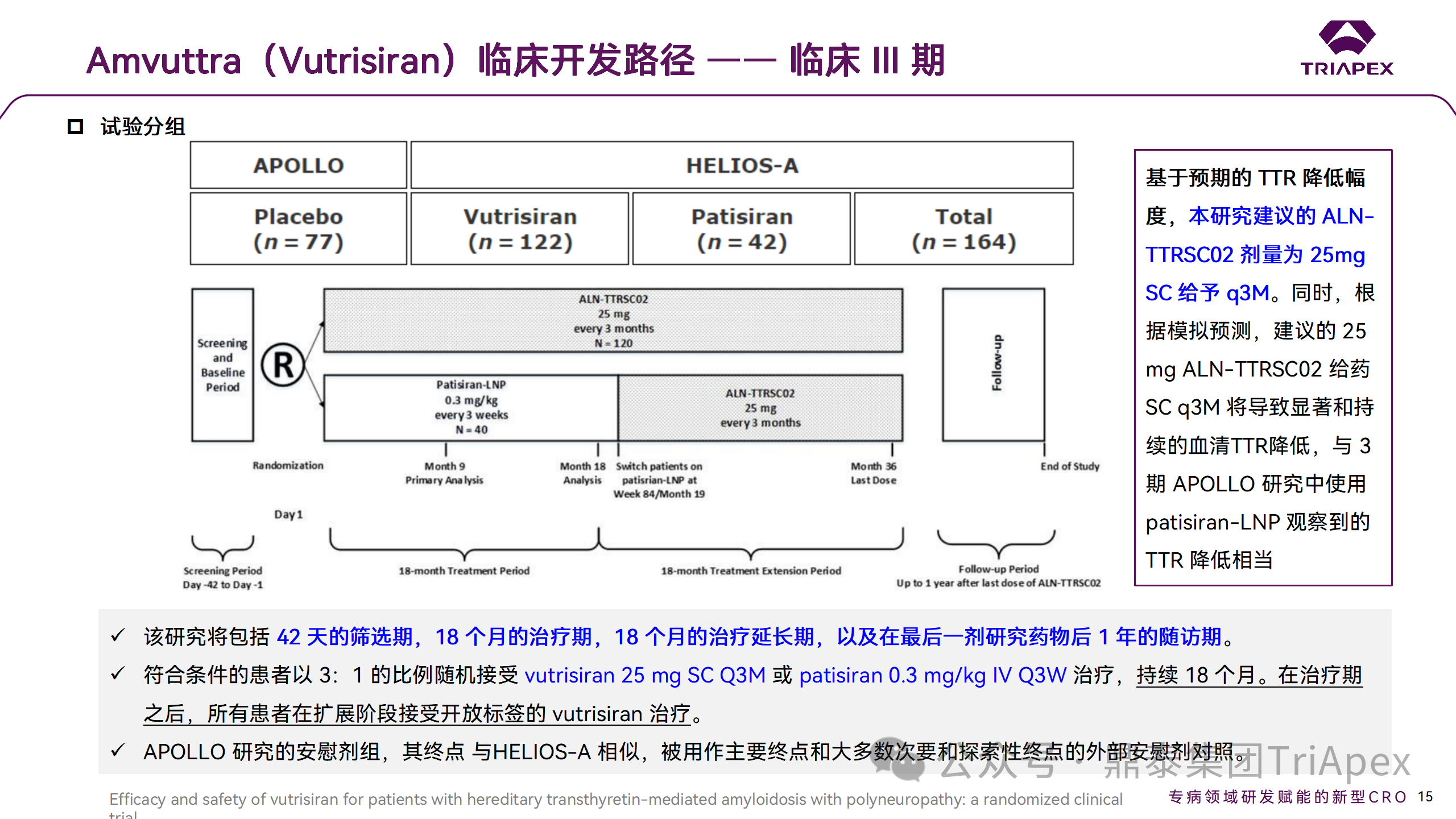
HELIOS-A 試驗設計及劑量選擇依據(jù)

2.2.1 主要研究結果
與安慰劑外部對照組相比,Vutrisiran 治療在第 9 個月時 mNIS+7 有統(tǒng)計學意義的改善,在第18個月時也觀察到了顯著的改善;同時,在第 9個月,Vutrisiran 還顯著改善了諾福克 QOL-DN 總分,在所有其他次要終點上均觀察到 Vutrisiran 治療的顯著改善,包括第 9 個月和第 18 個月的 10-MWT、 mBMI 和 R-ODS。在藥效學研究中,Vutrisiran 治療可導致血清 TTR 水平在 18 個月內快速(≤3 周)和持續(xù)的降低,相對于基線可降低 87.6% ,而外部對照組同期為15.7%[3]。
HELIOS-A 的研究結果建立在先前報道的 Patisiran 經(jīng)驗的基礎上。本實驗中,使用 Vutrisiran Q3M SC 注射液對 TTR 的抑制不遜于 Patisiran Q3W IV 輸注,證明了與 GalNac 設計相關的效力和穩(wěn)定性。
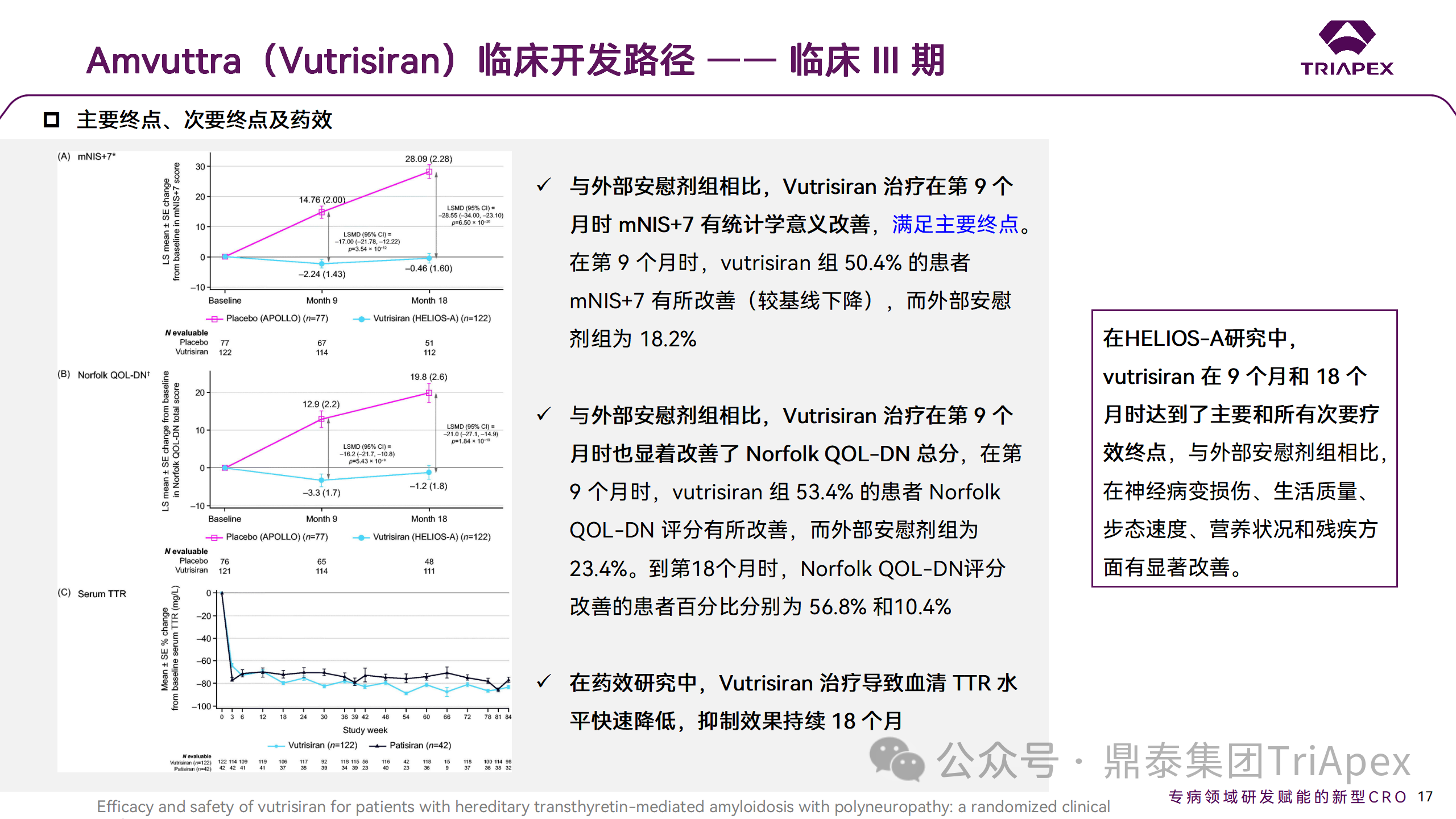
在安全性方面,沒有發(fā)生與藥物相關的停藥或死亡事件,最常報告的AE包括關節(jié)痛(11%),呼吸困難(7%)和維生素A減少(7%)。在5例患者中報告了注射部位反應(ISRs)(4%),并且都是輕度和短暫的。
綜上所述,在 HELIOS-A 研究中,Vutrisiran 在 9 個月和 18 個月時達到了主要和所有次要療效終點。與安慰劑外部對照組相比,在神經(jīng)病變損傷、生活質量、步態(tài)、營養(yǎng)狀況和殘疾方面有顯著改善,表明疾病表現(xiàn)的逆轉,患者可以在這段時間內獲得臨床益處。Vutrisiran 耐受性良好,并顯示出可接受的安全性。除了降低給藥頻率以外,與 Patisiran 組相比,siRNA 與 GalNAc 的偶聯(lián)使 Vutrisiran 的皮下給藥無需術前用藥,同時報告的 ISR AE 更少(4%)。這些都可以減輕患者的治療負擔,提高依從性,更具有臨床價值,最大限度發(fā)揮長期給藥藥物治療的益處。
基于上述III期臨床研究(HELIOS-A)9個月的積極結果,F(xiàn)DA 于 2022 年 06 月 14 日批準 Vutrisiran 上市。當然,Vutrisiran 的成功上市,不僅與合理的臨床試驗設計息息相關,也離不開與監(jiān)管的高效互動。
03
監(jiān)管互動里程碑
3.1 End of phase 2 會議
在 Vutrisiran 的上市歷程中,申請人就非臨床研究、臨床試驗設計等問題,多次與監(jiān)管緊密溝通,確保雙方就產品開發(fā)和申請策略方面達成一致,避免了不必要的耗時及資源浪費,如 Ⅱ 期臨床結束后的 EOP2 會議、上市前的 pre-NDA 會議等。

在 2018 年 7 月 17 日召開的 EOP2 會議上,申請人就 Vutrisiran 的非臨床和臨床開發(fā)計劃與 FDA 進行溝通,部分臨床相關溝通內容如下:
計劃開展的 III 期臨床試驗將允許輕度肝功能損傷患者、輕度至中度腎損傷患者入組,肝腎功能損傷對 ALN-TTRSC02 PK、PD 和安全性的影響將采用群體 PK/PD 方法進行評估。FDA 是否同意?
FDA答復:
根據(jù)提供的信息,ALN-TTRSC02 可能不會受到器官功能損傷的顯著影響。FDA 鼓勵在研究中納入中度肝腎功能損傷患者。在 III 期研究中,利用群體 PK/PD 方法來評估內在/外在因素對療效/安全性的影響是合理的。
在實際臨床試驗運行過程中,沒有針對肝腎損傷患者進行單獨的臨床試驗,在兩項臨床研究中納入了輕度至中度的腎損傷患者,在Ⅲ期研究中納入了中度肝損傷患者。在肝腎損傷患者中,未見 PK 參數(shù)的顯著差異,后續(xù)臨床用藥無需進行劑量調整;未開展針對重度肝腎損傷患者的研究。
FDA 是否同意針對擬開展的針對 hATTR 淀粉樣變性患者的單臂 III 期研究 ALNTTRSC02-002 研究設計,特別是關于外部對照、患者人群選擇的納入標準和研究的持續(xù)時間?
FDA答復:
FDA 強烈建議申辦方包含一個外部對照(作為罕見病適應癥,沒有入組安慰劑對照組,采用之前 Patisiran 的對照組作為外部對照更加倫理)來評估 ALN-TTRSC02 與現(xiàn)有療法相比帶來的益處。雖然 FDA 理解申辦方基于治療 9 個月后 Patisiran 觀察到的臨床益處,但申辦方期望觀察到 ALN-TTRSC02 臨床益處所需的時間可能與 Patisiran 不同。因此,F(xiàn)DA 建議設立 18 個月的觀察期,9個月時進行中期療效分析。
FDA 認為患者人群的納入標準是可以接受的。
FDA 是否同意 III 期研究 ALN-TTRSC02 所建議的主要終點和其他關鍵終點?
FDA答復:
主要終點 mNIS+7,是基于臨床檢查的神經(jīng)病變損害評分,評分的許多單獨組成部分(如神經(jīng)傳導研究),是生物標志物,本身并不代表直接的臨床益處,也不是臨床益處的直接衡量標準。因此,F(xiàn)DA 建議將 mNIS+7 和 Norfolk QOL-DN(或其他有臨床意義的終點)指定為共同主要終點,TTR 生物標志物百分比降低將適合作為次要終點。
綜上,申請人在 EOP2 會議中提問了有關Ⅲ期臨床試驗納入人群,臨床研究設計,主要及次要研究終點等問題,F(xiàn)DA 針對上述問題均給出了監(jiān)管層面的答復,如增加外部對照組,延長觀察時間,設立中期檢查點等,但有些建議并未被申請人采納,比如臨床試驗主要終點的設計,這可能是基于申請人對自己產品更加獨到的理解。
3.2 pre-NDA 會議
在 pre-NDA 會議中, FDA 就申請人擬提交的 clinical data package 是否足以支持 Vutrisiran 用于轉甲狀腺素運載蛋白淀粉樣變性神經(jīng)病患者治療的 NDA 審查等問題給出回復。

在 2021 年 3 月 26 日召開的 pre-NDA 會議上,申請人就 Vutrisiran 的 Clinical meeting package 與 FDA 進行溝通,部分相關溝通內容如下:
FDA 是否同意關鍵的 III 期 HELIOS-A 研究的當前結果和擬提交的臨床數(shù)據(jù)包足以支持 NDA 的審查?
FDA答復:
從表面上看,III 期研究(HELIOS-A)的結果和簡報文件中提出的臨床數(shù)據(jù)包有可能支持 Vutrisiran 提交 NDA。在提交 NDA時,將確定數(shù)據(jù)是否足夠。
從簡報文件中尚不清楚已獲得至少 1 年安全性數(shù)據(jù)的患者數(shù)量。請在提交 NDA 申請時說明將有多少患者已獲得至少1年的安全性數(shù)據(jù)。
此外,與FDA 溝通了關于 NDA data package 準備方面的問題。FDA 給出了共性建議。
綜上,在 pre-NDA 會議上,申請人沒有詢問過多的有關科學性以及試驗設計的問題,只是就當前已有數(shù)據(jù)以及格式咨詢 FDA,是否足以支持產品的 NDA 申請,說明申請人對自己的產品在科學設計及數(shù)據(jù)質量上是有信心的。
04
免疫原性檢測
4.1 Vutrisiran 非臨床免疫原性
在非臨床研究中采用經(jīng)驗證的 ELISA 法檢測食蟹猴血清中抗 Vutrisiran 的 ADA,評價免疫原性。研究結果顯示,ADA 的發(fā)生率較低,滴度較低,且 ADA 的發(fā)生未表現(xiàn)出明顯的劑量相關性,申請人認為抗藥抗體的存在不會影響食蟹猴體內的藥物暴露。這與前幾期文章中分享的其他 GalNac-siRNA 的相關研究結果類似。

4.2 Vutrisiran 臨床免疫原性
根據(jù) Ⅰ 期試驗設計,在給藥前(第 -1 天)和給藥后第 29 天和第 90 天收集受試者血樣用于抗藥抗體檢測[2]。結果顯示,僅有 1 名 (1.7%) 非日本受試者在第 29 天血液檢測呈 ADA 陽性,未見有臨床意義的顯著差異。以上結果提示,Vutrisiran 具有較低的免疫原性,且不會對療效和安全性產生影響。
在 III 期臨床試驗(HELIOS-A)中,由藥物治療導致的 ADA 發(fā)生率為 2.5%(3/120),且滴度很低(50),患者在后續(xù)的隨訪中檢測為陰性。在 ADA 陽性患者和陰性患者的 PK、PD 和療效無顯著差異。ADA 陽性患者的 Vutrisiran 血藥濃度與 ADA 陰性患者同樣無顯著性差異。ADA 陽性患者的個體血清 TTR 降低水平同樣與 ADA 陰性患者相當;在主要終點方面,ADA 陽性陰性患者在第 9 個月時的 mNIS+7 基線變化相似。由于較低的發(fā)生率和輕微的影響,ADA 的中和活性預計同樣不會影響免疫原性評估,因此未對 ADA 的中和活性進行檢測[3]。
總體而言,在 2 項臨床研究中,Vutrisiran 治療患者出現(xiàn) ADA 的發(fā)生率較低(2.2%,4/120),滴度很低(50)且是短暫的。同時,ADA 的出現(xiàn)未見時間依賴性,最早發(fā)生在第 29 天,最晚發(fā)生在第 260 天。在2項研究中,ADA 的存在均未影響 PK、PD 或安全性,在 HELIOS‐A 中未觀察到 ADA 對療效的影響[4]。

05
非臨床與臨床試驗相關性分析
藥物開發(fā)過程中,非臨床研究和臨床研究之間有著密切的關聯(lián)。非臨床研究主要在動物模型中進行,評估藥物的安全性、毒性和藥代動力學特性,提供藥物進入臨床試驗所需的基本安全性及有效性數(shù)據(jù)。基于這些數(shù)據(jù),臨床研究分為多個階段:I 期臨床關注藥物的安全性和耐受性,II 期臨床評估藥物的有效性和進一步的安全性,III 期臨床則驗證藥物在更大人群中的效果和安全性。非臨床研究為臨床研究提供了科學依據(jù),確保藥物開發(fā)過程既科學又安全。
5.1 siRNA 藥物臨床起始劑量與非臨床的相關性
FDA 指導原則 Guidance for Industry Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers(2005) 建議在采用健康志愿者進行 FIH 時,根據(jù) NOAEL 計算起始劑量(MRSD),同時基于藥理學活性劑量(PAD)考慮較低的 MRSD 的必要性。
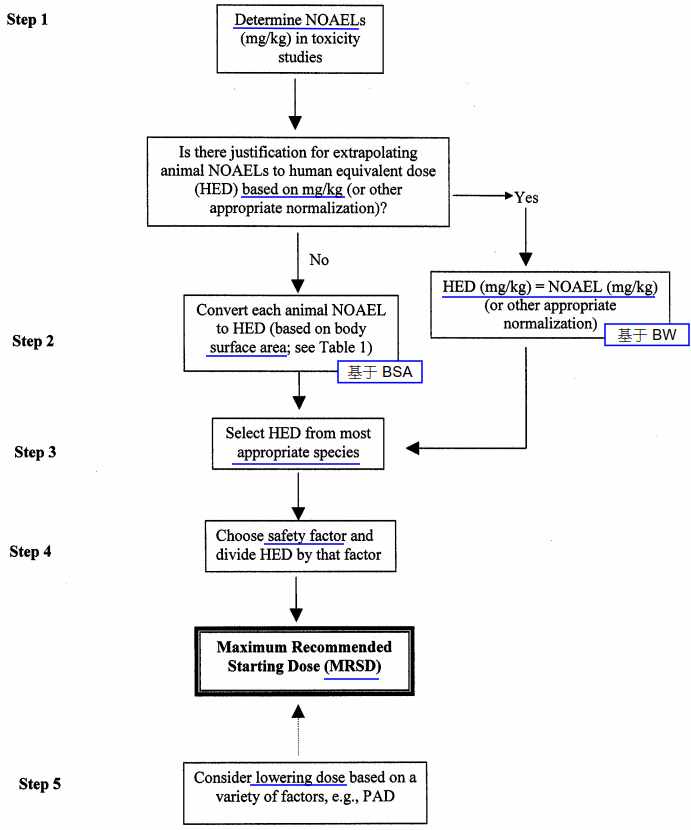
FDA 指導原則中關于健康志愿者作為受試者的 FIH 起始劑量設計依據(jù)
基于 Alnylam 的研究經(jīng)驗,包括人體在內的多個種屬的寡核苷酸藥物 PK 研究表明,將動物劑量外推至 HED 的最合適方法是基于單位體重劑量(mg/kg),而不是單位表面積劑量(mg/m2)或血漿暴露量(AUC 或 Cmax)。寡核苷酸藥物的人體等效劑量可以直接從猴外推到人體,按 mg/kg 劑量給藥的比例因子為 1.0。
鼎泰團隊通過對已上市的 siRNA 的臨床起始劑量以及非臨床 NOAEL 劑量進行匯總,發(fā)現(xiàn)了一些共性和個性的思路。如對于有 Alnylam 公司開發(fā)的產品,F(xiàn)IH 起始劑量的計算,綜合了非臨床藥理學研究中的有效劑量以及毒理學研究中最相關種屬的 NOAEL 劑量確定起始劑量。此外,我們也注意到,有部分藥物在 FIH 起始劑量組開始給藥后,入組了更低劑量的受試者人群,推測是直接從動物體內換算而來的人體等效劑量與實際檢測結果可能存在差異,或為了探索更廣泛劑量下的 PK、PD 特征,重新招募了更低劑量的受試者人群。
以下是已上市的 5 款 siRNA 藥物起始劑量設計的依據(jù),其中由 Dicerna 公司研發(fā)的 Nedosiran 的思路有所不同,詳情敬請關注他山之石系列-6。
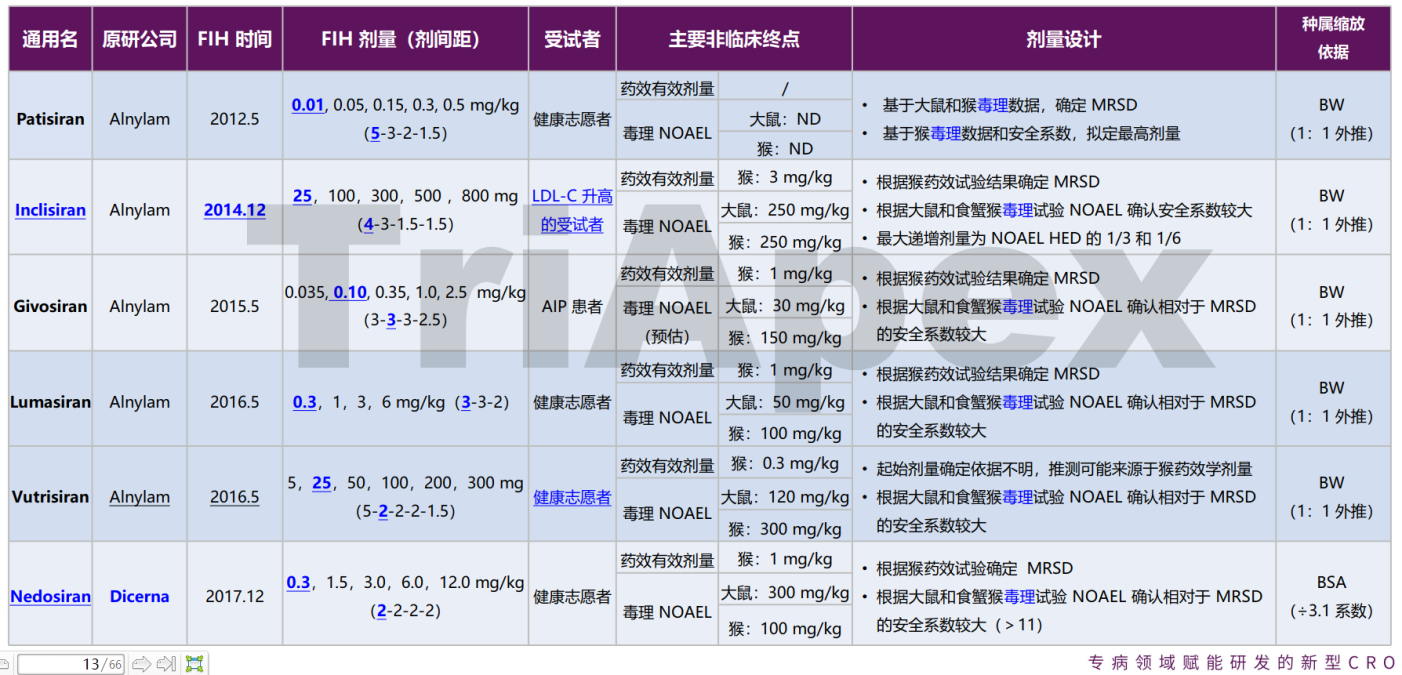
已上市 siRNA 藥物 FIH 起始劑量設計依據(jù)
5.2 非臨床與臨床試驗的相關性
| 為臨床藥效學標志物提供參考
食蟹猴體內研究表明,單次給藥及多次給藥后 Vutrisiran 可劑量依賴性持續(xù)降低血清中 TTR 蛋白的水平。在非臨床研究中觀察到的生物標志物(TTR)的變化,為臨床研究中藥物劑量設計、給藥方案及藥效標志物的選擇提供了依據(jù),因此在臨床試驗上,將 TTR 作為主要藥效學指標。將 TTR 蛋白作為臨床上的藥效標志物也得到了之前 Patisiran 研究中的支持。

| 提供劑量設置依據(jù)
非臨床階段發(fā)現(xiàn)的肝臟毒性對臨床試驗中起始劑量的設計具有影響,肝臟毒性可能會導致臨床不良反應。雖然肝臟毒性屬于 siRNA 藥物普遍存在的毒性,但在制定臨床試驗的起始劑量時,需要綜合考慮非臨床研究中發(fā)現(xiàn)的肝臟毒性數(shù)據(jù),起始劑量的選擇應在保證藥物療效的同時,盡可能降低潛在的肝臟毒性風險。需要基于非臨床毒理學研究結果、劑量反應關系以及患者的個體差異來制定,可能需要采取逐步遞增的劑量調整策略,以確保藥物在安全范圍內使用。
| 提示潛在不良反應
通過毒理學數(shù)據(jù)報告和風險評估,強調肝臟毒性的表現(xiàn)和可能的臨床后果。
設計臨床試驗時應包括肝臟功能的監(jiān)測指標。制定嚴格的劑量遞增方案和緊密的安全監(jiān)測計劃,及早發(fā)現(xiàn)和管理任何與肝臟毒性相關的副作用,有效地評估藥物的安全性并保護受試者的健康。
06
小結
作為寡核苷酸藥物領域的頭部研發(fā)機構,Alnylam 已經(jīng)積累了豐富的產品上市經(jīng)驗。憑借在技術創(chuàng)新、臨床研究策略和藥政策略方面駕輕就熟的運用和改進,不斷推進新的研發(fā)平臺和產品迭代,在這種背景下推出了 Vutrisiran。
作為 Alnylam 第二款獲得 FDA 批準的 ATTR 領域 siRNA 藥物,其上市歷程和臨床開發(fā)路徑彰顯了對前期 Patisiran 臨床數(shù)據(jù)的合理高效運用,卓越的臨床研究策略以及與 FDA 的良好溝通互動的重要性。這些因素對于加快臨床轉化和推動產品上市至關重要。借助高效的藥政策略,Alnylam 與 FDA 就產品上市歷程中的關鍵問題進行了溝通,并獲得了 FDA 的認同和支持,表明了其實驗設計的合理性以及數(shù)據(jù)的有效性。同時,利用前期Patisiran的臨床數(shù)據(jù)作為外部對照組,有效證明了迭代產品的安全性與有效性。正是基于前期 Patisiran 的開發(fā)經(jīng)驗,Alnylam 在 Ⅰ 期研究初步驗證安全性和有效性之后,敢于直接擴大受試者樣本量開展 III 期臨時研究,從而加快了產品的上市進程。這些策略和做法也為后續(xù) siRNA 藥物的研發(fā)提供了寶貴的經(jīng)驗和啟示。
Alnylam 從未止步,針對 ATTR 疾病領域展開了更加深遠的布局,期待為更多患者帶來更多的治療選擇和希望。2024年6月24日,Alnylam 宣布 Vutrisiran 用于治療 ATTR 淀粉樣變性心肌病(ATTR-CM)的III期 HELIOS-B 研究達到了主要終點。結果顯示,在雙盲期間總人群(N=654)和單藥治療人群(N=395)的全因死亡率和復發(fā)性心血管事件的發(fā)生率顯著降低,所有次要終點均獲得統(tǒng)計學顯著改善。HELIOS-B 研究表明,Vutrisiran改 善了所有 ATTR 心肌病患者組的心血管狀況,包括生存、功能和生活質量,且安全性可控。Alnylam 計劃在 2024 年下半年向全球監(jiān)管機構提交補充上市申請,包括使用優(yōu)先審評券[5]向 FDA 提交補充新藥申請(sNDA)。
綜上,Vutrisiran的成功再次印證了與監(jiān)管機構的溝通、優(yōu)化臨床試驗設計以及充分利用非臨床研究結果和以往臨床經(jīng)驗的重要性,這些策略為后續(xù) siRNA 藥物的研發(fā)提供了重要經(jīng)驗和啟示。Alnylam 正在更多疾病領域進行更深遠的布局,期待為更多患者帶來治療選擇和希望。
下期,鼎泰團隊將分享他山之石系列的最后一期 —— Nedosiran,傳承和差異化并存,敬請期待。
參考資料:
[1] Alnylam官網(wǎng):https://www.alnylam.com/alnylam-rnai-pipeline
[2] Habtemariam BA, Karsten V, Attarwala H, et al. Single-Dose Pharmacokinetics and Pharmacodynamics of Transthyretin Targeting N-acetylgalactosamine-Small Interfering Ribonucleic Acid Conjugate, Vutrisiran, in Healthy Subjects. Clin Pharmacol Ther. 2021;109(2):372-382.
[3] Adams D, Tournev IL, Taylor MS, et al. Efficacy and safety of Vutrisiran for patients with hereditary transthyretin-mediated amyloidosis with polyneuropathy: a randomized clinical trial. Amyloid. 2023;30(1):1-9.
[4] FDA reviews of Vutrisiran. 2022
[5] Alnylam官網(wǎng)信息:https://investors.alnylam.com/press-release?id=28321
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內容


微信公眾號

藥方舟手機版

