
2024-07-29 12:00:29來源: QA and MAH部落瀏覽量:1563
關鍵網傳的這個飛行檢查缺陷匯總,據說是省局2024年即今年進行匯總的缺陷,從微信群還有注明公眾號平臺都有看到分享,本身飛行檢查缺陷匯總不稀奇,但是這次飛行檢查匯總的缺陷感覺被之前的其他缺陷嚴了很多,有些缺陷感覺都是平時很多藥企都會存在的缺陷,也是作為嚴重缺陷落下,只能說現在監(jiān)管部門對企業(yè)的質量管理要求越來越嚴格,對于很多A證企業(yè),C證企業(yè)人員配備一般比較充足,可能還好點,但是對于很多B證企業(yè),本身人員配備可能就不是那么充足,又加上人員對質量管理體系運行存在盲點,對工藝也不是那么熟悉,所以在委托生產監(jiān)管過程中,可能會存在很多疏漏,至少與A,C證相比可能會存在一些欠缺,咱們一起看下,都有哪些缺陷:
1.1《胞磷膽堿鈉注射液工藝驗證報告》,對生產批量由10萬支增至15萬支進行驗證,未對產品在水浴滅菌器中的裝載數量及裝載方式進行確認。【分析:未對工藝驗證產品在水浴滅菌器中的裝載數量及裝載方式進行確認,這樣也是嚴重缺陷,裝載數量與裝載方式確實會影響滅菌的效果,工藝驗證過程未沒有考慮到滅菌的效果,落嚴重缺陷確實也是說的通的,不過這個也確實是看檢查老師個人的,監(jiān)管趨嚴,工藝驗證需要考慮的全面】
1.2《胞磷膽堿鈉注射液工藝時限驗證報告》,僅對存放0、8、10、12小時的產品進行無菌檢測,未對有關物質等質量指標進行考察。【分析:工藝嚴重問題:《胞磷膽堿鈉注射液工藝時限驗證報告》,僅對存放0、8、10、12小時的產品進行無菌檢測,未對有關物質等質量指標進行考察。這一條個人感覺應該很多企業(yè)都會遇到,工藝驗證時限檢測項目不全,很多企業(yè)是跟進自己的風險評估進行的檢驗項目的確認,這一條缺少有關物質等質量指標考察,也作為嚴重缺陷,說明現在藥監(jiān)部門監(jiān)管還是非常嚴格的,有可能是針對這個產品,儲存時限對有關物質的影響比較大】
2、質量控制檢驗存在問題:
2.1 胞磷膽堿鈉注射液質量標準【含量測定】項下要求進樣量為10μl,實際操作進樣量為20μl,企業(yè)未啟動偏差調查,而是將原始檢驗記錄中高效液相色譜圖的進樣量手工修改為10μl,且企業(yè)審核過程沒有發(fā)現該問題。【分析:這一條落嚴重缺陷真的是一點不冤枉,這是數據真實性的問題,是一條紅線,如果按照前段時間,四川同創(chuàng)康能藥業(yè)有限公司,因檢驗人員批檢驗記錄鑒別造假,檢驗人員與質量負責人皆被罰款,禁業(yè),那這一條深究的話,也是一樣的,可以罰款加禁業(yè)的,四川同創(chuàng)罰款禁業(yè)文章鏈接(“飛來橫禍”:檢驗記錄造假,質量負責人、檢驗人員全都罰款,禁業(yè)!!)】
2.2 胞磷膽堿鈉含量測定的原始檢驗記錄中,高效液相色譜圖無進樣時間、操作人等信息。【分析:原始記錄無法追溯,這樣的情況可能性有很多,有可能是造假,有可能原始數據丟失,也有可能只是紙質圖譜中沒有進樣時間操作人,電子數據里是有的,若是前兩種情況,對于藥企來說是不應該的,若是最后一種情況,那也不會是嚴重缺陷,所以這一條是嚴重缺陷,那大概率就是造假,跟前一條差不多,也是可以罰款,禁業(yè)的,這樣想想,質量受權人是真的高危職業(yè),檢驗人員大部分情況下,都是身不由己,一般檢驗人員都不愿意造假的,檢驗人員受制于QC經理,QC經理受制于質量負責人,質量負責人受制于老板,所以最終企業(yè)的質量文件或者誠信文件咋樣,還是得看企業(yè)負責人的態(tài)度】
2.3 胞磷膽堿鈉注射液采用高效液相色譜法進行含量測定、有關物質考察,未按《中國藥典》要求進行系統(tǒng)適用性試驗。【分析:個人感覺這一條,從字面意思來看,不至于嚴重缺陷的,但是既然落了嚴重缺陷,應該是有其原因的,可能與前兩條是連在一起的,不過系統(tǒng)適用性試驗沒有做,或者未按照藥典要求做,這個正常情況是不應該的,這是對于HPLC檢驗人員來說是常識,責任人還是在QC經理或質量負責人,檢驗人員一般不會自作主張去不按要求進行系統(tǒng)適用性,可能SOP這么規(guī)定,或者QC經理要求這么做,即使QC檢驗人員,真的做的不符合要求,QC經理、QA,質量負責人也應該有人能審核出來,所以質量部門領導需要負責任】
2.4 質量控制部采用進口胞磷膽堿鈉標準物質“作為藥品檢驗對照品,用于原料胞磷膽堿鈉及胞磷膽堿鈉注射液12個月持續(xù)穩(wěn)定性考察。未將該進口標準物質與法定對照品進行比對標化即投入使用。【分析:其實這一條,單獨來看的話,也不至于是嚴重缺陷,穩(wěn)定性考察用的進口對照品,一般國內檢驗老師對FDA或EMA的對照品也是認可的,即使用的進口對照品不是官方的,但是也不至于落嚴重缺陷,而且還是穩(wěn)定性考察的檢驗,怎么就因為未與法定標準品進行對比就落嚴重缺陷,單純這一條,不至于,可能還是跟上一條一樣,是這幾天合并到一起的,所以嚴重缺陷】
3、質量管理體系不能有效運行:
3.1 公司質量管理人員不足;3.2 未對廠房設施進行變更控制。如新建陰涼成品庫、將原陰涼成品庫改為試劑庫、將原常溫成品庫改為粗品庫、在液體庫中存放固體物料和建筑材料等均未進行變更控制。3.3 未進行產品質量回顧分析。【分析:這三條還是一起看吧,單獨看落的缺陷不至于是嚴重缺陷,整個大標題是質量體系不能有效運行,這個大標題肯定是可以落嚴重缺陷的,3.1具體的質量管理人員不足,單看不至于嚴重缺陷,3.2未對廠房設施進行變更控制,但看也不至于嚴重缺陷,不過如果全部未進行變更控制,嚴重缺陷也正常,單獨一個,或兩個未進行變更控制,不至于嚴重缺陷,3.3未進行產品質量回顧分析,這條也一樣,單獨看的不至于嚴重缺陷,但是這些加一起,讓檢查老師覺得質量體系不能正常運行,那老師就可能懷疑其他的質量體系運行方面也不符合要求,所以落了嚴重缺陷】
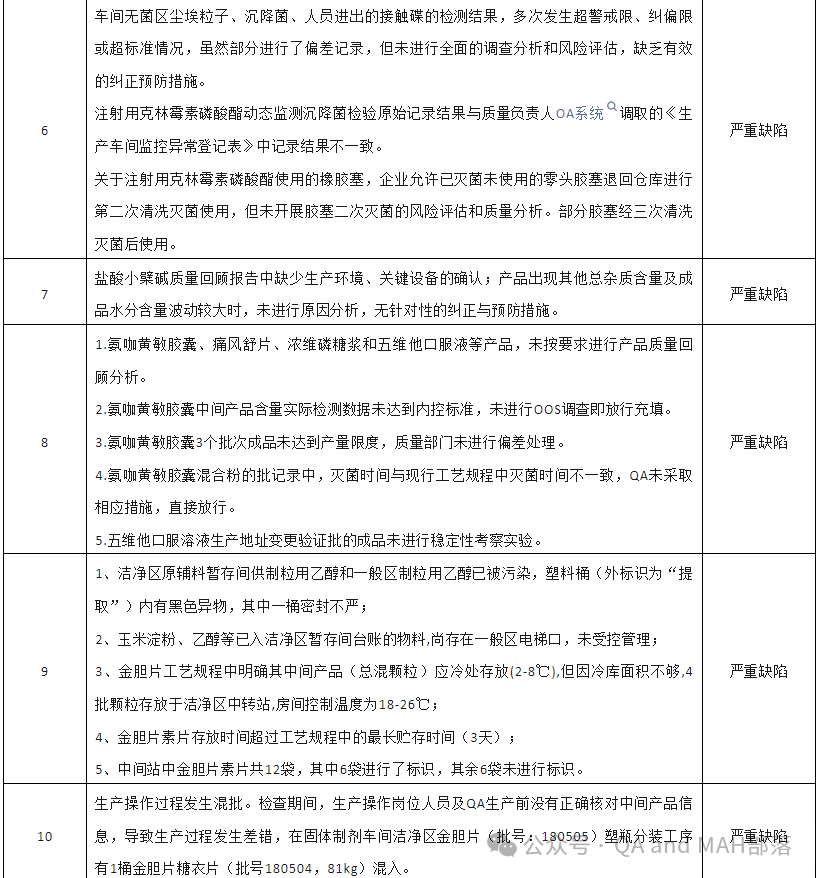
6.1 車間無菌區(qū)塵埃粒子、沉降菌、人員進出的接觸碟的檢測結果,多次發(fā)生超警戒限、糾偏限或超標準情況,雖然部分進行了偏差記錄,但未進行全面的調查分析和風險評估,缺乏有效的糾正預防措施。【分析:這一條是很多企業(yè)比較常見的情況,出現了偏差,也進行了偏差調查,但是未進行完全調查,CAPA自然也是為了CAPA而CAPA,個人感覺這樣的情況是偶爾一次還是情有可原,但是若是很多偏差都是這樣的情況,那就是故意的,那就明知故犯,嚴重缺陷應該的】
6.2 注射用克林霉素磷酸酯動態(tài)監(jiān)測沉降菌檢驗原始記錄結果與質量負責人OA系統(tǒng)“調職的《生產車間監(jiān)控異常登記表》中記錄結果不一致。【分析:這可能涉及真實性問題,所以嚴重缺陷,也不冤枉】
6.3 關于注射用克林霉素磷酸酯使用的橡膠塞,企業(yè)允許已滅菌未使用的零頭膠塞退回倉庫進行第二次清洗滅菌使用,但未開展膠塞二次滅菌的風險評估和質量分析。部分膠塞經三次清洗滅菌后使用。【分析:重復滅菌還是需要評估其風險和質量分析的,畢竟是無菌注射液的關鍵包材,可能滅菌會影響其質量的,也可能影響其包材相容性的】
8.1 氨咖黃敏膠囊、痛風舒片、濃維磷糖漿和五維他口服液等產品,未按要求進行產品質量回顧分析。8.2 氨咖黃敏膠囊中間產品含量實際檢測數據未達到內控標準,未進行00s調查即放行充填。8.3 氫咖黃敏膠囊3個批次成品未達到產量限度,質量部門未進行偏差處理。8.4 氫咖黃敏膠囊混合粉的批記錄中,滅菌時間與現行工藝規(guī)程中滅菌時間不一致,QA未采取相應措施,直接放行。8.5 五維他口服溶液生產地址變更驗證批的成品未進行穩(wěn)定性考察實驗。【分析:第八條還是得連在一起看,有的單獨一小條,不至于嚴重缺陷,但是合并到一起嚴重缺陷就正常了,8.1產品質量回顧分析藥企必做的一件事,居然四個產品都未做,QA人員在干嘛,質量負責人在干嘛,這些產品未做質量回顧分析,都不管不顧?8.2中控未不合規(guī),還未做調查,真的不知道QA與QC都怎么想的,質量負責人肯定知道,知道了還不做調查,那就等著背鍋吧,8.3這一條與8.2一樣,質量負責人需要負責;8.4批記錄與現行工藝規(guī)程不一致,嚴重缺陷不冤枉,且出現了不一致,QA還未采取措施,還直接放行了,那嚴重缺陷,算是輕的,直接pass都沒得說,這肯定是質量負責人需要負責的,8.5場地變更未進行穩(wěn)定性考察,你能相信?變更前后質量可比性怎么比較?想不通,這質量負責人在干嘛,這個事情都不做】
9.1 潔凈區(qū)原輔料暫存間供制粒用乙醇和一般區(qū)制粒用乙醇已被污染,塑料桶(外標識為“提取”)內有黑色異物,其中一桶密封不嚴;【分析:潔凈區(qū)原輔料暫存間的管理缺失,等于沒有管理,車間的負責人能不知道嗎?現場QA從未檢查過?車間潔凈區(qū)管理人員都干嘛,有一個人較真起來,也不會出現這樣的情況,還是說這些人都知道,只是不管不管,都懷著僥幸心理,所以嚴重缺陷活該】
9.2 玉米淀粉、乙醇等已入潔凈區(qū)暫存間臺賬的物料,尚存在一般區(qū)電梯口,未受控管理;【分析:同上一條】
9.3 金膽片工藝規(guī)程中明確其中間產品(總混顆粒)應冷處存放(2-8℃),但因冷庫面積不夠,4批顆粒存放于潔凈區(qū)中轉站,房間控制溫度為18-26℃;【分析:這個是明星的明知故犯,存儲溫度相差這么多,也敢放,若是18-26℃經過風險評估或做過驗證也對中間產品質量沒有影響的話,那直接變更就好了,不能因為放不下就不管質量了,嚴重缺陷是自找的】
9.4 金膽片素片存放時間超過工藝規(guī)程中的最長貯存時間(3天);【分析:這個正常情況,超過多久,進行風險評估,看看超過了最長儲存時間,是否對產品質量有影響,若是無影響,或者有實驗數據證實,那超過貯存時間也可以解釋,或者直接做變更,但是一般老師看到未按照工藝規(guī)程進行生產的,又沒有合理解釋的,肯定是嚴重缺陷】
9.5 中間站中金膽片素片共12袋,其中6袋進行了標識,其余6袋未進行標識。【分析:這是妥妥的管理問題,沒啥好說的】
11.1 工藝再驗證產品未進行質量評估和穩(wěn)定性考察,企業(yè)整改僅對相關人員進行了《留樣管理規(guī)程》和《產品持續(xù)穩(wěn)定性考察管理規(guī)程》的培訓和考核。解郁安神顆粒原批量為10萬袋企業(yè)進行了工藝再驗證,變更批量為20萬袋。上述三批產品未進行質量評估和穩(wěn)定性考察不足以支持進行批量變更。【分析:這產品都是上市這么久了,這些低級錯誤還能犯,工藝再嚴重還不進行質量評估和穩(wěn)定性考察,產品批量變更都不進行質量評估,也不進行穩(wěn)定性考察,這研發(fā)企業(yè)都不敢這么做的吧,產品上市了,還能這么隨便,想怎么干就怎么 干,質量負責人在干嘛,公司有質量體系嗎?真的讓懷疑公司沒有質量負責人,沒有質量體系一樣】
11.2 未對解郁安神顆粒干膏粉的貯存時限(企業(yè)規(guī)定貯存期6個月,復驗后可再貯存6個月)進行驗證。企業(yè)整改僅對歷史檢驗記錄數據的水分、微生物進行回顧分析,未制定干粉貯有時限驗證方案進一步對干音粉有效指標(如含量)進行考察。【分析:同上】
13.1 現場檢查時,注射用鹽酸頭孢甲肟的包裝工序未監(jiān)測光照強度、溫度等產品影響因素。批記錄顯示注射用鹽酸頭孢甲肟(規(guī)格:1.0g)分裝、軋蓋操作結束時,未記錄溫、濕度。【分析:既然已經知道光照強度與溫度對產品影響,批記錄又不記錄,這是自作孽不可活,這是低級錯誤,不應該犯的錯誤】
13.2 鹽酸頭孢甲肟與無水碳酸鈉混合驗證時,僅提供了兩批產品的驗證數據,且無不同時間、不同取樣點的描述,對數據分析不全面。【分析:這三批工藝驗證,只能提供兩批驗證數據,這是也是夠無語的,難道只做了兩批?這也就罷了,不同時間,不同取樣點還沒有描述,這工藝驗證是怎么進行的,生產負責人,質量負責人這些都沒有看的嗎?犯這樣的錯誤?不應該】
13.3 注射用水日常記錄的數據與儀器監(jiān)測的數據出現偏離未及時調查原因。【分析:這一條單獨看,不至于嚴重缺陷的,不過畢竟是注射用水,出現偏離還是需要調查原因的,注射用水關乎產品安全性的】
13.4 鹽酸頭孢甲肟采用西林瓶包裝留樣,與市售包裝不一致,也未采用模擬包裝。【分析:這是什么操作,留樣保證與市售包裝不一致,還留樣做什么,不懂啥情況,難道這個藥非常貴,舍不不得留樣?也不至于吧】
13.5 企業(yè)變更管理臺賬中,對變更原輔料供應商等重要變更等級均評定為中度變更,與制定的變更管理規(guī)程不一致。【分析:這一條感覺有點奇怪,變更原輔料供應商可以評估為中度變更的,這與制定的變更管理規(guī)程不一致,是什么情況,SOP中寫的是重大變更?做變更評估都不按照SOP規(guī)定進行,這是什么騷操作的,有點看不懂】
13.6 培訓檢驗員使用了一瓶注射用鹽酸頭孢甲肟,無取樣記錄。【分析:低級錯誤】
13.7 質量部的個別取樣員未經取樣相關培訓;碳酸鈉含量檢測原始記錄無計算公式,直接由電腦計算,無法體現修約規(guī)則,易產生誤差。【分析:低級錯誤,不應該犯這樣的錯誤,經常發(fā)生,那就是質量管理體系有問題,不能正常運行】
13.8 部分檢驗項目原始記錄未代入滴定液校正值進行計算,例如低硼硅玻璃管制注射劑瓶內表面耐水性檢測未將0.01mol/L的鹽酸滴定液校正值代入計算。【分析:低級錯誤】



聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容