
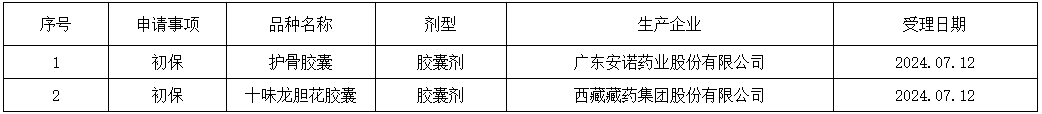
2024-07-16 14:20:37來源:注冊圈瀏覽量:348








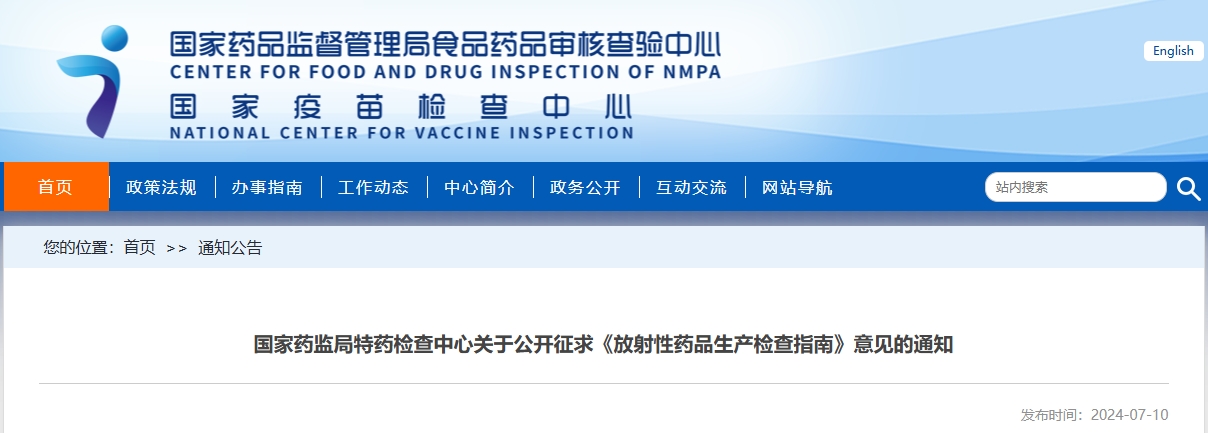
為加強放射性藥品的生產質量管理,指導檢查員開展放射性藥品生產環節現場檢查工作,國家藥監局核查中心、國家藥監局特藥檢查中心組織起草了《放射性藥品生產檢查指南》,現向社會公開征求意見。
請于2024年7月17日前通過電子郵箱反饋,郵件標題請注明“《放射性藥品生產檢查指南》意見反饋”。
聯系人:牛琪,電子郵箱:tsypjczx@163.com。
附件1 意見反饋表.doc
附件2 放射性藥品生產檢查指南(征求意見稿).pdf
國家藥品監督管理局
特殊藥品檢查中心
2024年7月10日

2024年7月11日
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容


微信公眾號

藥方舟手機版

