
2024-07-02 16:59:36來(lái)源:美柏必締瀏覽量:322
據(jù)美不完全的統(tǒng)計(jì),2024年6月中國(guó)醫(yī)藥BD及并購(gòu)交易共計(jì)12筆,其中跨境資產(chǎn)買入2筆,跨境資產(chǎn)賣出6筆,中國(guó)境內(nèi)交易4筆。

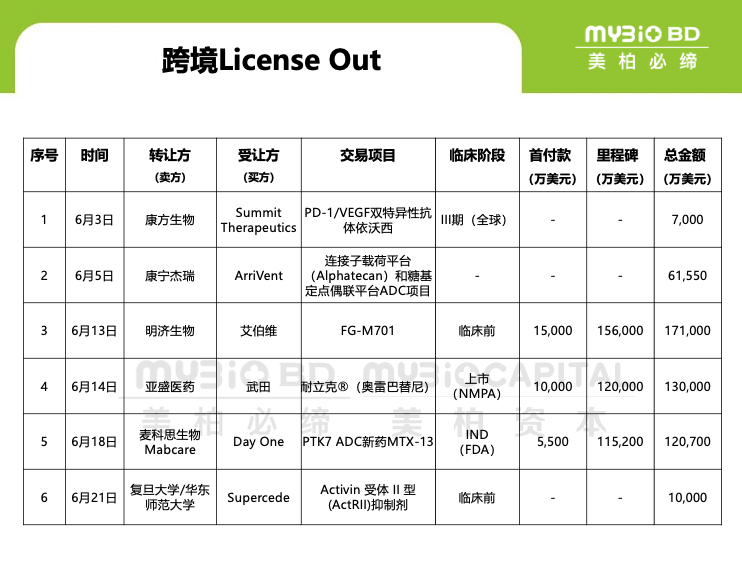
2024年6月5日,康寧杰瑞生物發(fā)布公告,其全資子公司江蘇康寧杰瑞生物制藥與ArriVent BioPharma公司簽訂研發(fā)與商業(yè)化合作協(xié)議,雙方將合作使用康寧杰瑞專有的連接子載荷平臺(tái)(Alphatecan)和糖基定點(diǎn)偶聯(lián)平臺(tái),發(fā)現(xiàn)和開(kāi)發(fā)創(chuàng)新ADC藥物。根據(jù)協(xié)議條款:合作期間,康寧杰瑞將保留相關(guān)ADC產(chǎn)品在大中華區(qū)開(kāi)發(fā)及商業(yè)化權(quán)益。ArriVent將擁有相關(guān)ADC產(chǎn)品腫瘤領(lǐng)域的海外權(quán)益,并將負(fù)責(zé)及承擔(dān)ADC產(chǎn)品的相應(yīng)開(kāi)發(fā)費(fèi)用支出。康寧杰瑞有權(quán)收取一次性、不可退還的預(yù)付款,以及潛在的里程碑付款,包括產(chǎn)品注冊(cè)、開(kāi)發(fā)及銷售里程碑款項(xiàng),總計(jì)高達(dá)6.155億美元。此外,康寧杰瑞還有權(quán)就各ADC產(chǎn)品向ArriVent收取分級(jí)銷售特許權(quán)使用費(fèi)。
2024年6月13日,艾伯維和明濟(jì)生物制藥(北京)有限公司宣布簽署一項(xiàng)許可協(xié)議,共同開(kāi)發(fā)FG-M701。FG-M701是正處于臨床前開(kāi)發(fā)階段的一種用于治療炎癥性腸病(IBD)的下一代TL1A抗體。根據(jù)協(xié)議條款,艾伯維將獲得FG-M701在全球進(jìn)行開(kāi)發(fā)、生產(chǎn)和商業(yè)化的獨(dú)家許可權(quán)。明濟(jì)生物將獲得1.5億美元作為預(yù)付款和近期的里程碑付款,并有資格額外獲得最高可達(dá)15.6億美元的臨床開(kāi)發(fā)、監(jiān)管注冊(cè)和商業(yè)化的里程碑付款,以及最高可達(dá)凈銷售額低兩位數(shù)比例的分級(jí)特許權(quán)使用費(fèi)。
2024年6月14日,亞盛醫(yī)藥(6855.HK)宣布與武田簽署了一項(xiàng)獨(dú)家選擇權(quán)協(xié)議,就公司的具有best-in-class潛力的第三代BCR-ABL酪氨酸激酶抑制劑(TKI)耐立克?(奧雷巴替尼)達(dá)成獨(dú)家許可協(xié)議。一旦選擇權(quán)被行使,武田將獲得開(kāi)發(fā)及商業(yè)化奧雷巴替尼的全球權(quán)利許可,惟中國(guó)大陸、中國(guó)香港特別行政區(qū)、中國(guó)澳門特別行政區(qū)、中國(guó)臺(tái)灣等地區(qū)除外。亞盛醫(yī)藥在協(xié)議簽署后將收到1億美元的選擇權(quán)付款,并有資格獲得最高約12億美元的選擇權(quán)行使費(fèi)和額外的潛在里程碑付款,以及基于年度銷售額提成的雙位數(shù)比例特許權(quán)使用費(fèi);武田制藥將購(gòu)買亞盛醫(yī)藥的少數(shù)股權(quán)。
2024年6月18日,Day One Biopharma宣布,以12億美元引進(jìn)中國(guó)公司Mabcare Therapeutics的靶向PTK7 ADC新藥MTX-13的大中華區(qū)外全球權(quán)益。根據(jù)協(xié)議條款,Day One支付5500萬(wàn)美元預(yù)付款,11.52億美元里程碑金額,以及低至中個(gè)位數(shù)比例的銷售分成,總額高達(dá)12億美元。
2024年6月21日,Supercede Therapeutics在Linkedin宣布,已與復(fù)旦大學(xué)和華東師范大學(xué)就抗腫瘤惡病質(zhì)與增肌領(lǐng)域的創(chuàng)新藥物達(dá)成一項(xiàng)全球權(quán)益合作。基于本次合作,Supercede Therapeutics將獲得復(fù)旦大學(xué)和華東師范大學(xué)共同研發(fā)的處于臨床前的小分子抗腫瘤惡病質(zhì)肌萎縮、肌少癥和增肌創(chuàng)新藥物全球開(kāi)發(fā)和商業(yè)化權(quán)益。復(fù)旦大學(xué)和華東師范大學(xué)將有資格獲得最高可達(dá)近1億美元的首付款和開(kāi)發(fā)、監(jiān)管和商業(yè)化里程碑付款,以及未來(lái)基于全球年度銷售凈額的梯度特許權(quán)使用費(fèi)。
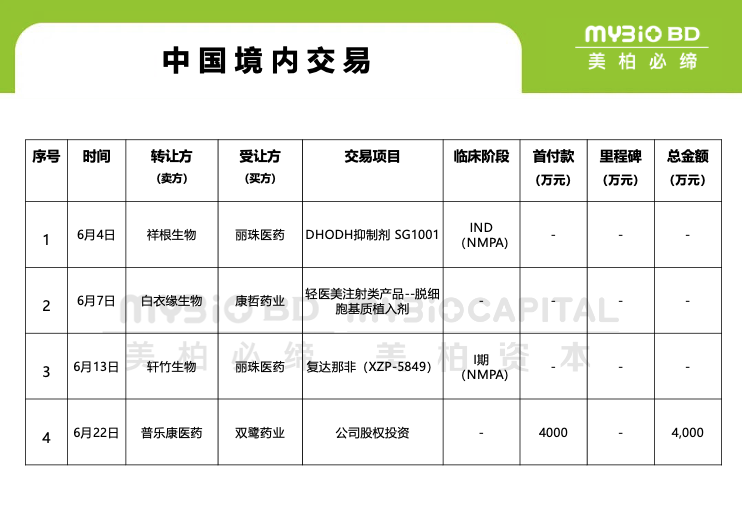
2024年6月4日,深圳市祥根生物與麗珠醫(yī)藥聯(lián)合宣布,雙方就SG1001達(dá)成戰(zhàn)略合作并簽署大中華區(qū)權(quán)益交易協(xié)議。SG1001,口服片劑,是祥根生物首款抗真菌創(chuàng)新藥,全球第二款DHODH(二氫乳清酸脫氧酶)抑制劑,適應(yīng)癥為侵襲性真菌病,具有自主知識(shí)產(chǎn)權(quán)和全新結(jié)構(gòu),為化學(xué)藥品1類創(chuàng)新藥。目前,該產(chǎn)品已獲得國(guó)內(nèi)臨床試驗(yàn)許可,擬用于侵襲性真菌病的治療。
2024年 6月7日,康哲藥業(yè)通過(guò)附屬皮膚醫(yī)美業(yè)務(wù)公司"康哲美麗"與上海白衣緣生物就一款輕醫(yī)美注射類產(chǎn)品--脫細(xì)胞基質(zhì)植入劑("產(chǎn)品")訂立獨(dú)占許可協(xié)議("許可協(xié)議")。根據(jù)許可協(xié)議,康哲美麗獲得該產(chǎn)品在中國(guó)大陸、香港特別行政區(qū)、澳門特別行政區(qū)及臺(tái)灣地區(qū)獨(dú)占的推廣、銷售及商業(yè)化產(chǎn)品的權(quán)利。許可期限為2024年6月7日開(kāi)始至產(chǎn)品取得中國(guó)大陸第三類醫(yī)療器械注冊(cè)證且康哲美麗收到白衣緣生物交付的第一批商業(yè)化可銷售的產(chǎn)品之日起十年;上述期限屆滿后,若符合許可協(xié)議約定,則許可期限自動(dòng)延續(xù)十年。
2024年6月13日,四環(huán)醫(yī)藥發(fā)布一則公告,宣布旗下非全資附屬公司軒竹生物與麗珠醫(yī)藥就軒竹生物自主研發(fā)的高選擇性磷酸二酯酶5(PDE5)抑制劑復(fù)達(dá)那非(XZP-5849)達(dá)成獨(dú)家授權(quán)許可合作。復(fù)達(dá)那非是軒竹生物自主研發(fā)的一款高選擇性PDE5抑制劑,屬于化藥1類新藥,軒竹生物對(duì)其具有獨(dú)立自主的知識(shí)產(chǎn)權(quán)及全球權(quán)利。產(chǎn)品具有抑制前列腺增生、顯著改善前列腺增生癥引起的下尿路癥狀,同時(shí)對(duì)勃起功能障礙、肺動(dòng)脈高壓有良好的改善作用,同時(shí)能克服勃起功能障礙患者同類藥物如西地那非、伐地那非和他達(dá)拉非等出現(xiàn)的視覺(jué)障礙、背痛等不良反應(yīng)。目前該產(chǎn)品處于I期臨床研究階段。
2024年6月22日,普樂(lè)康醫(yī)藥獲得雙鷺?biāo)帢I(yè)4000萬(wàn)元人民幣的股權(quán)投資,所募集資金將用于普樂(lè)康醫(yī)藥眼科臨床藥物管線的研發(fā)。普樂(lè)康醫(yī)藥成立于2019年,致力于開(kāi)發(fā)存在未滿足臨床需求的、具有創(chuàng)新作用機(jī)制的眼科和自身免疫性疾病藥物,同時(shí)關(guān)注罕見(jiàn)病領(lǐng)域的藥物研發(fā)。據(jù)悉,普樂(lè)康醫(yī)藥在成立較短的時(shí)間內(nèi)已將數(shù)個(gè)在研管線項(xiàng)目從藥物發(fā)現(xiàn)和篩選推進(jìn)至CMC階段及臨床前和臨床試驗(yàn)研究階段,目前其已經(jīng)有兩款產(chǎn)品處于臨床研究階段。
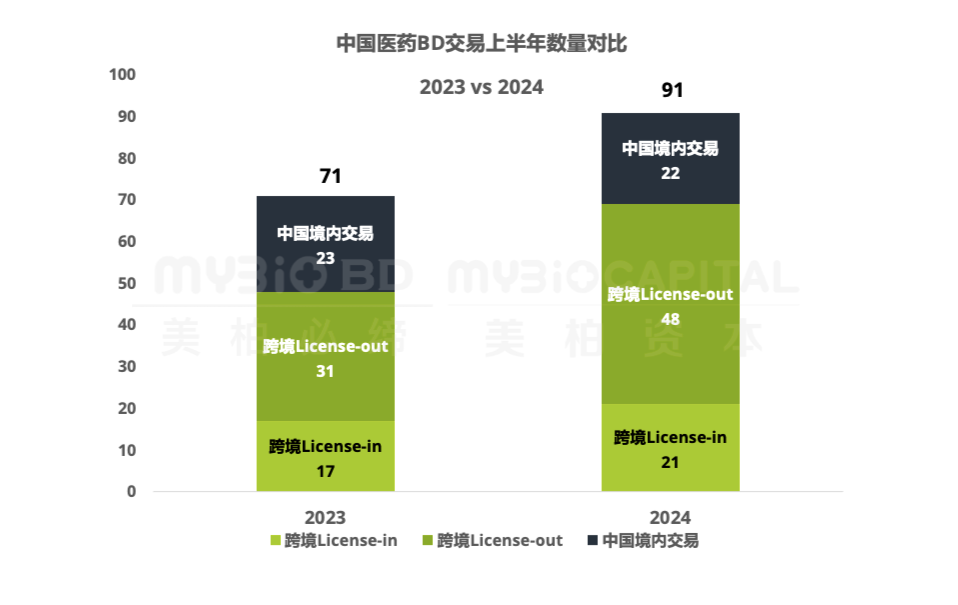
2024年截止6月底,中國(guó)醫(yī)藥領(lǐng)域上半年共完成91筆交易(跨境引進(jìn)21筆,跨境出海48筆,中國(guó)境內(nèi)交易22筆)。同比2023年上半年增長(zhǎng)28%。國(guó)內(nèi)制藥行業(yè)在一二級(jí)市場(chǎng)及醫(yī)藥政策持續(xù)收緊背景下,加速外部合作。
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺(tái)觀點(diǎn)。如涉及作品內(nèi)容、版權(quán)和其它問(wèn)題,請(qǐng)與本網(wǎng)站留言聯(lián)系,我們將在第一時(shí)間刪除內(nèi)容