
2020-11-05 11:49:59來源: Armstrong的醫藥筆記瀏覽量:480
2020年11月6日星期五,FDA專家委員會將開會審評Aducanumab的上市申請。11月4日,FDA官網發布了相關材料。

在披露的材料中,FDA認為302臨床的數據提供了“高度令人信服的”有效性證據。

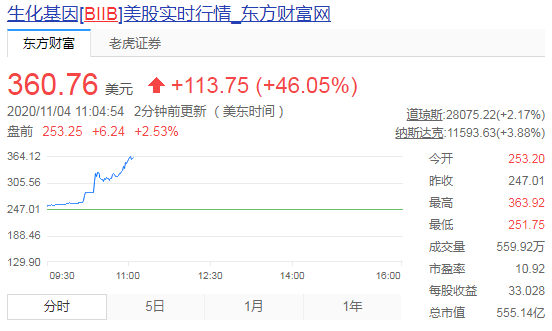
市場反應來看,看到這樣的材料明顯對Aducanumab獲批抱有樂觀期待。Biogen股價大漲46%,市值上漲超170億美元。
當然,FDA也認為另一項三期臨床301的結果為陰性,但確實顯著減少了大腦內的淀粉樣蛋白。

總結
Aducanumab兩項三期臨床一項獲得成功,另一項則未表現出統計學差異。不過Aducanumab作為Aβ寡聚體抗體的作用機理清晰,臨床中也能劑量依賴性的減少淀粉樣蛋白的沉積。從今天披露的上會討論材料看,業界對FDA的批準持樂觀態度。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!