
2024-06-24 17:07:42來(lái)源:鼎泰瀏覽量:334
與前 3 款 siRNA 藥物相比,Inclisiran 的特別之處在于它是第一款和目前唯一一款獲得 FDA 批準(zhǔn)用于慢性疾病治療的 siRNA 藥物,適應(yīng)癥為:
作為飲食的輔助療法,用于治療雜合子家族性高膽固醇血癥(HeFH)或臨床動(dòng)脈粥樣硬化性心血管疾病(ASCVD)的成人患者,這些患者接受了最大耐受劑量的他汀類藥物治療,但需要額外降低低密度脂蛋白膽固醇(LDL-C)。
LEQVIO? is indicated as an adjunct to diet and maximally tolerated statin therapy for the treatment of adults with heterozygous familial hypercholesterolemia (HeFH) or clinical atherosclerotic cardiovascular disease (ASCVD), who require additional lowering of low-density lipoprotein cholesterol (LDL-C).
Inclisiran 從遞交 IND 申請(qǐng)到首個(gè)適應(yīng)癥獲批上市歷時(shí)約 6 年,隨后陸續(xù)獲 EMA、NMPA 及 PMDA 批準(zhǔn)上市。 Inclisiran 的獲批上市掀開了 siRNA 藥物用于慢病治療的新篇章,將引領(lǐng)更多 siRNA 候選分子用于代謝性疾病、感染性疾病和心血管疾病等領(lǐng)域。
目前,國(guó)內(nèi)已有 6 款以 PCSK9 為靶點(diǎn)的 siRNA 藥物進(jìn)入臨床試驗(yàn),后續(xù)也還將陸續(xù)有更多優(yōu)秀的同類分子進(jìn)入臨床。截至目前,鼎泰團(tuán)隊(duì)已完成了 60 多 個(gè) siRNA 藥物的相關(guān)研究,其中以 PCSK9 為代表的擬用于代謝或心血管疾病的 siRNA 近 10 個(gè),積累了豐富的評(píng)價(jià)經(jīng)驗(yàn),包括非人靈長(zhǎng)類或轉(zhuǎn)基因小鼠藥效學(xué)、藥代動(dòng)力學(xué)和毒理學(xué)研究。
Inclisiran 是全球首款獲批用于慢性疾病治療的 siRNA 藥物,也是我國(guó)截至目前批準(zhǔn)的唯一一款 siRNA 藥物,同時(shí)也是唯一一款同時(shí)包括單藥和聯(lián)合用藥方案的 siRNA 藥物,其臨床開發(fā)路徑、藥政策略和相關(guān)的支持性非臨床研究具有重要的參考價(jià)值。基于既往的項(xiàng)目經(jīng)驗(yàn)和對(duì)未來(lái)產(chǎn)品開發(fā)預(yù)期的規(guī)劃,鼎泰團(tuán)隊(duì)對(duì) Inclisiran 上市歷程及臨床開發(fā)路徑進(jìn)行了復(fù)盤,學(xué)習(xí)他山之石、尋找突破創(chuàng)新思路,期待為助力該類藥物更高效地實(shí)現(xiàn)臨床轉(zhuǎn)化和推動(dòng)產(chǎn)品上市提供借鑒和啟示。
FDA 和 NMPA 批準(zhǔn)的產(chǎn)品外包裝
★ 文章導(dǎo)覽 ★
1 | 產(chǎn)品的研發(fā)背景 關(guān)鍵詞:他汀類藥物、PCSK9、聯(lián)合用藥 |
2 | Inclisiran 產(chǎn)品信息 |
3 | Inclisiran 臨床開發(fā)路徑 關(guān)鍵詞:起始劑量、3 項(xiàng)關(guān)鍵Ⅲ期 |
4 | 監(jiān)管互動(dòng)里程碑 關(guān)鍵詞:EOP2、ADA 檢測(cè)、Pre-NDA |
5 | 免疫原性檢測(cè)與藥代動(dòng)力學(xué) |
6 | 非臨床與臨床試驗(yàn)相關(guān)性分析 |
7 | 小結(jié) |
01
產(chǎn)品的研發(fā)背景
1、疾病背景
心血管疾病(Cardiovascular Disease,CVD)一直是全球一大死亡原因,ASCVD 是最常見的一種 CVD,而高膽固醇血癥是 ASCVD 的誘因之一。特別是以 LDL-C 或總膽固醇(Total Cholesterol,TC)升高為特點(diǎn)的血脂異常是 ASCVD 重要的風(fēng)險(xiǎn)因素。因此,控制 LDL-C 對(duì)心臟病和非心臟病患者至關(guān)重要[1]。
2、目前治療手段
ASCVD 的管理包括生活方式的改變,如有氧運(yùn)動(dòng)和調(diào)節(jié)飲食。除了健康的生活方式干預(yù)外,還可以使用降脂藥物進(jìn)行藥物治療。
目前,降脂藥物主要有他汀類藥物、膽固醇吸收抑制劑、貝特類藥物、抗氧化類藥物(普羅布考)、煙酸類藥物、PCSK9 抑制劑(PCSK9:靶向降解編碼前蛋白轉(zhuǎn)化酶枯草溶菌素 9 )等。
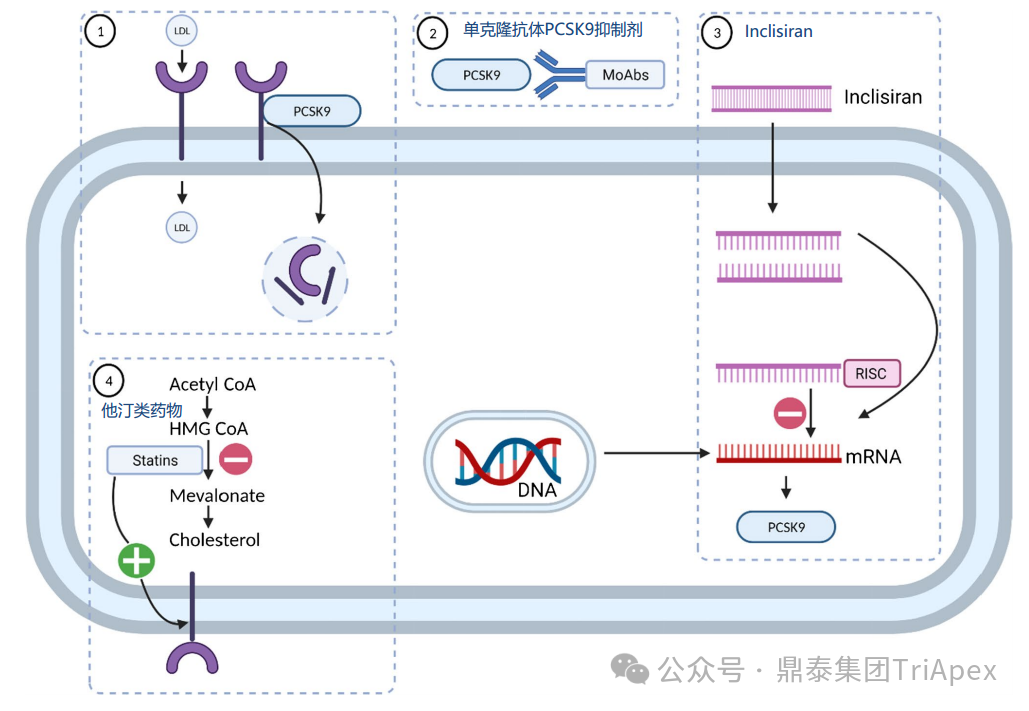
降脂藥物對(duì)肝細(xì)胞的作用機(jī)制[2]
① 他汀類藥物
② PCSK9 抑制劑
LDL-C 是臨床血脂檢測(cè)的四項(xiàng)重要指標(biāo)之一,其水平越高,患 ASCVD 的風(fēng)險(xiǎn)就越高。PCSK9 是肝臟合成的分泌型絲氨酸蛋白酶。在細(xì)胞外,PCSK9 與肝細(xì)胞表面的 LDL-R 結(jié)合并使其降解,從而阻止 LDL-R 的再循環(huán),導(dǎo)致細(xì)胞表面 LDL-R 濃度降低,血漿 LDL particle 濃度增加。
PCSK9 抑制劑可阻斷 PCSK9 與膜結(jié)合LDL-R(membrane-bound LDL receptor)的相互作用,或直接阻斷 PCSK9蛋白的合成(siRNA 類),使參與體循環(huán)的 LDL-R 增加,細(xì)胞表面受體濃度增加,提高 LDL-R 對(duì) LDL-C 的重?cái)z取,降低循環(huán) LDL-C 水平,最終達(dá)到降低血脂的目的(見下圖)[4]。研究表明,在降低血清膽固醇水平方面 PCSK9 抑制劑比他汀類藥物更有效[6]。
Ezetimibe 和/或 PCSK9 抑制劑被認(rèn)為是在接受最大耐受劑量他汀類藥物治療的 CVD 高風(fēng)險(xiǎn)(二級(jí)預(yù)防和 HeFH)、需要額外降低 LDL-C 的患者的二線加載治療(addon therapy)[3]。
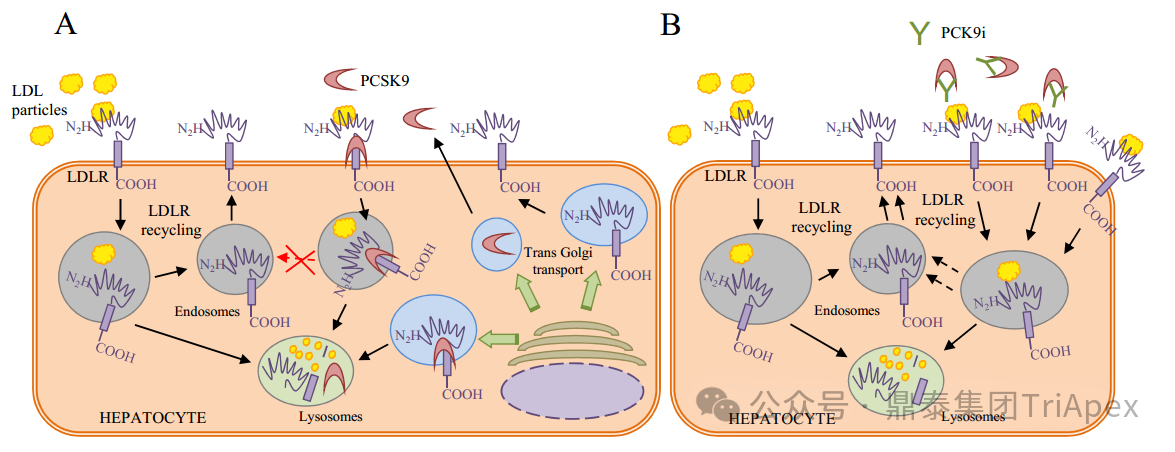
PCSK9 介導(dǎo) LDL-C 降解的作用機(jī)制[4]
3、PCSK9 與他汀類藥物聯(lián)合使用
盡管他汀類藥物是最常用的降血脂藥物,但其在治療過(guò)程中存在一定的局限性,如 CVD 事件的風(fēng)險(xiǎn)仍存在、LDL-C 水平未達(dá)臨床治療目的、部分患者對(duì)他汀類藥物不耐受和他汀類藥物依從性差等[5]。
研究表明,與單獨(dú)使用他汀類藥物相比,他汀類藥物 + PCSK9 抑制劑的輔助治療可以使 LDL-C 水平降低 50-60%。此外,PCSK 抑制劑聯(lián)合高劑量他汀類藥物可降低臨床 ASCVD 患者的 CVD 事件和全因死亡率(all-cause mortality)[4]。
02
Inclisiran 產(chǎn)品信息
Inclisiran 是一款 GalNAc 偶聯(lián)的 siRNA 藥物(GalNAc-siRNA),靶向肝臟分布。Inclisiran 與單抗類 PCSK9 抑制劑的最大不同點(diǎn):Inclisiran 可直接作用于編碼 PCSK9 蛋白的 mRNA,利用 RNA 干擾機(jī)制,誘導(dǎo) PCSK9 mRNA 降解,增加肝細(xì)胞表面 LDL-R 的表達(dá)和循環(huán),繼而增加對(duì) LDL-C 的攝取,并降低循環(huán)中的 LDL-C 水平(見下圖)。

PCSK9 蛋白的生物學(xué)功能和 Inclisiran 的作用機(jī)制示意圖[7]
Inclisiran 最初由 Alnylam Pharmaceuticals 研發(fā),于2019 年 11 月由諾華(Novartis)收購(gòu) The Medicines Company(該公司從 Alnylam Pharmaceuticals 購(gòu)買了 Inclisiran 分子的授權(quán))后進(jìn)行后續(xù)開發(fā)。
2020 年 12 月 09 日,Inclisiran 首先在歐盟獲批上市,作為飲食的輔助療法,用于成人原發(fā)性高膽固醇血癥(雜合子型家族性和非家族性)或混合型血脂異常患者的治療[8]。
2021 年 12 月 22 日,Inclisiran 獲得 FDA 批準(zhǔn),適應(yīng)癥為:作為飲食的輔助療法,用于治療雜合子家族性高膽固醇血癥(HeFH)或臨床動(dòng)脈粥樣硬化性心血管疾病(ASCVD)的成人患者,這些患者接受了最大耐受劑量的他汀類藥物治療,但需要額外降低低密度脂蛋白膽固醇(LDL-C)。
2023 年 08 月 22 日,Inclisiran 在 NMPA 獲批上市,獲批的適應(yīng)癥與 EMA 獲批的相同。
2023 年 09 月 25 日,Inclisiran 在 PMDA 獲批上市,作為飲食的輔助療法,用于成人原發(fā)性高膽固醇血癥的治療。
03
Inclisiran 臨床開發(fā)路徑
Inclisiran 從 IND 申請(qǐng)到獲批上市歷時(shí)約 6 年時(shí)間,支持 Inclisiran 首次 NDA 批準(zhǔn)的主要臨床試驗(yàn)包含 1 項(xiàng) Ⅰ 期試驗(yàn)、2 項(xiàng) Ⅱ 期試驗(yàn)和 3 項(xiàng) Ⅲ 期臨床試驗(yàn)。

臨床開發(fā)路徑小結(jié)
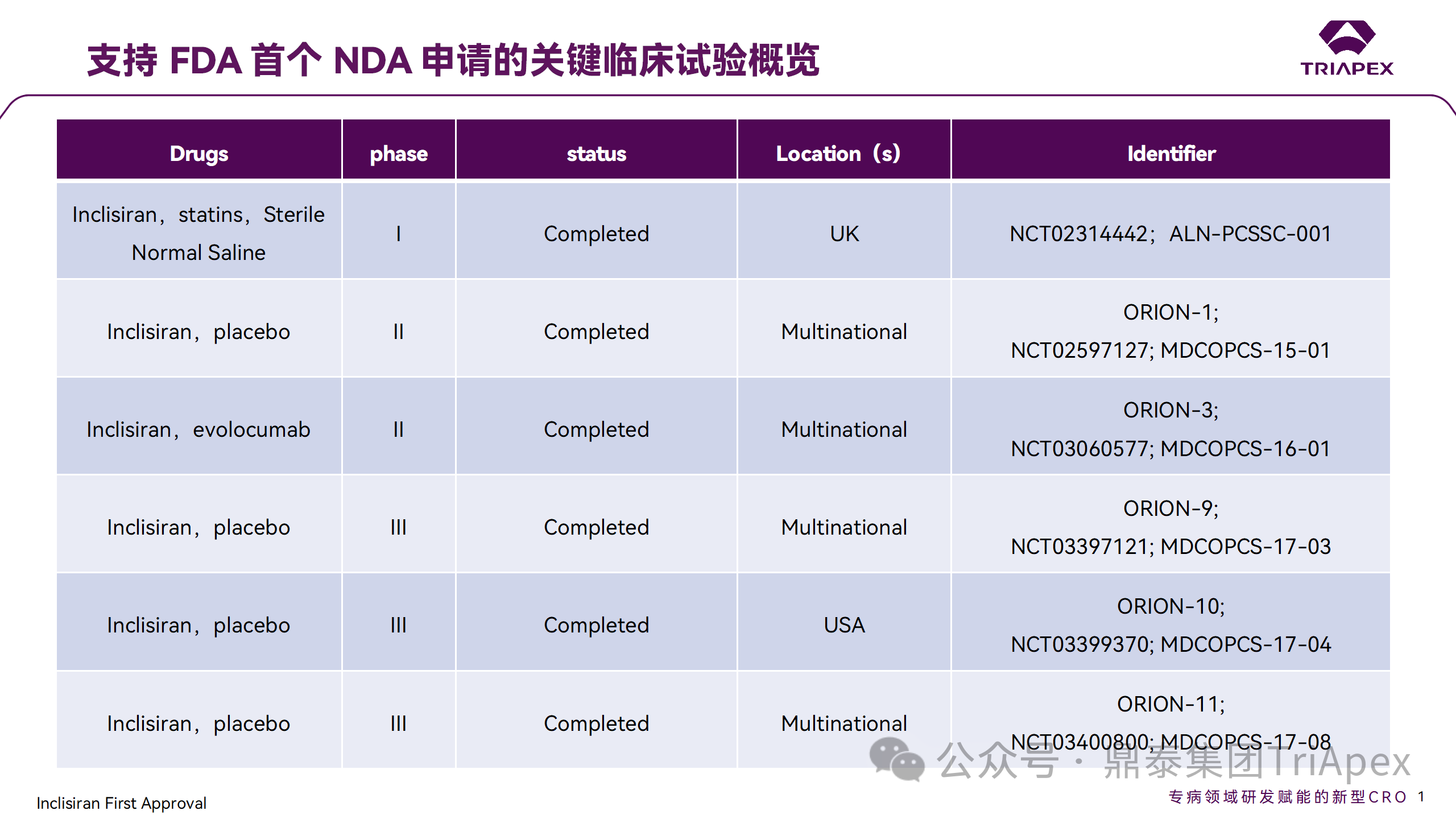
支持首個(gè) NDA 申請(qǐng)的臨床試驗(yàn)
1、Ⅰ 期臨床
Ⅰ 期臨床起始劑量設(shè)計(jì)依據(jù)
在大鼠和猴重復(fù)給藥 28 天毒性試驗(yàn)中,確定了 NOAEL 劑量分別為 250 mg/kg 和 300mg/kg,該結(jié)果支持 Ⅰ 期臨床試驗(yàn) FIH 起始劑量為 25mg(具體計(jì)算過(guò)程未透露)。

Ⅰ 期臨床起始劑量設(shè)計(jì)依據(jù)
① NCT02314442-ALN-PCSSC-001,UK
2014 年,Inclisiran 的首次人體試驗(yàn)(FIH)啟動(dòng)。這是 1 項(xiàng)在英國(guó)開展的隨機(jī)、單盲、安慰劑對(duì)照、劑量遞增試驗(yàn),旨在評(píng)估 Inclisiran 在 LDL-C 升高受試者中的安全性、耐受性、藥代動(dòng)力學(xué)和藥效學(xué)。

Ⅰ 期臨床試驗(yàn)設(shè)計(jì)
? 125mg QW*4 單藥
? 250mg Q2W*2 單藥
? 300mg QM*2 單藥
? 300mg QM*2 與他汀類藥物聯(lián)合用藥
? 500mg QM*2 單藥
? 500mg QM*2 與他汀類藥物聯(lián)合用藥
主要終點(diǎn)為 AE、SAE 和導(dǎo)致研究藥物停藥的 AE 的受試者比例;次要終點(diǎn)為藥代動(dòng)力學(xué)參數(shù)(Cmax、Tmax、AUC、t1/2)及 Inclisiran 對(duì)血清 LDL-C 水平、血漿 PCSK9 水平的影響。
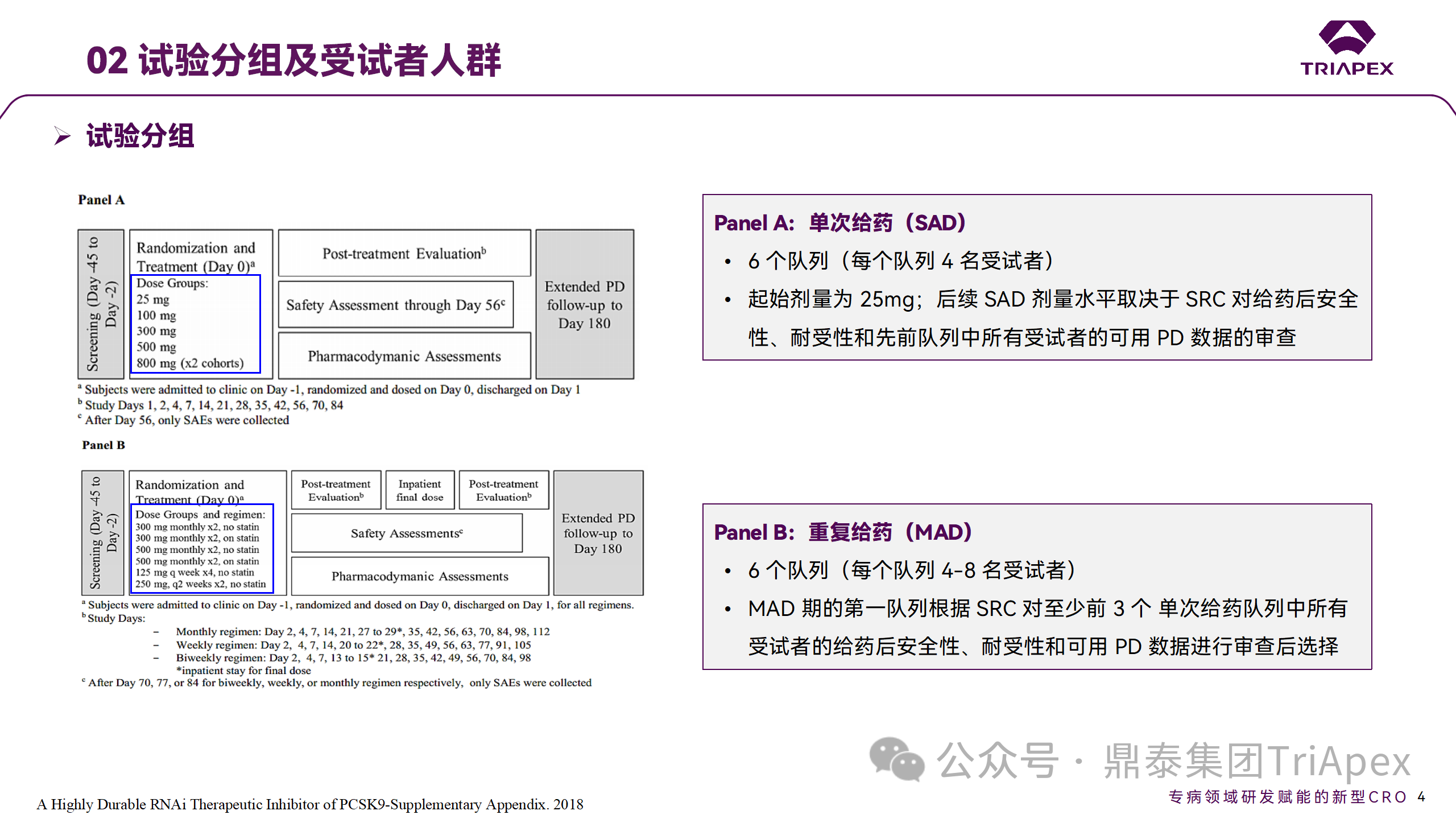
Ⅰ 期臨床試驗(yàn)分組和給藥方案
所有 AE 的嚴(yán)重程度均為輕度或中度;在 1 個(gè)月內(nèi)給予 Inclisiran,觀察到 PCSK9 和 LDL-C 水平持續(xù)下降;服用穩(wěn)定劑量他汀類藥物的患者在給予 Inclisiran 后可進(jìn)一步降低 LDL-C 水平。此外,本研究支持 PCSK9 作為顯著降低 LDL-C 的治療靶點(diǎn)。
探索性研究結(jié)果顯示,無(wú)論 SAD 還是 MAD,接受 Inclisiran 治療的受試者的 TC、非高密度脂蛋白膽固醇(Non-HDL-C)和載脂蛋白 B(Apo-B)水平均有所下降;與安慰劑組相比,從基線到接受首次治療后第 84 天時(shí),上述指標(biāo)均顯著降低。
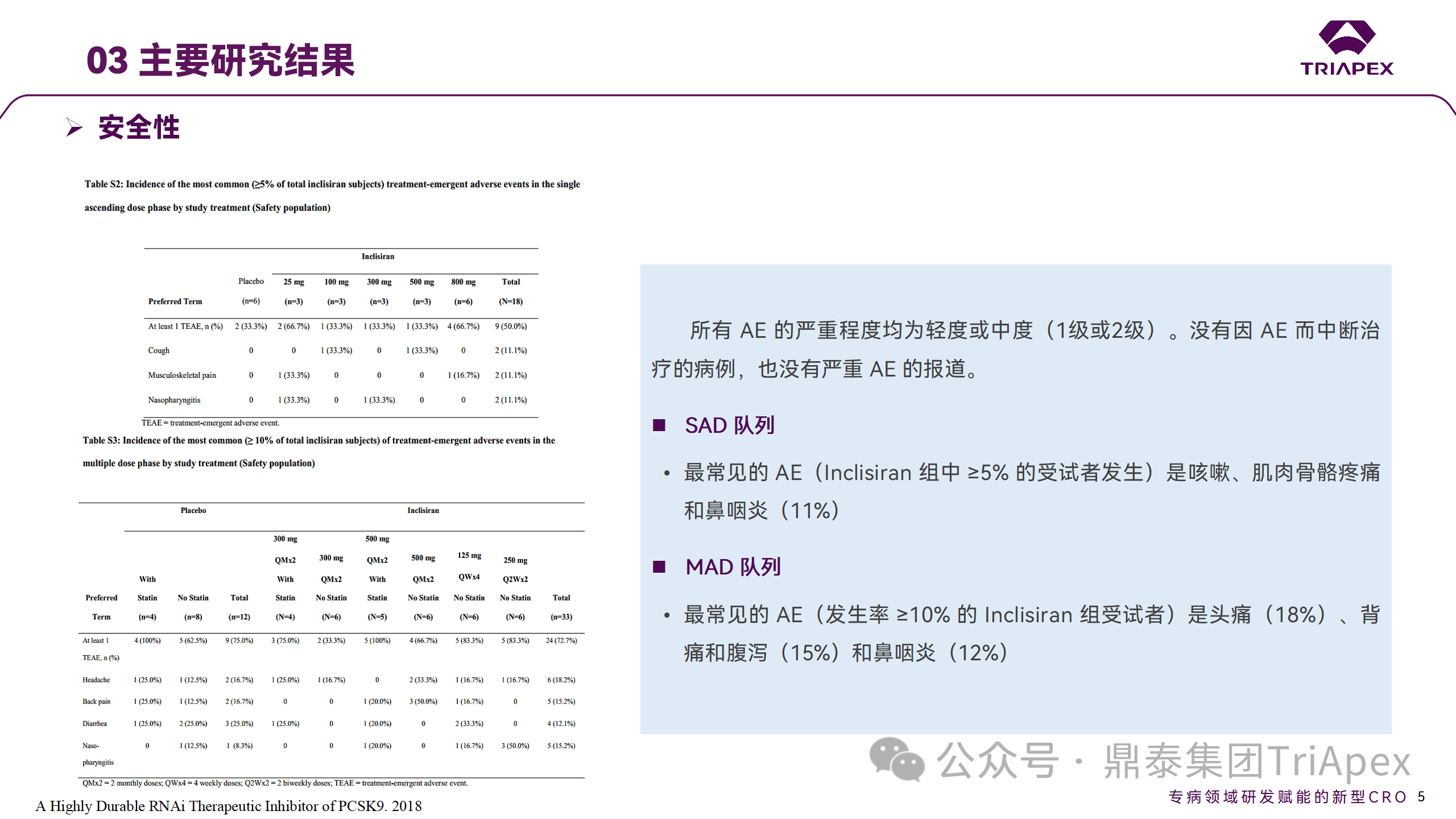
Ⅰ 期臨床試驗(yàn)安全性相關(guān)結(jié)果

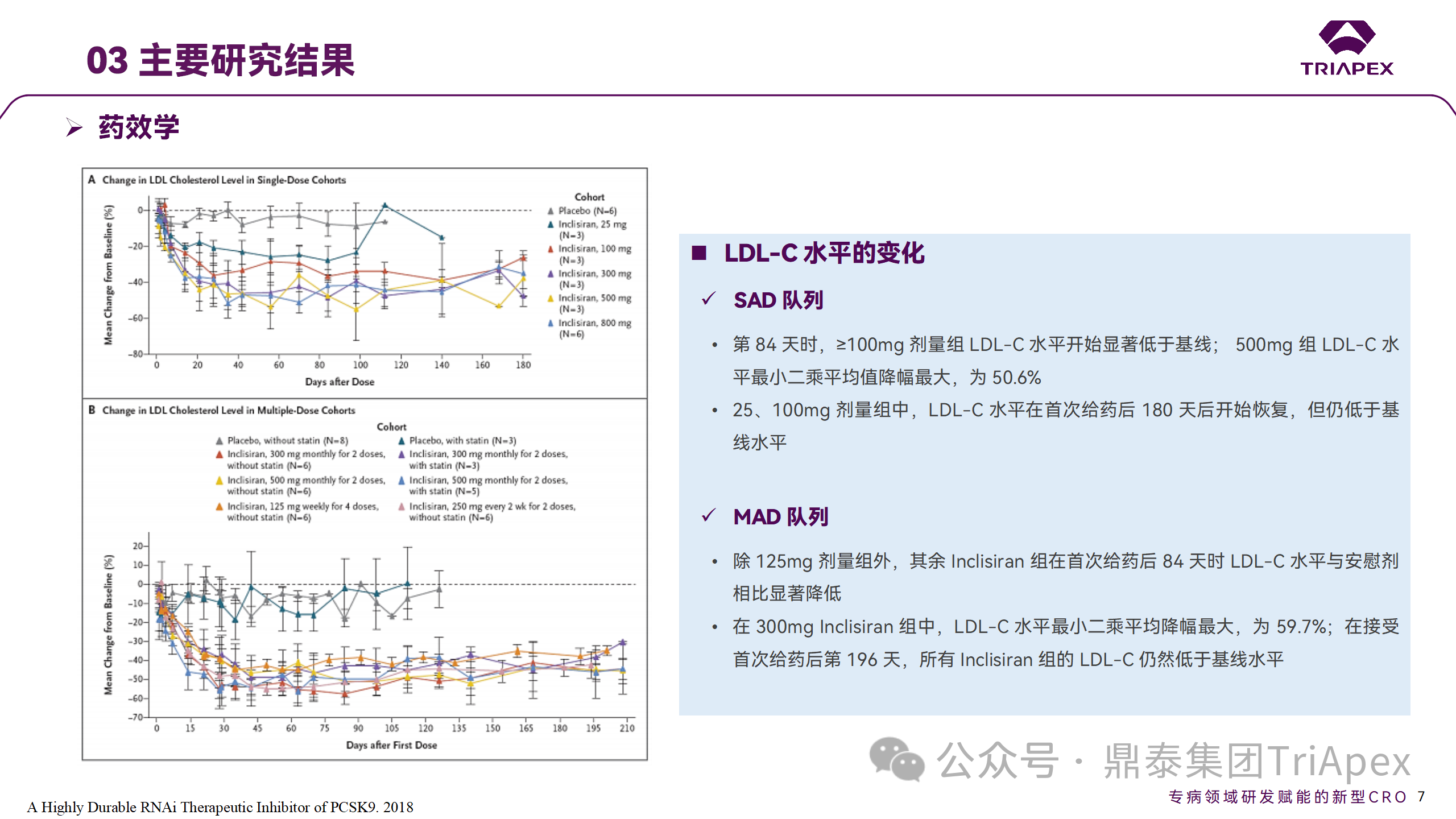
Ⅰ 期臨床試驗(yàn)藥效學(xué)相關(guān)結(jié)果
② NCT03159416-ORION-7,New Zealand
腎清除是 Inclisiran 體內(nèi)消除的主要途徑,在給藥后 24h 內(nèi)尿液中檢測(cè)到約 1/3 的總給藥劑量。ASCVD 患者常伴有腎功能不全,因此,有必要對(duì)Inclisiran 在不同程度腎功能損害個(gè)體中的安全性、PK 和 PD 效應(yīng)進(jìn)行表征。
NCT03159416-ORION-7 是一項(xiàng)在新西蘭開展的單次給藥、開放標(biāo)簽、平行組研究,以評(píng)估腎功能損害與腎功能正常受試者的藥代動(dòng)力學(xué)。該試驗(yàn)根據(jù)腎功能損害的程度分為四組,分別為腎功能正常組、輕度腎功能損害、中度腎功能損害和重度腎功能損害。受試者在第一天接受 300mg Inclisiran 單次皮下給藥。
該研究的主要終點(diǎn)為藥代動(dòng)力學(xué)參數(shù),包括 Cmax 、Tmax 、t1/2、AUC0-24、AUC0-48、AUC0-inf、SC 給藥后的 CL/F 和 Vd/F、排泄分?jǐn)?shù)、腎清除率(CLr)等;次要終點(diǎn)為 PCSK9、血脂、脂蛋白與基線相比的變化。

Ⅰ 期臨床試驗(yàn)設(shè)計(jì)
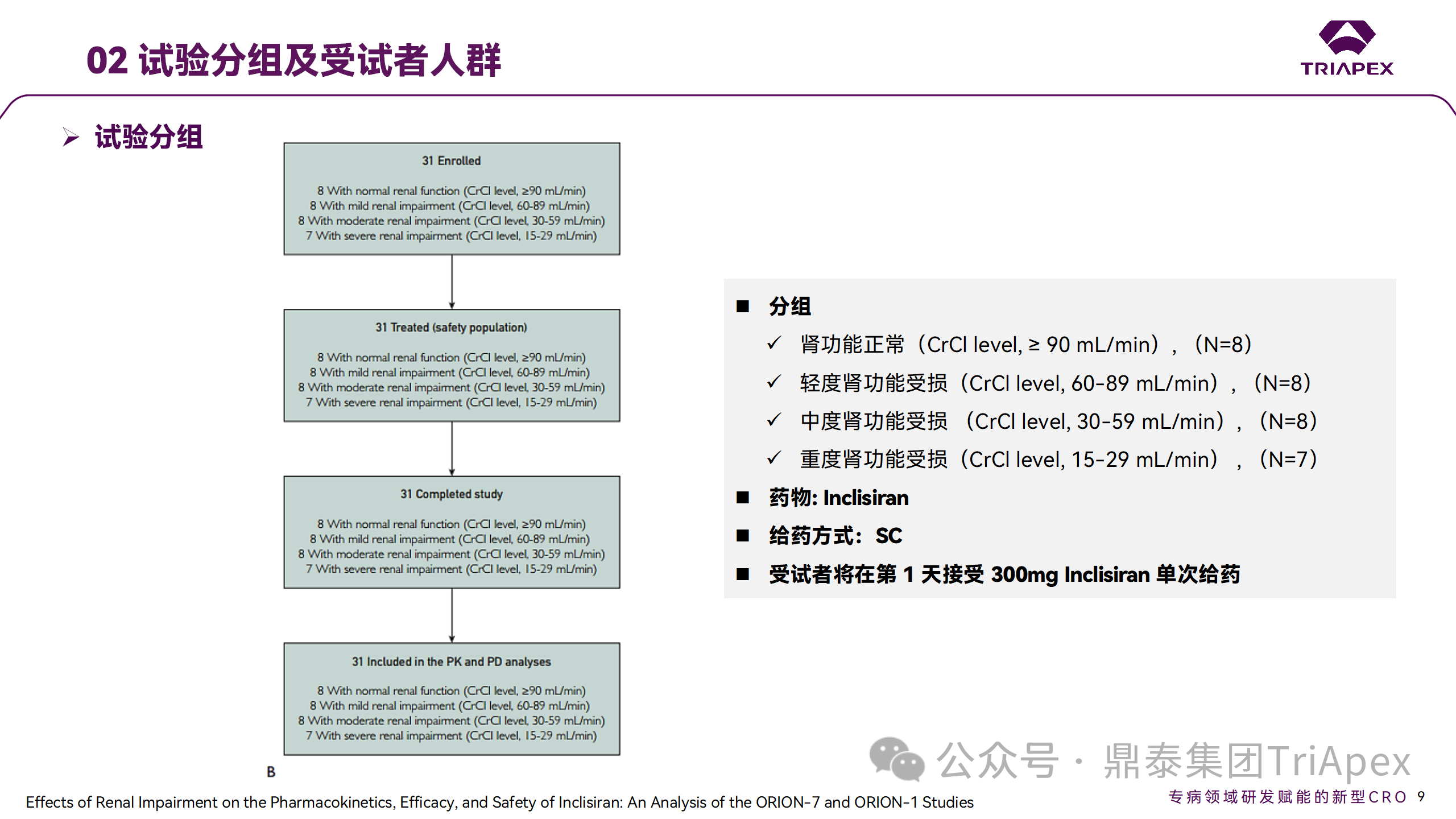
Ⅰ 期臨床試驗(yàn)分組
研究結(jié)果顯示,在腎功能正常和損害受試者中,Inclisiran 的藥效學(xué)作用和安全性相似。腎損害患者不需要調(diào)整 Inclisiran 劑量。雖然接受 Inclisiran 治療的腎功能損害患者的血漿暴露量更大,但對(duì) LDL-C 水平、PCSK9 水平的降低程度和持續(xù)時(shí)間未見影響。該項(xiàng)研究提示了 Inclisiran 可以安全地用于輕度、中度或重度腎功能損害患者,且無(wú)需調(diào)整劑量或給藥方案。
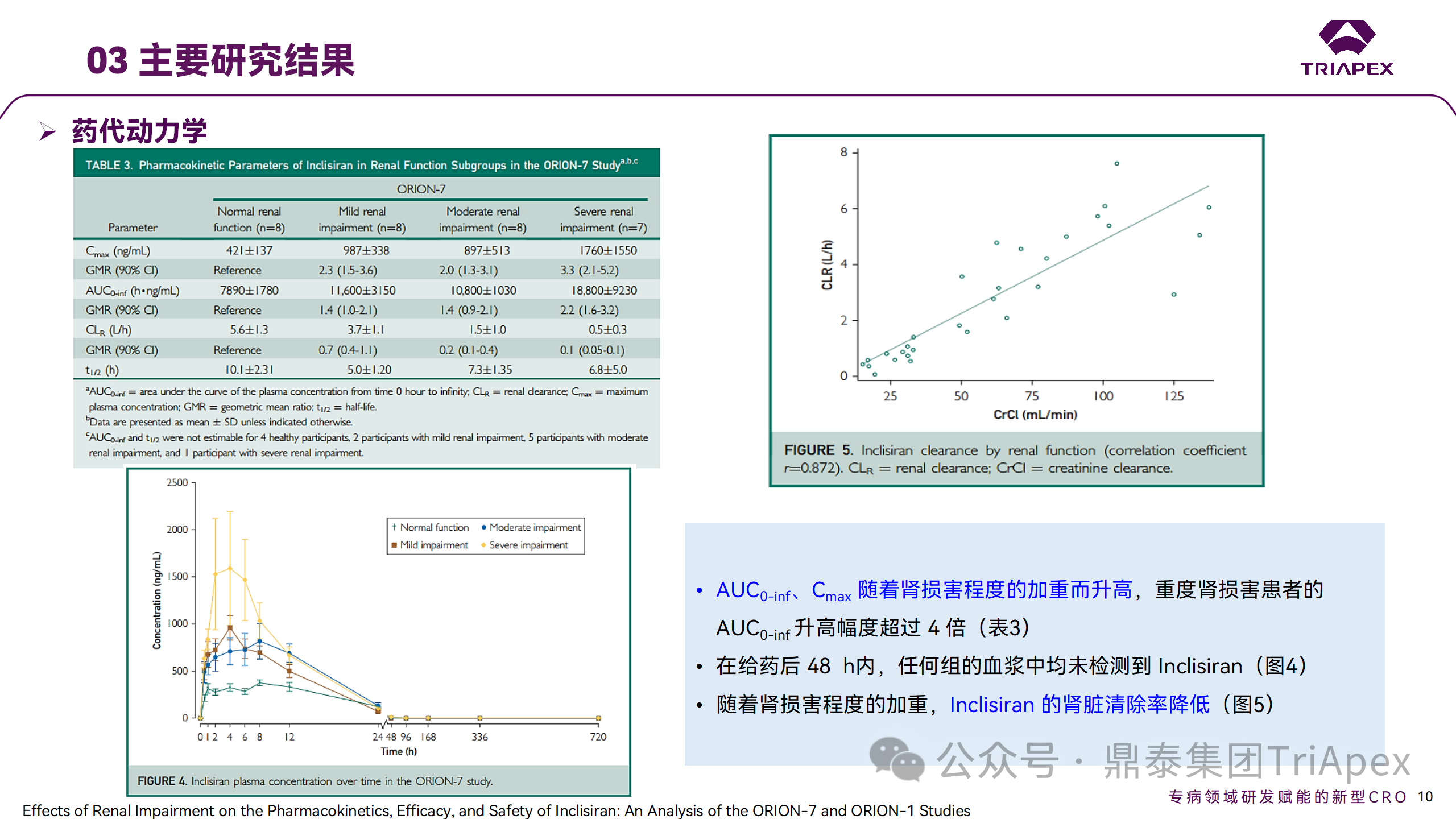
Ⅰ 期臨床試驗(yàn)藥代動(dòng)力學(xué)結(jié)果
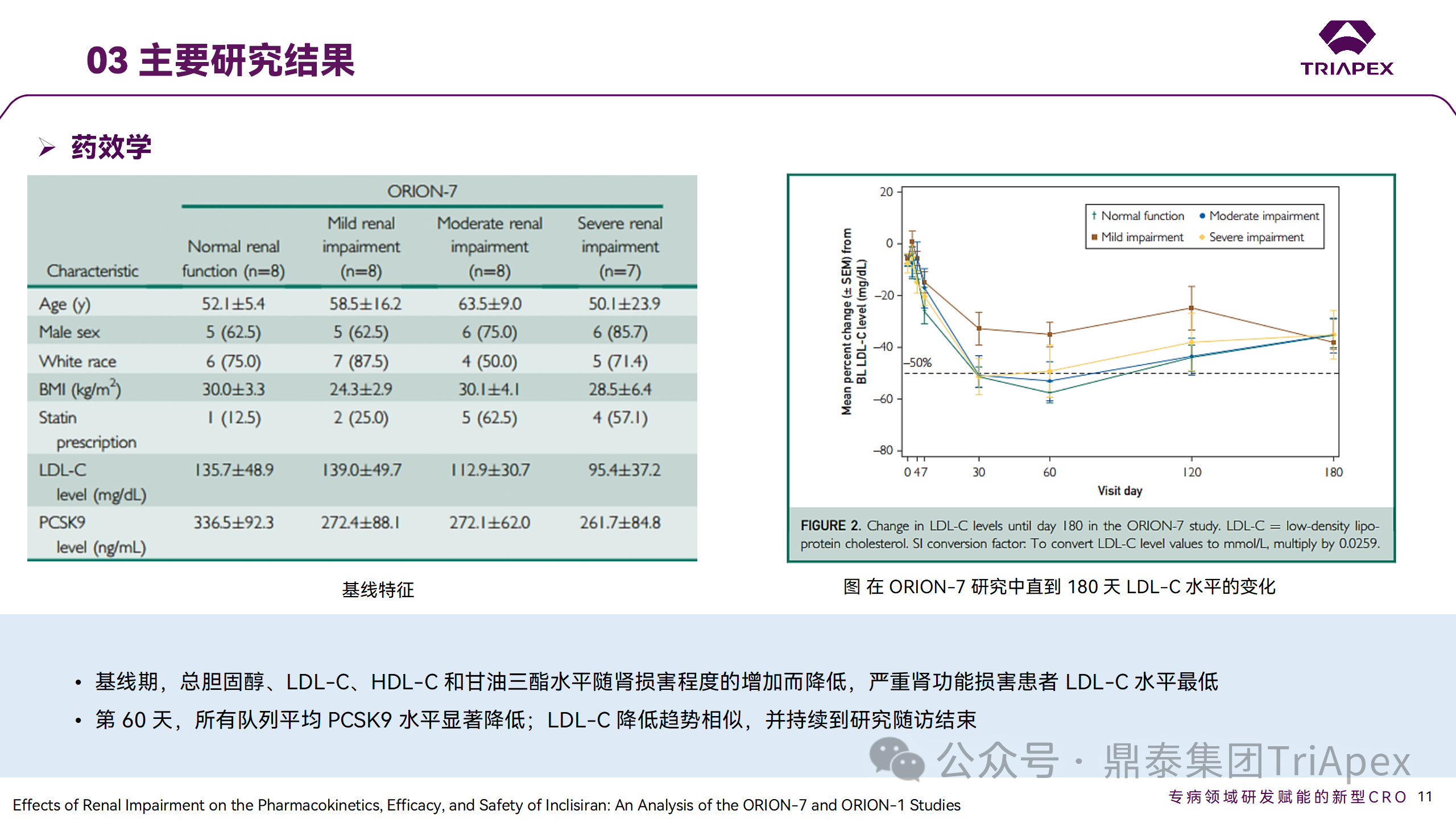
Ⅰ 期臨床試驗(yàn)藥效學(xué)結(jié)果
除此之外,還開展了一項(xiàng) Ⅰ 期臨床試驗(yàn)—ORION-6,這是一項(xiàng)單劑量、開放標(biāo)簽、平行組研究,以評(píng)估肝功能損害受試者與肝功能正常受試者的藥代動(dòng)力學(xué)、藥效學(xué)和安全性。研究結(jié)果表明,Inclisiran 可以安全地用于輕度、中度肝功能損害患者,而無(wú)需調(diào)整劑量或給藥方案。
2、Ⅱ 期臨床
Ⅱ 期臨床劑量設(shè)計(jì)依據(jù)
Ⅱ 期臨床劑量是根據(jù) Ⅰ 期研究 ALN-PCSSC-001 的中期結(jié)果設(shè)計(jì),并將為 Ⅲ 期臨床劑量設(shè)計(jì)提供選擇。

Ⅱ 期臨床試驗(yàn)劑量設(shè)計(jì)依據(jù)
① NCT02597127-ORION-1,Multinational
ORION-1 是一項(xiàng) Ⅱ 期、隨機(jī)、雙盲、安慰劑對(duì)照試驗(yàn),共納入 480 名 ASCVD 或 ASCVD 風(fēng)險(xiǎn)相關(guān)患者(ASCVD-risk equivalents,eg, diabetes and familial hypercholesterolemia),這些患者盡管接受了最大耐受劑量的降 LDL-C 治療,但 LDL-C 水平仍升高。通過(guò)單次或多次皮下注射不同劑量的 Inclisiran,評(píng)估 ALN-PCSSC 在患者中的有效性、安全性和耐受性。
將患者隨機(jī)分配至單次給藥組或重復(fù)給藥組:
200mg、300mg 或 500mg Inclisiran 或安慰劑(500mg 分兩次注射:300mg+200mg,分別在兩個(gè)不同的注射部位注射)
100mg、200mg、300mg Inclisiran 或安慰劑
該研究的主要終點(diǎn)是第 180 天 LDL-C 水平相對(duì)于基線的變化。安全性隨訪至第 210 天,LDL-C 和 PCSK9 水平數(shù)據(jù)可持續(xù)檢測(cè)至第 240 天。

Ⅱ 期臨床試驗(yàn)設(shè)計(jì)
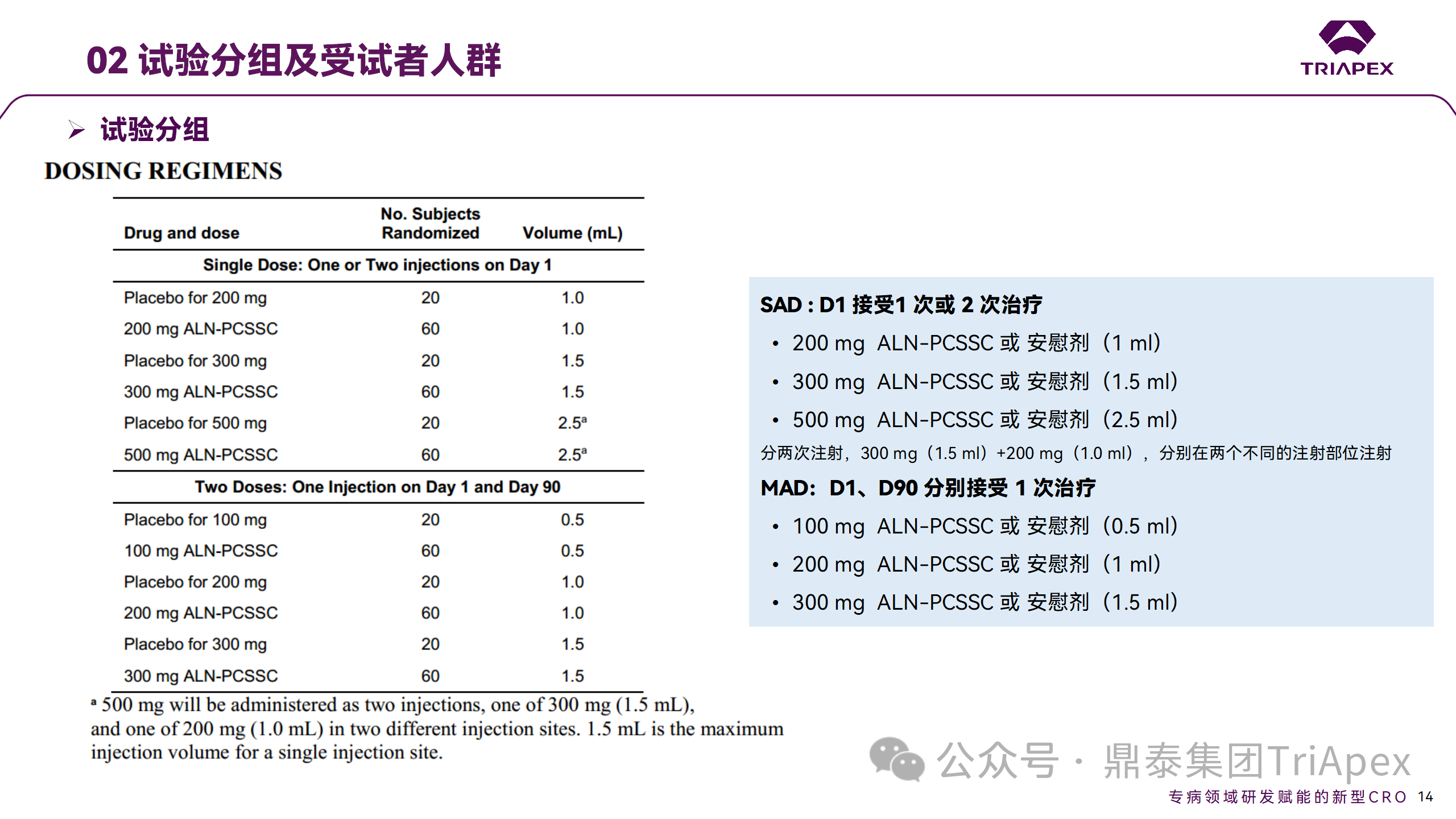
Ⅱ 期臨床試驗(yàn)分組
研究結(jié)果顯示,接受 Inclisiran 治療的患者 PCSK9 和 LDL-C 水平呈劑量依賴性降低;MAD 隊(duì)列中,300mg Inclisiran 對(duì) LDL-C 的影響程度最大,48% 患者的 LDL-C 水平在 D180 時(shí)<1.3 mmol/L。76% 的受試者出現(xiàn) AE,大多為輕至中度,最常見的 AE 為肌痛、頭痛、疲勞、鼻咽炎、背痛、高血壓、腹瀉和頭暈。該項(xiàng)試驗(yàn)表明,Inclisiran 可降低 LDL-C 水平升高的心血管高危患者的 PCSK9、LDL-C 水平,為后續(xù) Ⅱ 期臨床 ORION-7、Ⅲ 期臨床試驗(yàn)的劑量選擇提供依據(jù)。
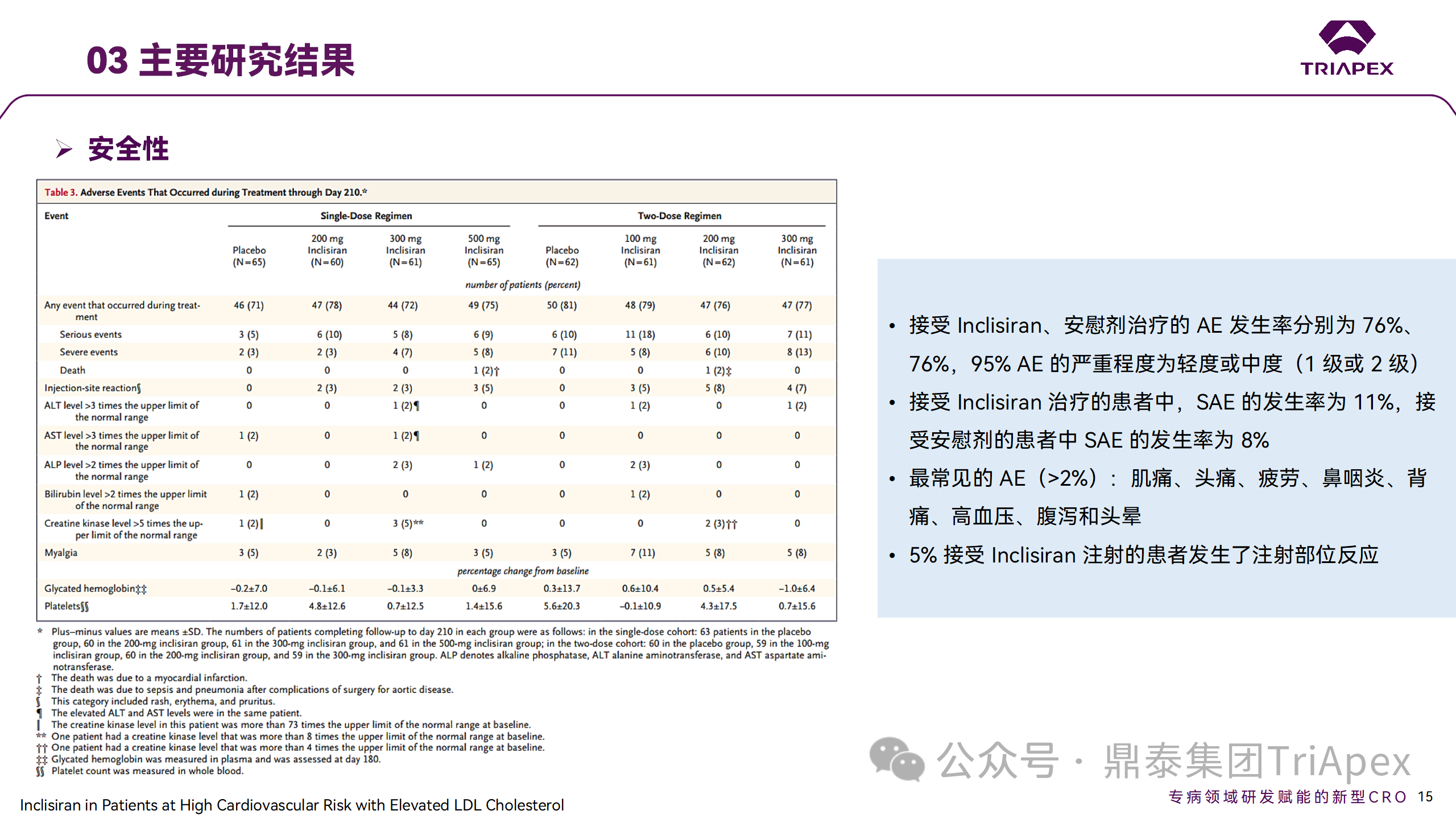
Ⅱ 期臨床試驗(yàn)安全性結(jié)果
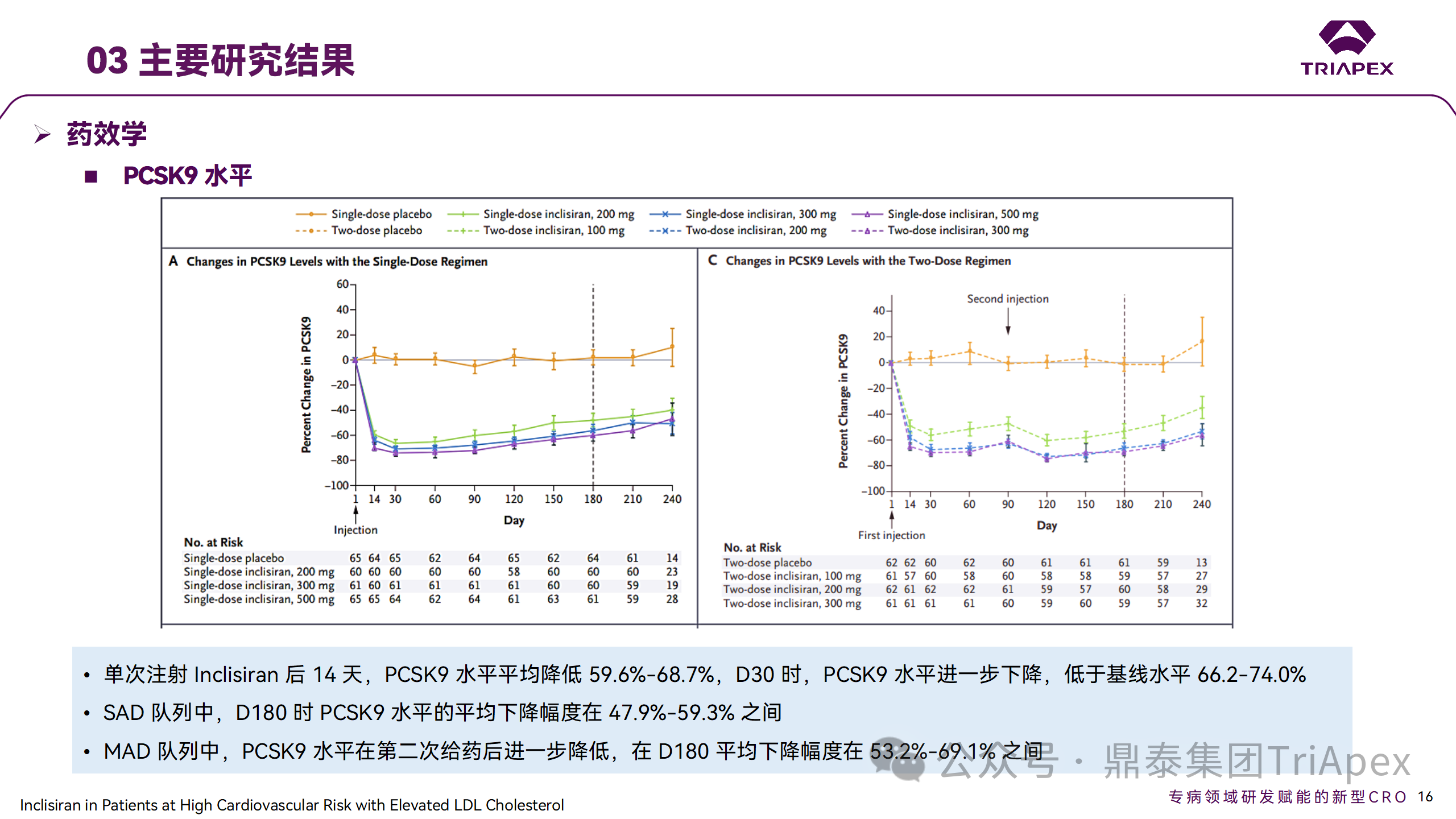

Ⅱ 期臨床試驗(yàn)藥效學(xué)相關(guān)結(jié)果
② NCT03060577-ORION-3,Multinational(ORION-1 的擴(kuò)展試驗(yàn))
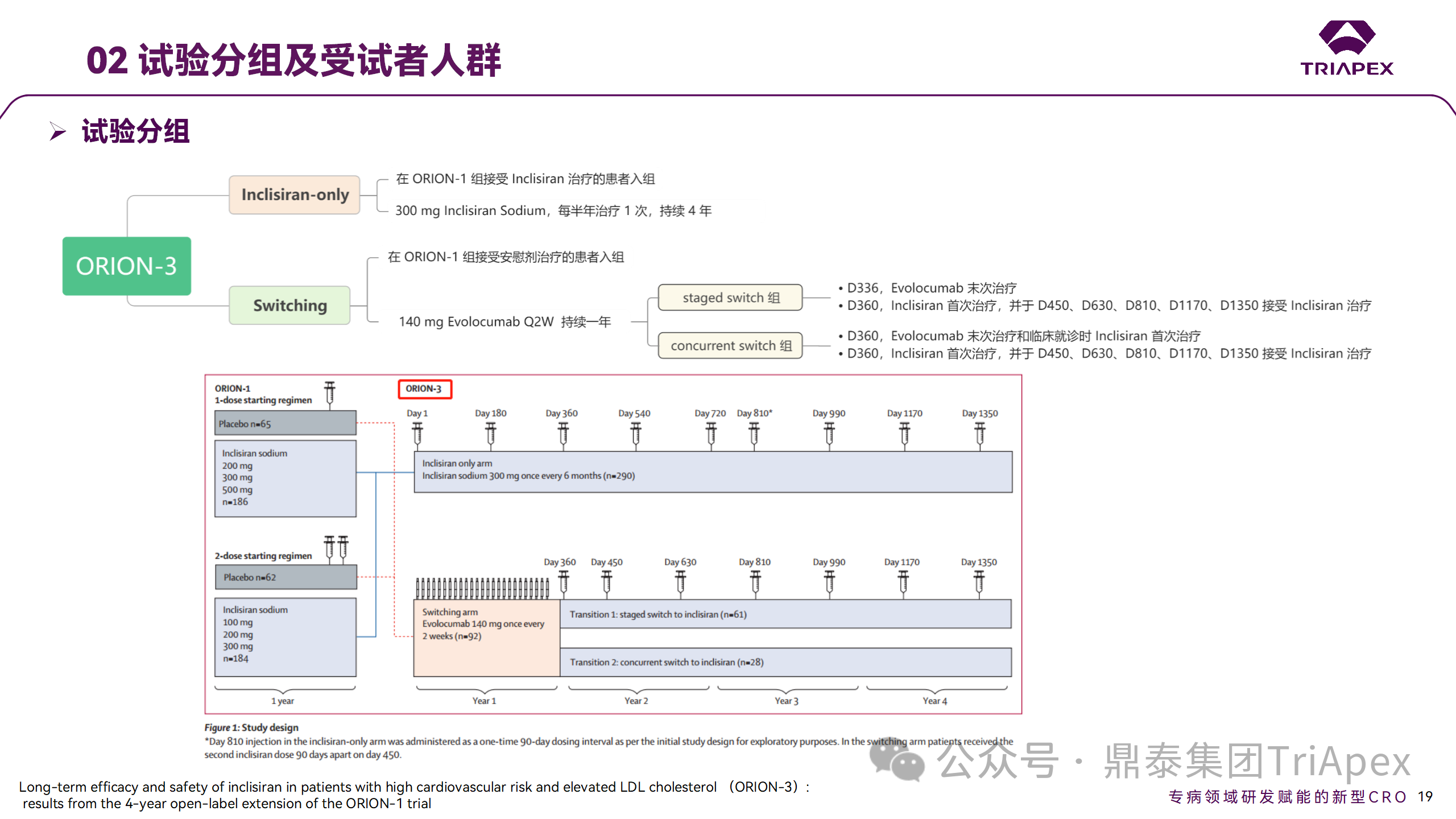
ORION-3 是一項(xiàng)開放標(biāo)簽、多中心、長(zhǎng)期(4年)的擴(kuò)展(OLE)試驗(yàn),在完成 ORION-1 Ⅱ 期試驗(yàn)的受試者中進(jìn)行。該項(xiàng)研究納入的 ASCVD 患者或 ASCVD 風(fēng)險(xiǎn)相關(guān)患者盡管接受了最大耐受劑量的他汀類藥物治療,但 LDL-C 仍然升高。來(lái)自 ORION-1 的受試者在完成試驗(yàn)后至少到第 210 天,并且 LDL-C 恢復(fù)到基線值的 20% 以內(nèi),或者患者完成第 360 天的訪問(wèn)(ORION-1),沒(méi)有 Inclisiran 或 evolocumab 的禁忌癥,則有資格參加 ORION-3。此外,受試者必須滿足 ORION-3 的所有納入和排除標(biāo)準(zhǔn),并簽署知情同意書。
該試驗(yàn)包括 2 個(gè)治療組:第 1 組(Inclisiran-only 組)只使用 300mg Inclisiran,每半年治療 1 次,持續(xù) 4 年;第 2 組(Switching組)接受evolocumab Q2W 治療 1 年后,接受 300mg Inclisiran 治療,完成剩余的試驗(yàn)。第 2 組受試者按研究機(jī)構(gòu)編號(hào)分為兩種過(guò)渡模式:
? 過(guò)渡期 1(分階段):第 336 天最后一次接受 evolocumab 治療,第 360 天隨訪時(shí)給予首次 Inclisiran 給藥,之后每半年治療 1 次,持續(xù)治療 3 年;
? 過(guò)渡期 2(同時(shí)):第 336 天在家接受最后一次 evolocumab 治療,第 360 天隨訪時(shí)接受額外的一劑 evolocumab,并且同時(shí)接受首次 Inclisiran 治療,之后每半年治療 1 次,持續(xù)治療 3 年。
該項(xiàng)臨床試驗(yàn)的主要終點(diǎn)為第 210 天 LDL-C 水平從基線到 ORION-3(Inclisiran組)的變化百分比,次要終點(diǎn)為血清 LDL-C、PCSK9 和其他脂質(zhì)參數(shù)相對(duì)于基線的變化百分比。

Ⅱ 期臨床試驗(yàn)設(shè)計(jì)
Ⅱ 期臨床試驗(yàn)分組
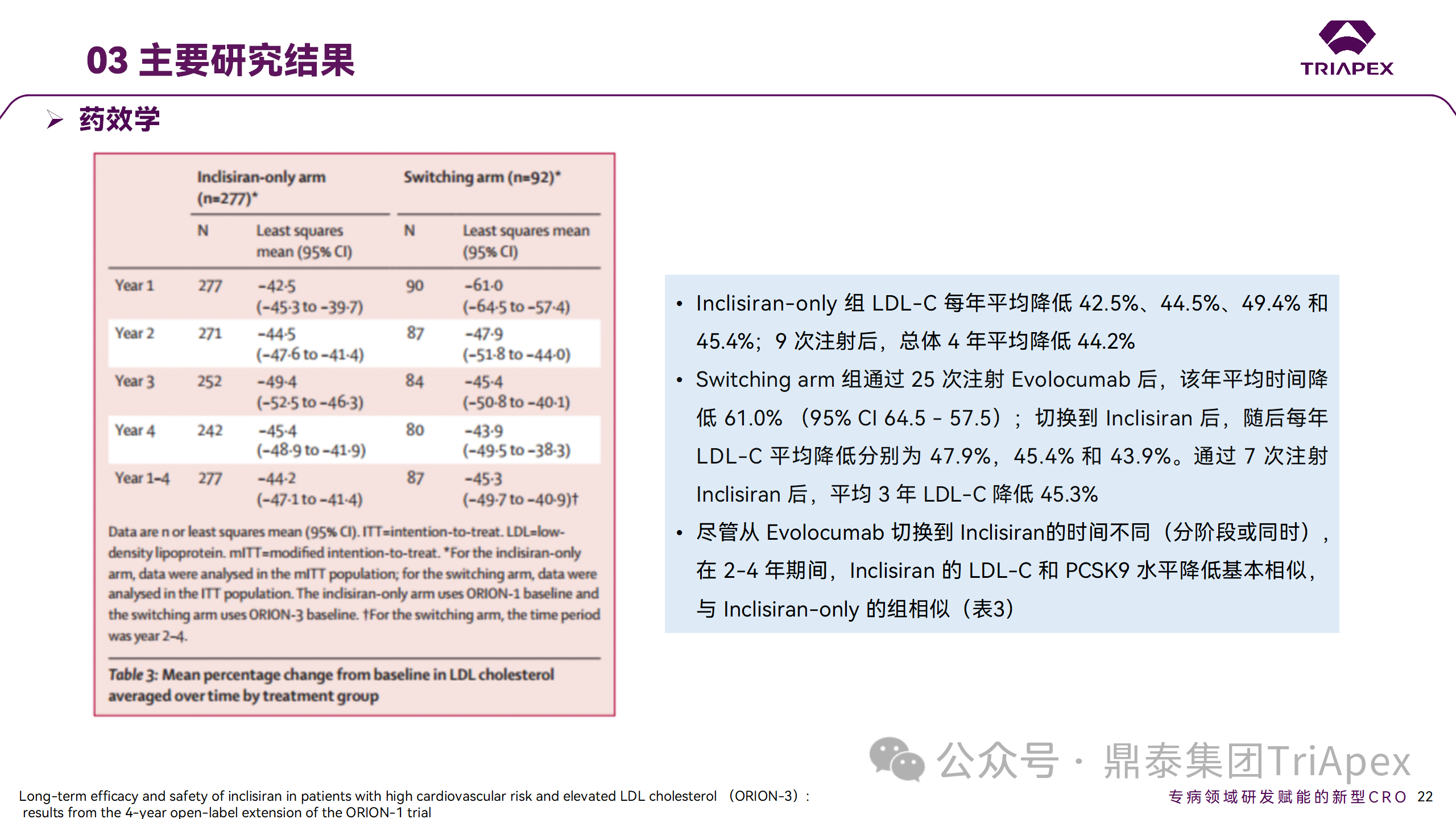
在 Ⅱ 期 OLE 試驗(yàn) ORION-3 中,最常見的 SAE 是心絞痛和骨關(guān)節(jié)炎,最常見的 AE 是鼻咽炎、高血壓、尿路感染、流感和關(guān)節(jié)痛。每年兩次 Inclisiran 皮下給藥耐受性良好,4 年間 LDL-C 和 PCSK9 水平持續(xù)有效降低。
ORION-3 表明,Inclisiran 的長(zhǎng)期藥效學(xué)作用不僅具有良好的耐受性,而且通過(guò)每年兩次的給藥,使 LDL-C 的持續(xù)額外降低成為可能。
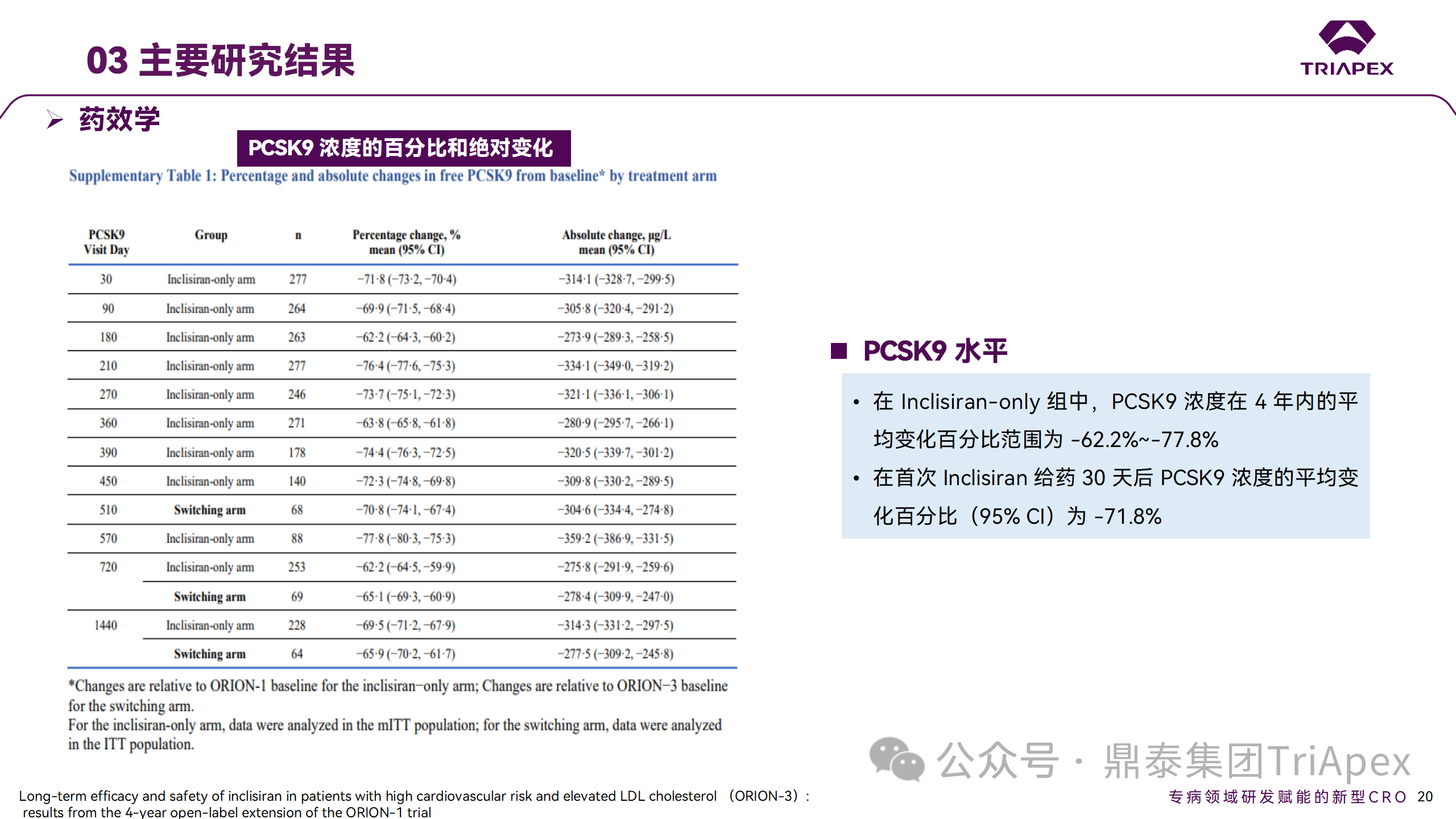

Ⅱ 期臨床試驗(yàn)藥效學(xué)相關(guān)結(jié)果
3、Ⅲ 期臨床
Ⅲ 期臨床劑量設(shè)計(jì)依據(jù)
在整個(gè) Ⅲ 期研究期間, Inclisiran sodium 的給藥劑量為 300mg。該劑量的設(shè)計(jì)依據(jù)包括:非臨床研究中的總體安全性數(shù)據(jù)、ALNPCSSC-001 Ⅰ 期和 ORION-1 Ⅱ 期研究的臨床數(shù)據(jù)以及多項(xiàng) PCSK9 抗體研究、群體 PD 模型的數(shù)據(jù)。

Ⅲ 期臨床試驗(yàn)劑量設(shè)計(jì)依據(jù)
① NCT03397121、NCT03399370、NCT03400800
基于 ORION-9、ORION-10 和 ORION-11 3 項(xiàng)關(guān)鍵的臨床試驗(yàn)結(jié)果,Inclisiran 的首個(gè) NDA 最終獲得 FDA 的批準(zhǔn)。這 3 項(xiàng)試驗(yàn)納入了大約 3660 名 HeFH 或 ASCVD 患者,這些患者盡管接受了最大耐受劑量的他汀類藥物治療,但 LDL-C 仍升高,他們?cè)诘?1 天、第 90 天、后續(xù)每 6 個(gè)月皮下注射 Inclisiran sodium 300mg,持續(xù) 18 個(gè)月。試驗(yàn)人群包括相關(guān)的并發(fā)癥,如年齡老化、腎功能損害、肝功能損害、高血壓和糖尿病等。主要研究終點(diǎn)為 LDL-C 從基線到第 510 天的變化百分比。

Ⅲ 期臨床試驗(yàn)

Ⅲ 期臨床試驗(yàn)分組
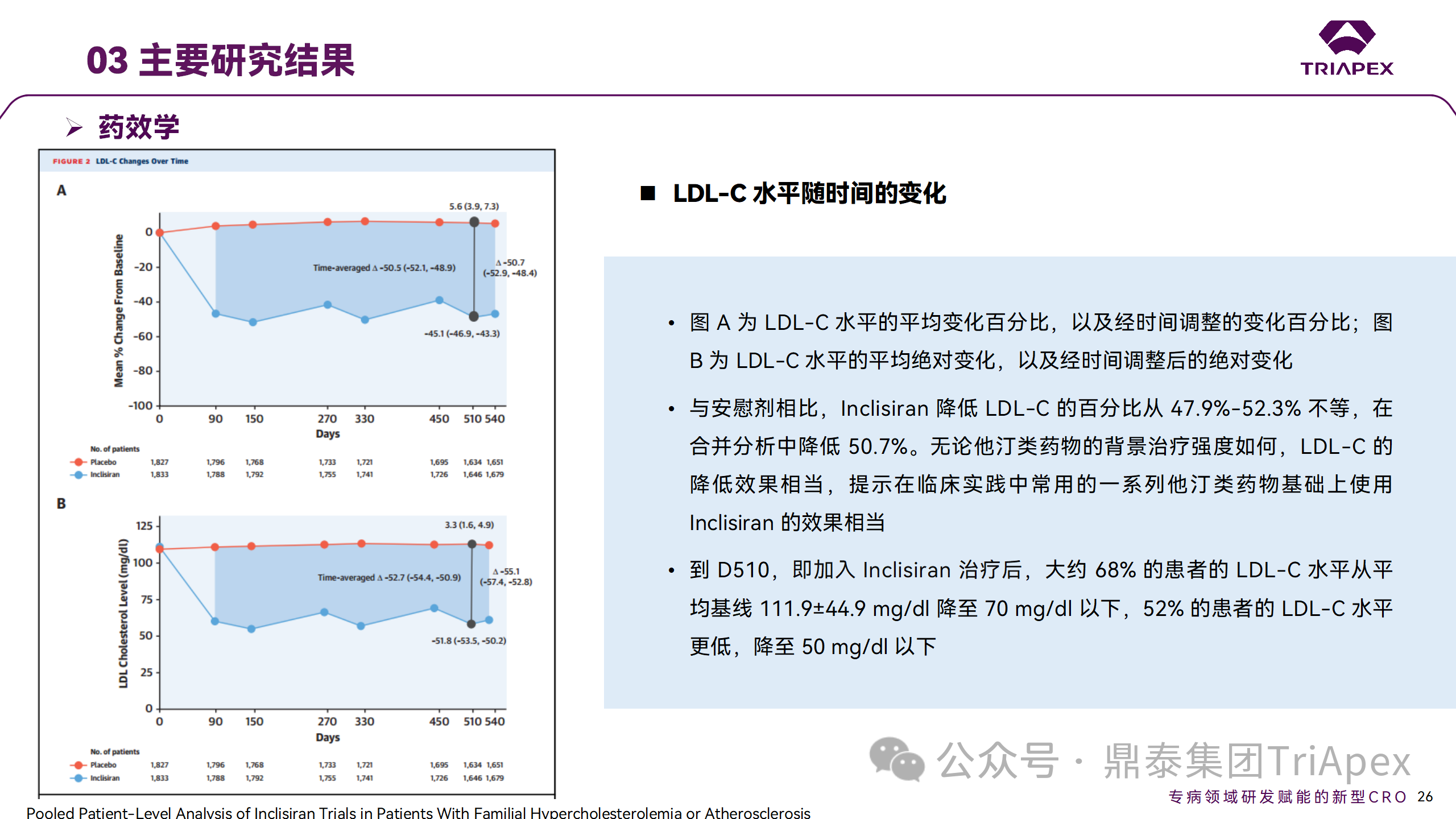
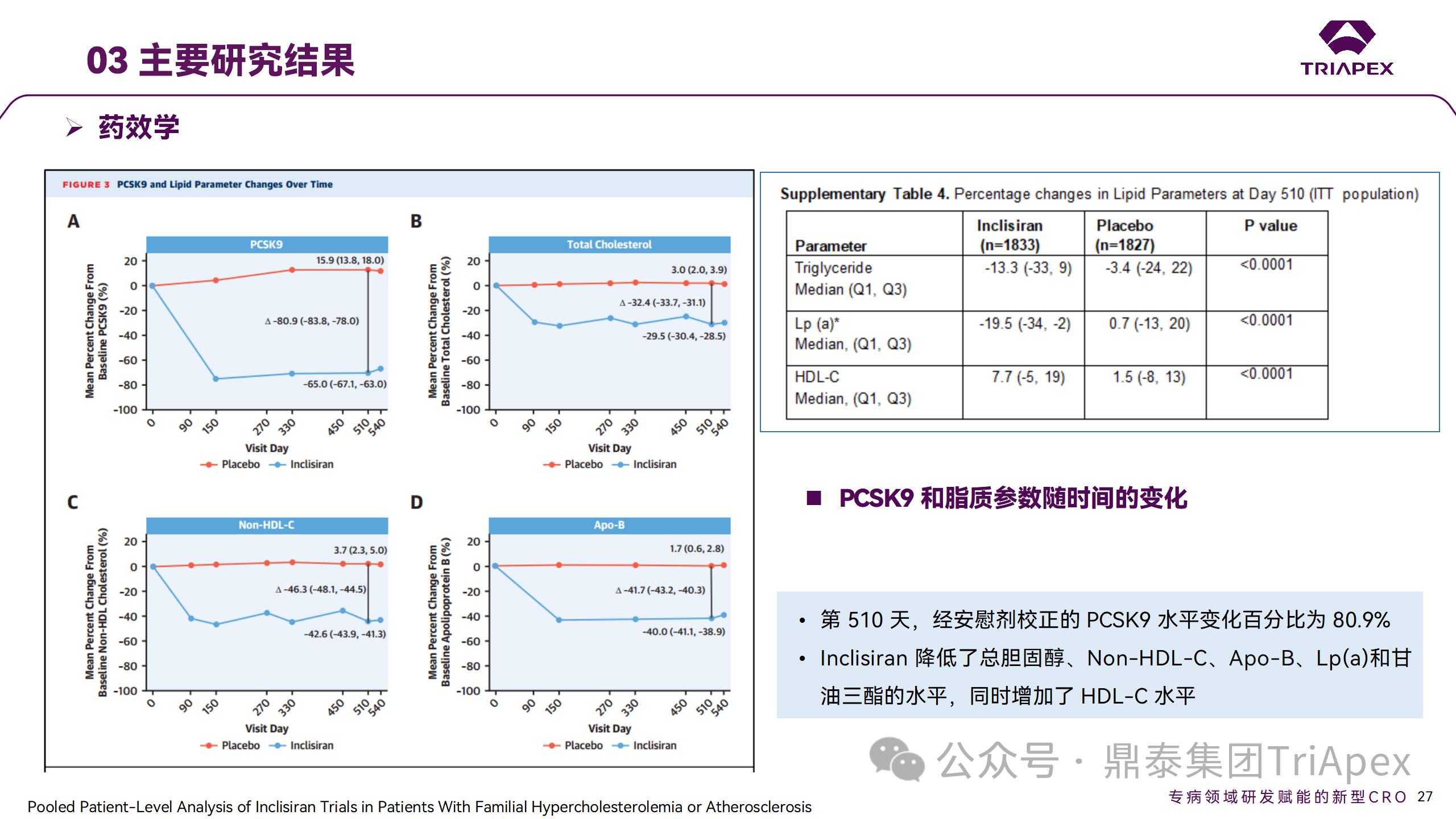
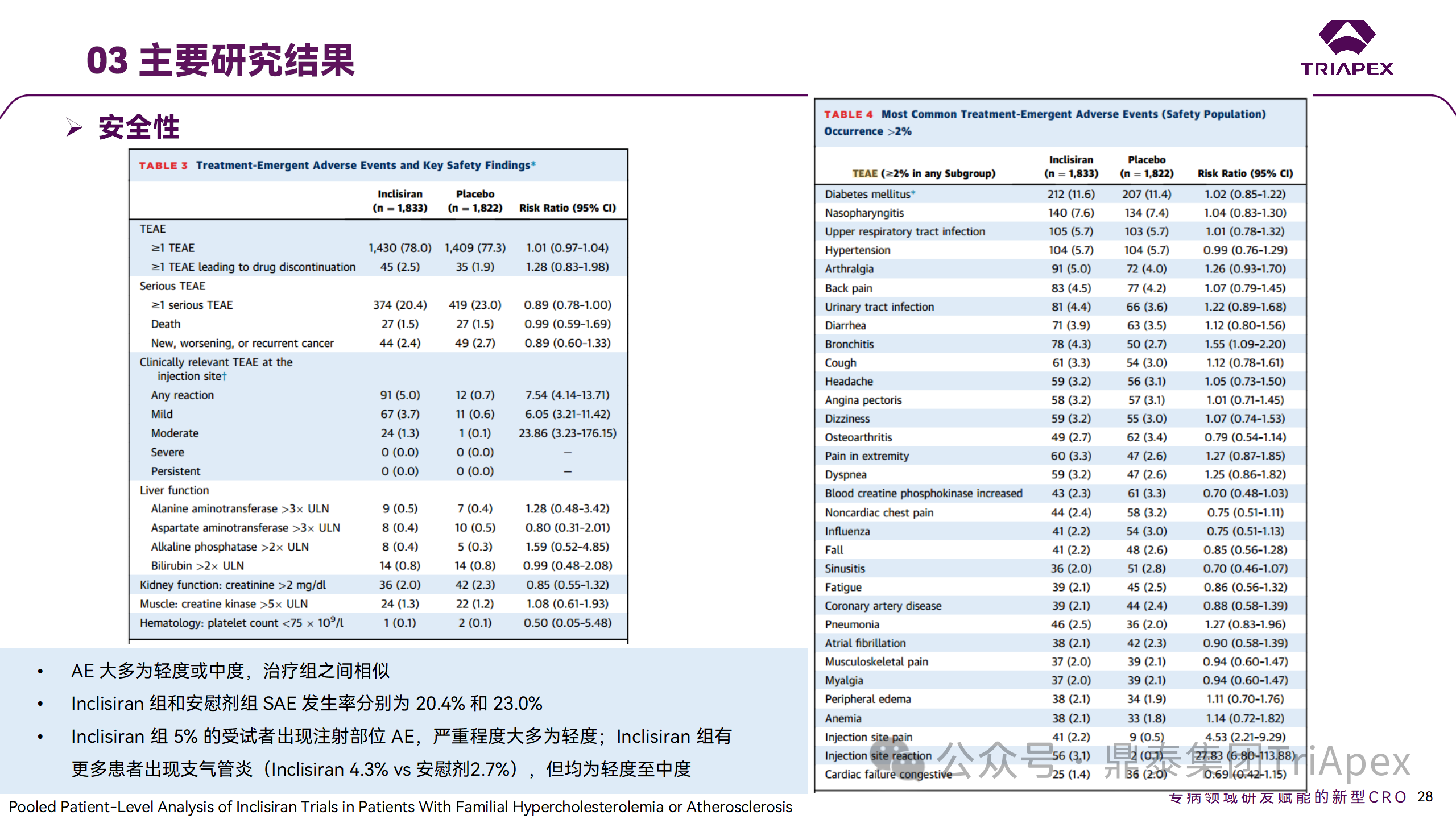
ORION-9、ORION-10 和 ORION-11 3項(xiàng)臨床試驗(yàn)的匯總分析顯示,Inclisiran 治療 17 個(gè)月后,平均 LDL-C 降低了 50.7%,平均 PCSK9 降低了80.9%;在安全性方面,Inclisiran 組與安慰劑相似,支氣管炎和注射部位出現(xiàn)適度的自限性(Modest excess of self-limited)、輕度至中度的 AE;組間肝臟、肌肉、血液學(xué)參數(shù)無(wú)差異。
Ⅲ 期臨床試驗(yàn)藥效學(xué)結(jié)果
Ⅲ 期臨床試驗(yàn)安全性結(jié)果
04
監(jiān)管互動(dòng)里程碑
Inclisiran 的成功上市,與合理的臨床試驗(yàn)設(shè)計(jì)息息相關(guān),當(dāng)然也離不開與監(jiān)管的高效互動(dòng)。在 Inclisiran 的上市歷程中,就非臨床研究、臨床試驗(yàn)設(shè)計(jì)等問(wèn)題,多次與監(jiān)管緊密互動(dòng),如 Ⅱ 期臨床結(jié)束后的 EOP2 會(huì)議、上市前的 Pre-NDA 會(huì)議等。
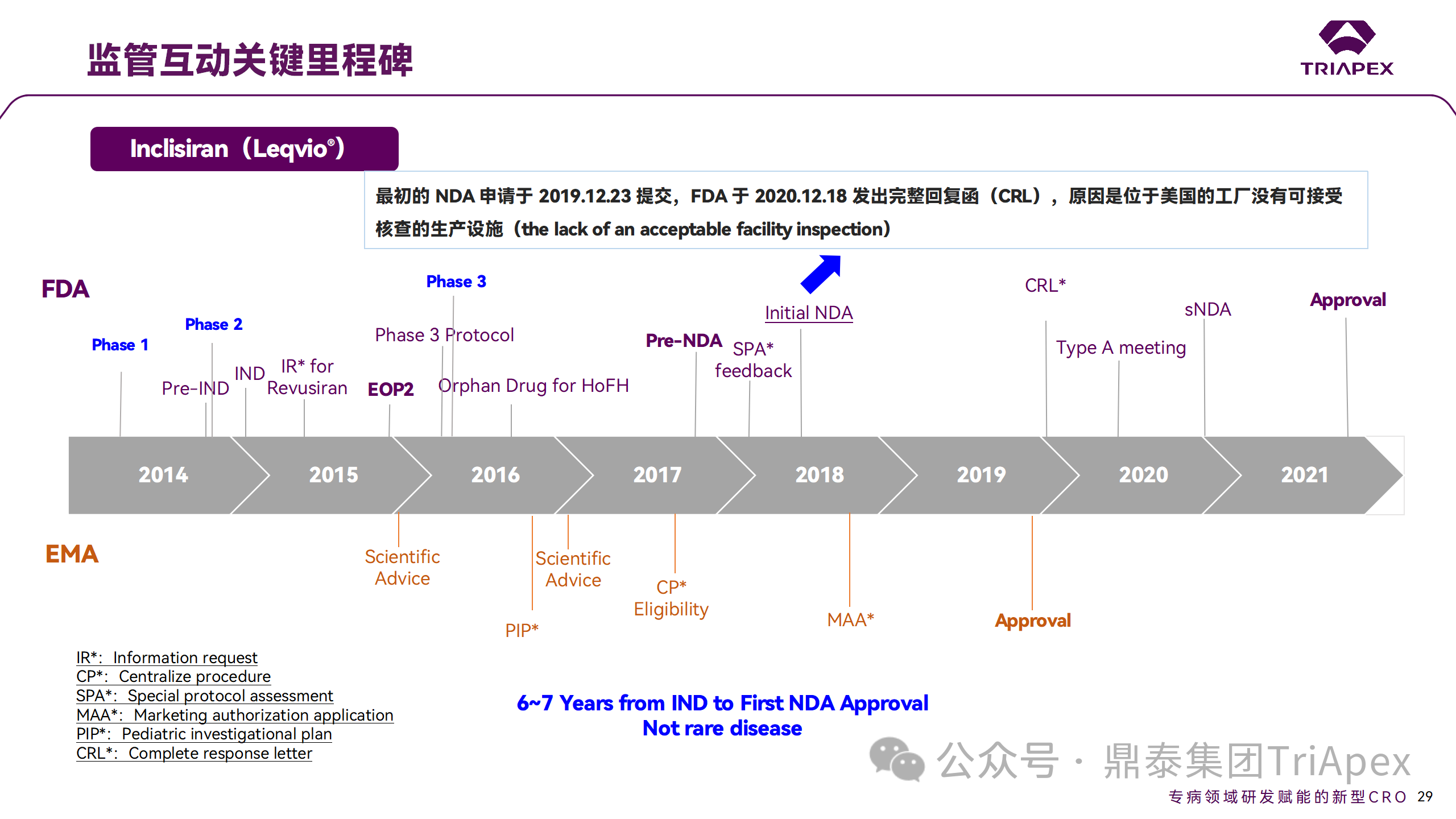
監(jiān)管互動(dòng)里程碑
1、EOP2 會(huì)議

EOP2 會(huì)議
在 2017 年 4 月 6 日召開的 EOP2 會(huì)議上,申請(qǐng)人就 Inclisiran 的非臨床和臨床開發(fā)計(jì)劃、臨床劑量和給藥方案與 FDA 進(jìn)行溝通,部分臨床相關(guān)溝通內(nèi)容如下:
Q:FDA 是否同意通過(guò)已驗(yàn)證的抗藥物抗體(ADA)檢測(cè)方法進(jìn)行免疫原性檢測(cè)的計(jì)劃?
FDA 指出,確定 ADA 是否與內(nèi)源性治療藥物有交叉反應(yīng)可以更好地了解治療風(fēng)險(xiǎn)。由于在目前臨床研究中沒(méi)有檢測(cè)到 ADA,F(xiàn)DA 沒(méi)有要求且認(rèn)為不需要開發(fā)這種檢測(cè)方法。然而,一旦在臨床中檢測(cè)到 ADA,則可能需要額外的檢測(cè)來(lái)充分評(píng)估產(chǎn)品的安全性。FDA 建議在第 30 天新增 ADA 的檢測(cè),以評(píng)估早期 IgG 反應(yīng)。此外,F(xiàn)DA 還建議申請(qǐng)人在關(guān)鍵臨床試驗(yàn)期間收集樣品用于 ADA 檢測(cè)。
申請(qǐng)人的觀點(diǎn)是,在 Ⅰ 期或 Ⅱ 期研究中未觀察到 ADA,并針對(duì) FDA 建議進(jìn)行進(jìn)一步澄清確認(rèn)(seeking some clarity regarding the request),以確定這些抗體是否與人類 RNA 會(huì)產(chǎn)生交叉反應(yīng)。但由于 RNA 的不穩(wěn)定性,很難開發(fā)出這樣的檢測(cè)方法。因此,申請(qǐng)人認(rèn)為在觀察到 ADA 的情況下檢測(cè)免疫復(fù)合物已足夠。
Q:FDA 是否同意擬開展的 PD 參數(shù)總體評(píng)估方法(沒(méi)有具體的 PK 參數(shù)評(píng)估)?
基于 Inclisiran 相對(duì)較短的半衰期(約為 7 h)和較長(zhǎng)的 PD 效應(yīng)(單次注射后對(duì) PCSK9 和 LDL-C 的影響,在大多數(shù)受試者中持續(xù)超過(guò) 6 個(gè)月),傳統(tǒng)的群體 PK 模型不太可能提供關(guān)于特殊人群劑量變化的信息,申請(qǐng)人計(jì)劃從 Ⅲ 期研究的受試者中收集 PD 數(shù)據(jù)(不進(jìn)行 PK 采集)來(lái)評(píng)估 PD 效應(yīng)的可能差異以及在特殊人群中調(diào)整劑量的必要性。
FDA 承認(rèn) Inclisiran 的 PK 和 PD 之間存在明顯的不相關(guān)性,臨床藥理學(xué)信息可使用 PD 數(shù)據(jù)進(jìn)行評(píng)估,但要有充分的理由和足夠的數(shù)據(jù)來(lái)支持 PCSK9 的檢測(cè),以評(píng)估 Inclisiran 的療效和安全性。FDA 建議提供 PD 參數(shù)總體評(píng)估的細(xì)節(jié),重點(diǎn)是如何對(duì)這些參數(shù)和參數(shù)的主要應(yīng)用進(jìn)行評(píng)價(jià)。
Q:FDA 是否同意整體的臨床藥理學(xué)方案,并同意他們可以支持最終的 NDA 提交和批準(zhǔn)?
申請(qǐng)人正在進(jìn)行一項(xiàng)體外轉(zhuǎn)運(yùn)體篩選研究,申請(qǐng)人將根據(jù)該項(xiàng)結(jié)果及前期研究評(píng)估是否需要額外的 DDI 研究。此外,還將對(duì)腎和肝功能損害患者進(jìn)行 Inclisiran PK/PD 研究,以評(píng)估是否需要針對(duì)上述人群進(jìn)行劑量調(diào)整。
考慮到他汀類藥物是擬開展的適應(yīng)癥中重要的聯(lián)合用藥對(duì)象,F(xiàn)DA 建議評(píng)估包括 PD 在內(nèi)的 DDI 的可能性。典型的單次給藥 DDI 研究可能無(wú)法為 Inclisiran 評(píng)估 PK 和 PD 相互作用提供足夠的數(shù)據(jù)。因此,F(xiàn)DA 建議在穩(wěn)定狀態(tài)下進(jìn)行研究,例如使用稀疏采樣的總體分析方法。或者,將 PCSK9 數(shù)據(jù)(含或不含他汀類藥物)與他汀類藥物 PK 一起收集,有助于和使用已有數(shù)據(jù)(例如 Ⅱ 期研究結(jié)果)來(lái)評(píng)估 PD 相互作用的潛力。
此外,F(xiàn)DA 還建議在 Ⅲ 期臨床試驗(yàn)中使用擬最終上市的產(chǎn)品,并在 Ⅲ 期試驗(yàn)之前進(jìn)行肝功能損害(hepatic impairment)研究。

EOP2 會(huì)議臨床相關(guān)內(nèi)容問(wèn)答
申請(qǐng)人在 EOP2 會(huì)議中表明會(huì)根據(jù)研究結(jié)果評(píng)估 DDI 開展的必要性,但最終并未進(jìn)行體內(nèi) DDI 研究。這是因?yàn)?Inclisiran 的成分不是 CYP 450 或轉(zhuǎn)運(yùn)體的底物、抑制劑或誘導(dǎo)劑。由于臨床上有聯(lián)合用藥計(jì)劃,在毒理學(xué)研究中進(jìn)行了聯(lián)合用藥的毒性評(píng)估,未發(fā)現(xiàn)對(duì)毒性或TK影響[9]。

Inclisiran 與他汀類藥物相互作用研究
2、Pre-NDA 會(huì)議
在 Pre-NDA 會(huì)議中, FDA 就 Inclisiran 的臨床藥理學(xué)、臨床安全性和有效性、優(yōu)先審評(píng)等問(wèn)題給出回復(fù)。

Pre-NDA 會(huì)議部分建議
在 Pre-NDA 會(huì)議召開后,申請(qǐng)人于 2019 年 12 月 23 日首次提交了 NDA,F(xiàn)DA 于 2020 年 12 月18 日發(fā)出 CRL 并表明不予批準(zhǔn),原因是位于美國(guó)的生產(chǎn)工廠沒(méi)有可接受核查的生產(chǎn)設(shè)施。第二次 NDA 于 2021 年 7 月提交,并于 2021 年 12 月獲得 FDA 批準(zhǔn)上市。
3、Approval Letter
除 EOP2 會(huì)議、Pre-NDA 會(huì)議外,在 Approval Letter 中,FDA 就 ADA 檢測(cè)及特殊人群相關(guān)研究做出要求。

Approval Letter
05
免疫原性檢測(cè)與藥代動(dòng)力學(xué)
1、免疫原性和免疫毒性檢測(cè)
在非臨床研究中,采用 ELISA 法,分別在大鼠和猴的重復(fù)給藥研究中評(píng)估了免疫原性。研究結(jié)果表明 ADA 的發(fā)生率較低,滴度較低,且 ADA 的發(fā)生與劑量無(wú)關(guān),對(duì) PD 結(jié)果無(wú)影響。
≥100mg/kg 劑量下,在食蟹猴中觀察到對(duì) KLH 抗原延遲或缺乏(delayed or absent)IgM 免疫反應(yīng);300mg/kg 劑量下,觀察到對(duì) KLH IgG 免疫應(yīng)答水平的降低,并且上述變化是可逆的。此外,Inclisiran 不會(huì)刺激小鼠或猴體內(nèi)的促炎細(xì)胞因子,也不會(huì)激活猴體內(nèi)的補(bǔ)體。
在 EOP2 會(huì)議(2017.04.06)中,申請(qǐng)人指出目前的臨床研究中暫未在受試者中檢測(cè)到 ADA。但在隨后的一項(xiàng) Ⅱ 期(ORION-3,2017.04.17開始)試驗(yàn)中,對(duì) 355 名受試者進(jìn)行檢測(cè),結(jié)果發(fā)現(xiàn)治療誘發(fā)的 ADA(Treatment Induced ADA)、持續(xù)性(Persistent)ADA、一過(guò)性(Transient)ADA 的受試者分別占 6.2 %、1.1%、5.1%,但治療性 ADAs 患者均未發(fā)生相關(guān)的過(guò)敏事件。
在 3 項(xiàng) Ⅲ 期(ORION-9、ORION-10 和 ORION-11)臨床試驗(yàn)中,對(duì) 1830 名受試者進(jìn)行了 ADA 檢測(cè),研究結(jié)果發(fā)現(xiàn)治療誘導(dǎo)的 ADA 反應(yīng)發(fā)生率為 4.9%,且滴度普遍較低,一過(guò)性 ADA、持續(xù)性 ADA 的發(fā)生率分別為 2.2%、1.7%。此外,申請(qǐng)人在 pre-NDA會(huì) 議中指出,ADA 的存在與 AE、LDL-C 和 PSCK9 水平的變化之間沒(méi)有關(guān)聯(lián)。
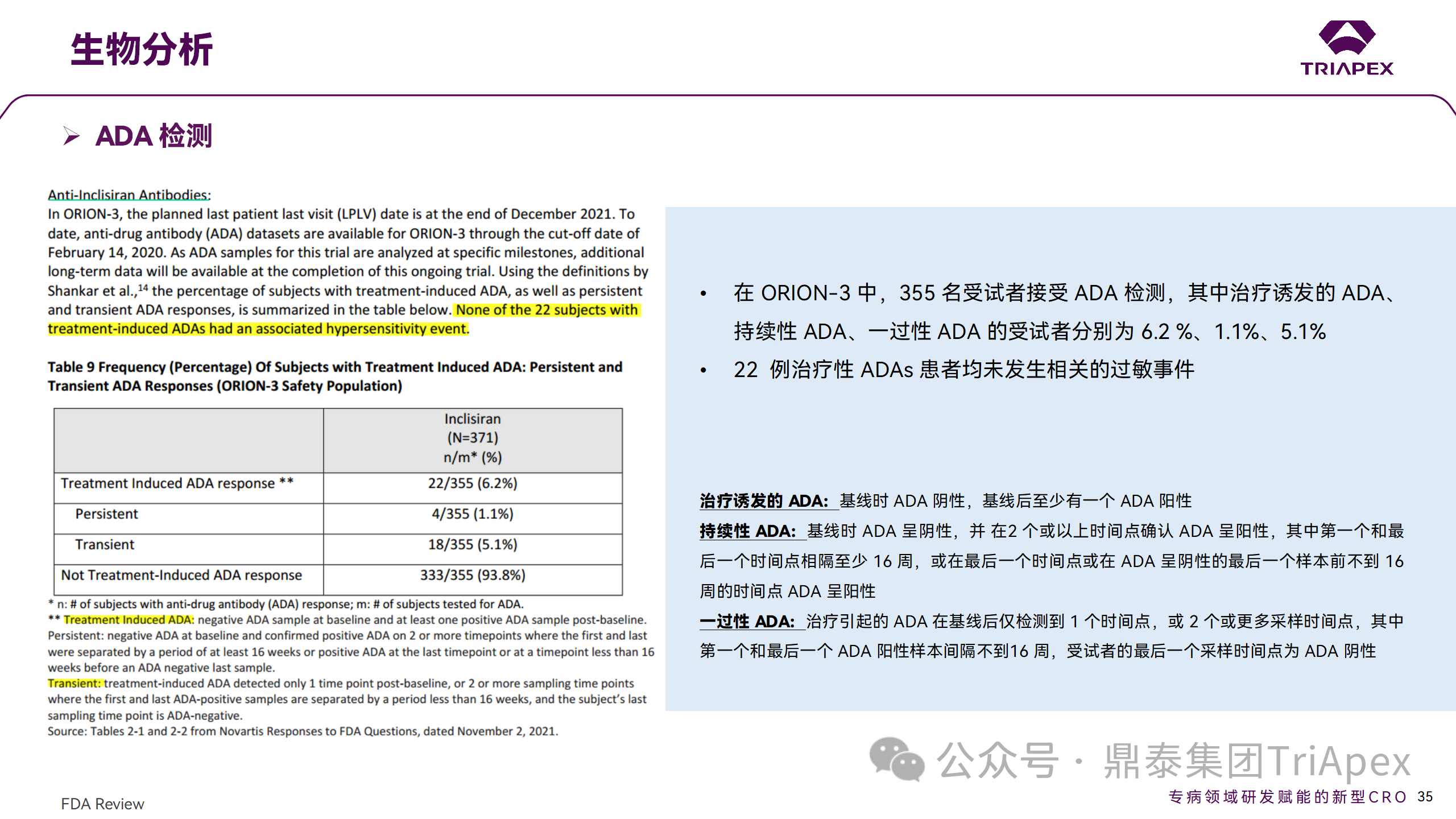

免疫原性檢測(cè)結(jié)果
2、藥代動(dòng)力學(xué)
Inclisiran 代謝的酶是核酸外切酶。雖然在 GalNAc 丟失后 SS 鏈的 3' 端有代謝物,但由于潛在的藥理活性,主要的代謝物是來(lái)自反義(AS)鏈的 5' 和 3'端 N-1 和 N-2 核苷酸的丟失,即 AS(N-1)3',AS(N-1)5',AS(N-2)3',AS(N-2)5'。
在非臨床試驗(yàn)(大鼠和猴)中,AS(N-1)是主要代謝物,濃度比 Inclisiran低數(shù)倍。在猴子模型中,腎臟排泄是主要的消除途徑,在放射性標(biāo)記 [14C]-Inclisiran 給藥后的 7 天內(nèi),尿液和糞便中的總放射性分別為 32% 和 1.6%。
在 Ⅲ 期臨床 ORION-7(腎損害試驗(yàn))中檢測(cè)了血漿樣本中 Inclisiran 代謝物的水平。研究結(jié)果發(fā)現(xiàn),在給藥后 0.5h、8h(Tmax)和 48h,AS(n-1)濃度分別約為 Inclisiran 的11%、27% 和 86%。未檢測(cè)到其他代謝物,即AS(N-2)。在 300mg 注射后,Inclisiran 的腎排泄量為劑量的 13-21%。此外,申請(qǐng)人未進(jìn)行物質(zhì)平衡研究。


藥代動(dòng)力學(xué)檢測(cè)結(jié)果
06
非臨床與臨床試驗(yàn)相關(guān)性分析
非臨床研究與臨床研究有著十分密切的關(guān)系。一方面,非臨床研究方案的設(shè)計(jì)依賴于擬定的臨床研究方案中的基本信息,包括 PK、PD 和安全性監(jiān)測(cè)相關(guān)指標(biāo)的確立;另一方面,非臨床研究結(jié)果對(duì)臨床給藥方案的制定、安全性和有效性的評(píng)估等有重要指導(dǎo)意義。特別地,為支持本品與已上市他汀類藥物的聯(lián)合用藥,開展了聯(lián)合用藥毒理試驗(yàn)。

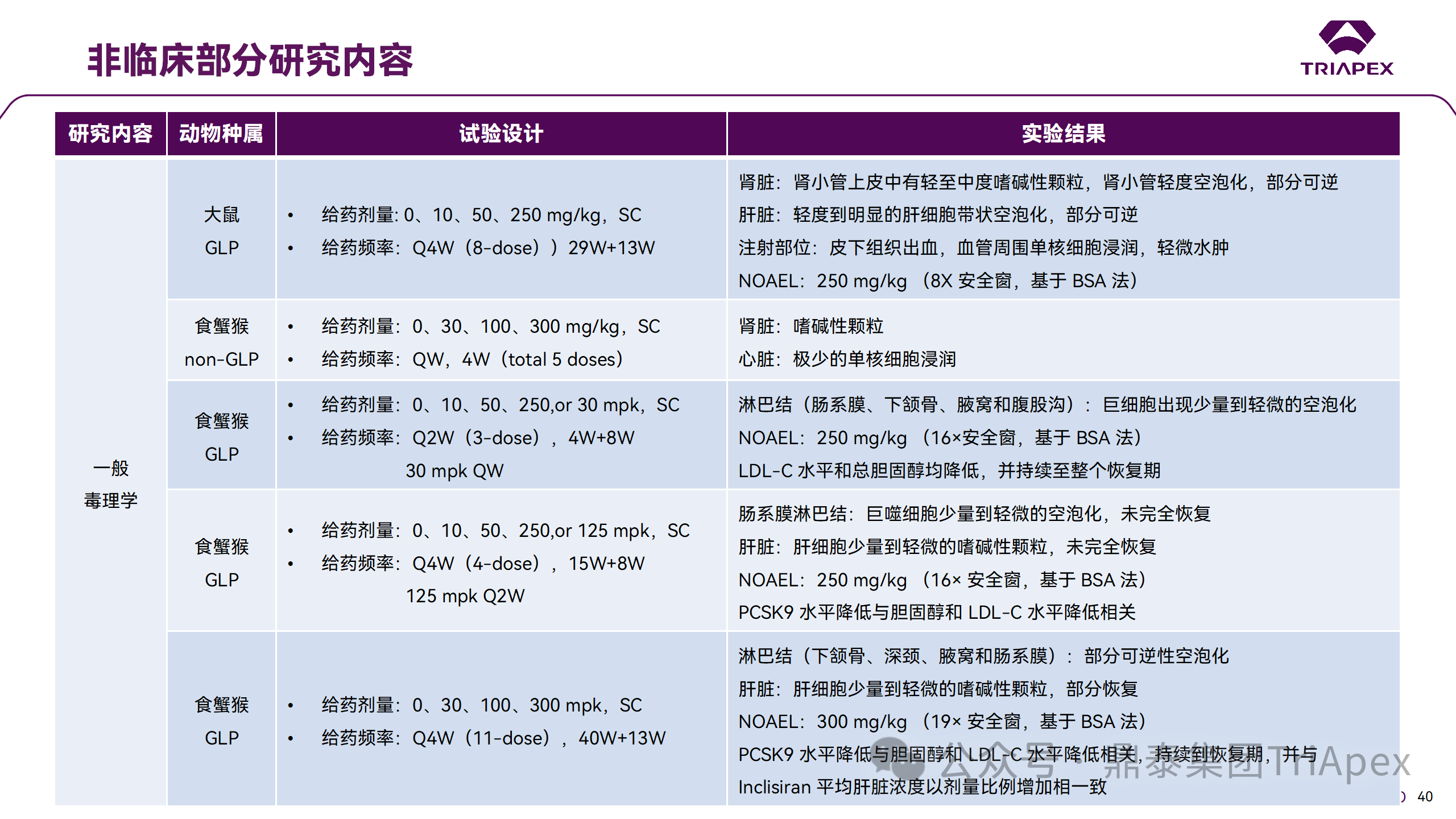
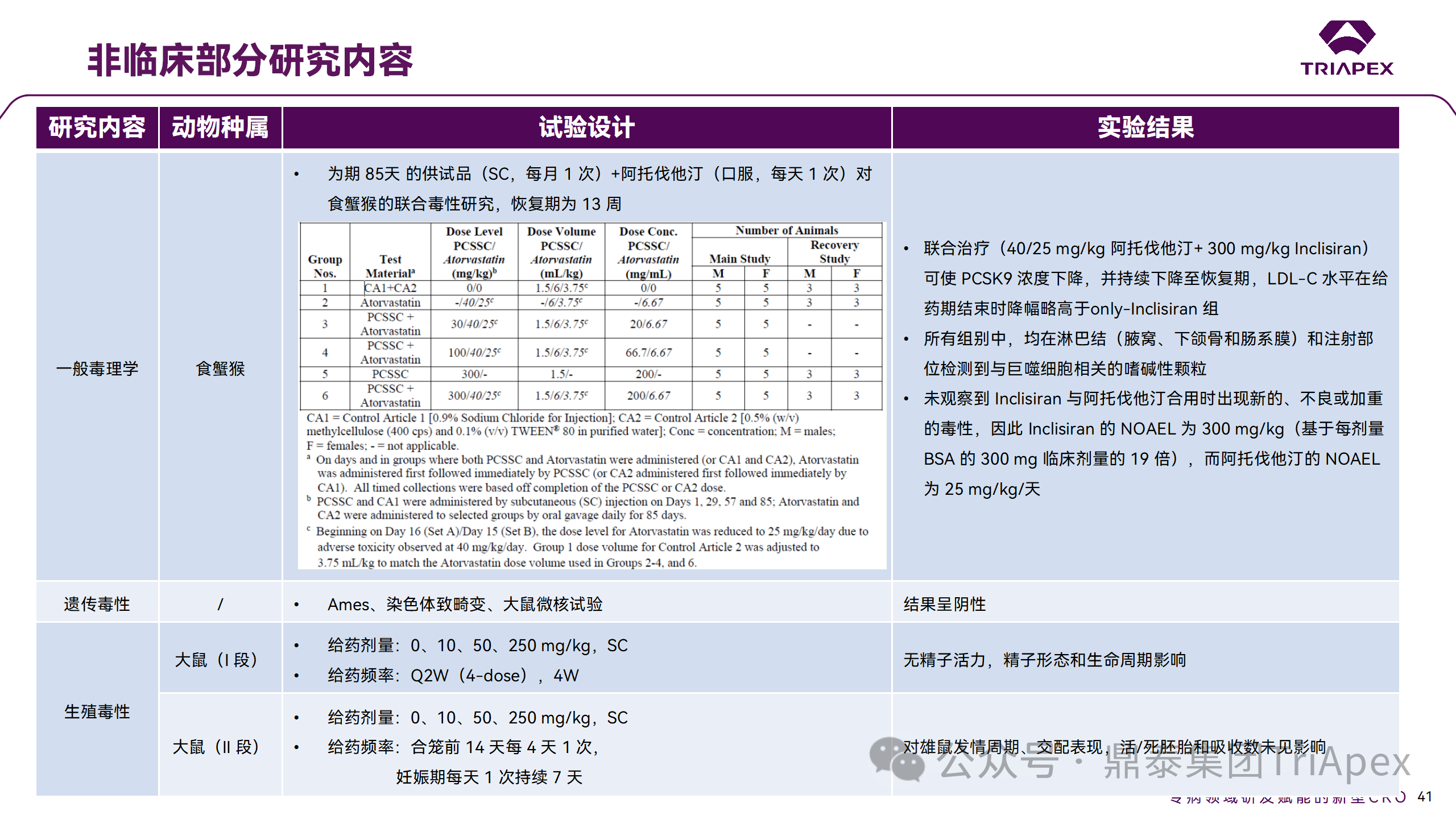
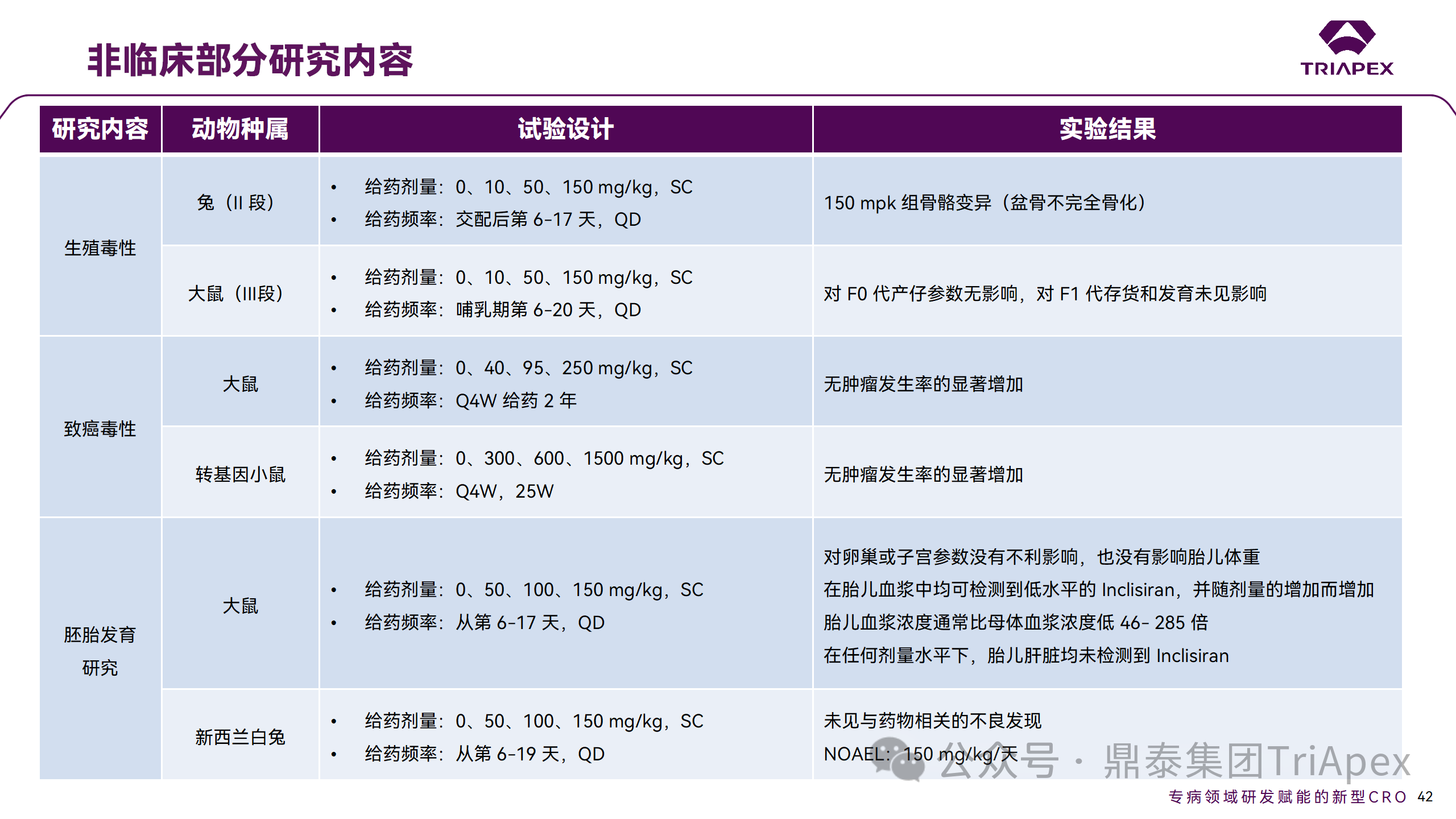
非臨床毒理研究?jī)?nèi)容
1、為臨床藥效學(xué)標(biāo)志物提供參考
食蟹猴體內(nèi)研究表明,單次給藥后 Inclisiran 可劑量依賴性持續(xù)降低血清中 PCSK9 水平和 LDL-C 水平。在小鼠體內(nèi)試驗(yàn)中觀察到單次給藥后 10 天 PCSK9 水平仍降低。在非臨床研究中觀察到的生物標(biāo)志物(LDL-C、PCSK9)的變化,為臨床研究中藥物劑量設(shè)計(jì)、給藥方案及藥效標(biāo)志物的選擇提供了依據(jù),因此在臨床試驗(yàn)上,將 LDL-C 和 PCSK9 作為主要藥效學(xué)指標(biāo)。同時(shí),非臨床的研究結(jié)果,提示了 Inclisiran 在動(dòng)物體內(nèi)具有長(zhǎng)期有效性,為臨床研究提供了初步參考。

非臨床 PD marker 與臨床 PD marker 的相關(guān)性
2、為臨床起始劑量的設(shè)計(jì)提供依據(jù)
非臨床研究結(jié)果為 FIH 劑量設(shè)計(jì)提供了重要依據(jù):在大鼠和猴重復(fù)給藥 28 天毒性試驗(yàn)中,NOAEL 分別為 250mg/kg 和 300mg/kg(基于 BW 和 BSA 法),以此確定Ⅰ期研究 SAD 組受試者的起始劑量為 25 mg。
3、提示臨床潛在不良反應(yīng)
在 Inclisiran 非臨床中發(fā)現(xiàn)的注射部位反應(yīng)預(yù)示著臨床研究中也會(huì)有潛在不良反應(yīng),并得以驗(yàn)證。
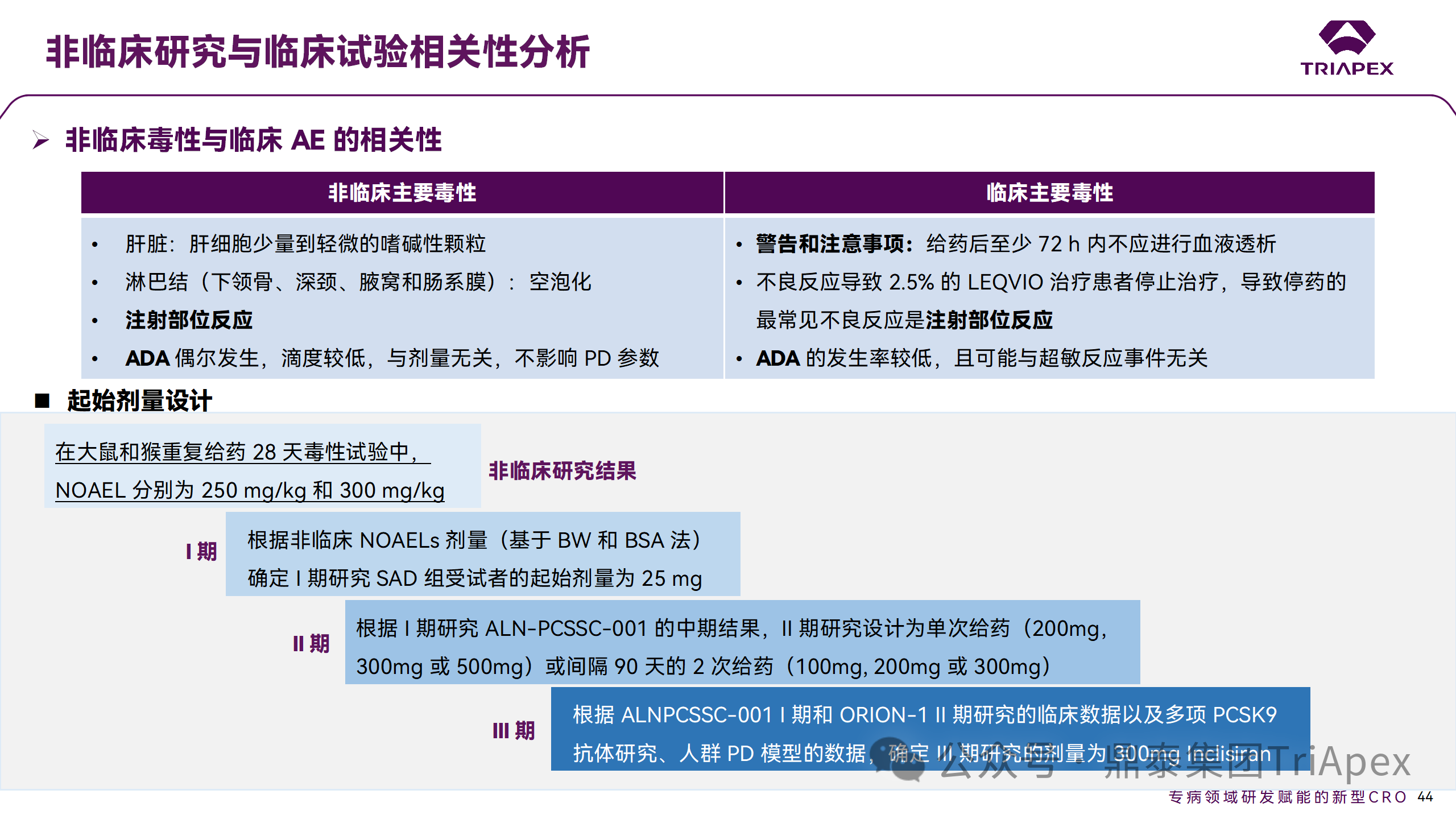
非臨床毒性與臨床 AE 的相關(guān)性
07
小結(jié)
作為唯一一款以降低膽固醇為目的的 siRNA 藥物,Inclisiran 開啟了血脂管理的新時(shí)代,實(shí)現(xiàn)了患者以更便捷、可依從、更安全的方式來(lái)進(jìn)行血脂的長(zhǎng)期管理,提升了患者的生活質(zhì)量。當(dāng)然,Inclisiran 的成功上市,離不開合理的非臨床設(shè)計(jì)、科學(xué)的臨床轉(zhuǎn)化和高效的監(jiān)管互動(dòng)。借助合理的非臨床設(shè)計(jì),確定了臨床起始劑量、臨床生物標(biāo)志物,為臨床設(shè)計(jì)及結(jié)果解讀提供強(qiáng)有力的數(shù)據(jù)支持;借助高效的監(jiān)管互動(dòng),就產(chǎn)品開發(fā)中遇到的問(wèn)題(如 ADA 的檢測(cè)計(jì)劃、PD 參數(shù)總體評(píng)估方法、整理臨床試驗(yàn)設(shè)計(jì)等)與 FDA 積極溝通,并獲得 FDA 的認(rèn)同和建議。
Inclisiran 在慢性疾病領(lǐng)域的成功,吸引著越來(lái)越多的跟隨創(chuàng)新和原創(chuàng)新靶點(diǎn)藥物的開發(fā),Inclisiran 的成功經(jīng)驗(yàn)為 siRNA 藥物的研發(fā)提供了寶貴的借鑒,這些策略和做法也為后續(xù)同類產(chǎn)品的研發(fā)提供了寶貴的經(jīng)驗(yàn)和啟示。
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺(tái)觀點(diǎn)。如涉及作品內(nèi)容、版權(quán)和其它問(wèn)題,請(qǐng)與本網(wǎng)站留言聯(lián)系,我們將在第一時(shí)間刪除內(nèi)容


微信公眾號(hào)

藥方舟手機(jī)版

