生物制品的質量控制是其藥學研究和評價的關鍵,貫穿藥品的整個生命周期。隨著生物制品相關分析技術的發展和上市后產品知識的積累,上市許可持有人(marketing authorization holder,MAH)可持續改進藥物分析方法,增強質量風險管理。本文從監管角度出發,探討關于治療用生物制品分析方法變更的審評考量,分享分析方法變更的相關案例,為制藥企業持續不斷提升藥物質量控制和完善分析方法變更申報資料提供參考。
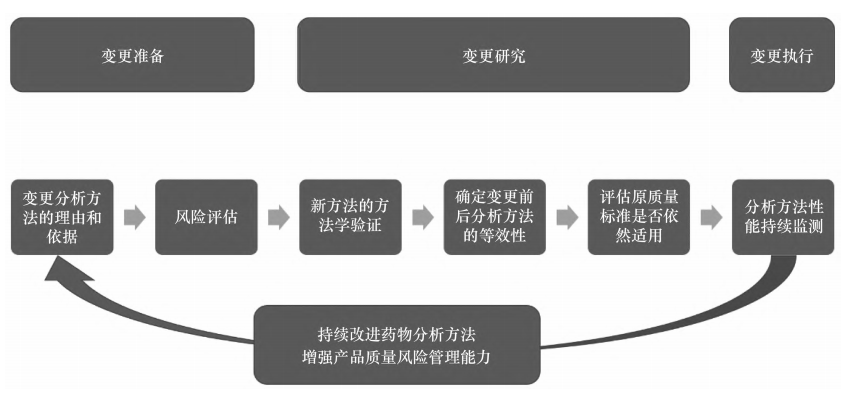
關鍵詞:治療用生物制品;分析方法;全生命周期管理;上市后藥學變更生物制品的質量控制是其藥學研究和評價的關鍵內容,貫穿藥物的全生命周期管理。在開發期間研究者需要根據臨床安全性、有效性、免疫原性和藥動學影響對藥物質量屬性進行評估,以確定其是否為關鍵質量屬性,針對關鍵質量屬性建立相應的控制策略,選擇特定檢測項目的分析方法,并對檢測結果制定合理的可接受范圍[1-2]。分析方法作為質量控制的重要組成部分,決定了質量控制體系的可靠性和準確性。分析方法的開發、驗證、轉移、變更和日常監測是連續且相互關聯的,貫穿了產品生命周期管理的始終,不斷推動著產品質量朝著更優的方向發展[3-4]。藥物早期的研發、臨床試驗申請和注冊過程往往經歷分析方法的開發、建立、確認、驗證、轉移、再驗證等過程,從而確保分析方法適用于藥物的過程中控制、放行檢測和穩定性檢測[5]。在獲批上市后,一方面上市許可持有人(marketing authorization holder,MAH)需要對生產工藝進行持續驗證,不斷積累商業化生產的研究數據;另一方面,隨著更加先進和靈敏的分析技術的出現和成熟運用,MAH 利用這些新技術持續改進藥物分析方法,采用更優的分析技術以增強產品質量風險管理能力[6]。應用新的質量控制分析方法,往往具有降低檢驗成本、提高方法穩健性、加快產品放行、減少實驗動物使用等方面的優勢。本文將從監管角度出發,探討生物制品分析方法變更的相關案例,為MAH 持續不斷提升藥品質量控制和完善上市后變更申報資料提供參考。ICH Q8,Q9,Q10 和 Q11 等指導原則描述了用于藥物開發的質量源于設計(quality by design,QbD)理念、方法和工具以及全生命周期的質量體系要求[6-8]。隨著 QbD 在藥物開發中的應用越來越廣泛,已擴展到包括分析方法生命周期在內的分析方法開發和維護中。在分析質量源于設計(analyti-cal quality by design,AQbD)框架下,MAH 應充分利用專業知識和生產經驗,積極運用風險評估和風險管理工具,開展持續的監測和驗證,從而獲得符合預期性能要求的質量可靠的分析方法[9]。基于科學的風險評估和全面的變更研究是分析方法生命周期內迭代更新的基礎。MAH 在進行分析方法的迭代更新研究時,可以參考相關的國內外技術指南,例如國家藥品監督管理局的《已上市生物制品藥學變更研究技術指導原則(試行)》、ICH Q12 的“藥品生命周期管理的技術和監管考慮”、ICH Q14 的“分析方法開發(草案)等[10-11]。生物制品分析方法的迭代變更與產品質量控制密切相關,由 MAH 對分析方法的變更進行風險評估,確定風險等級。MAH 可以參考《已上市生物制品藥學變更研究技術指導原則(試行)》,同時結合分析方法特點和實際變更內容展開風險評估,根據風險等級執行變更研究,按照藥品注冊管理的規定及程序申報補充申請、備案或報告。變更執行后,MAH 仍需持續對分析方法的性能進行監測,收集產品質量相關信息。分析方法變更研究流程示例見圖1。分析方法在產品生命周期內的迭代更新應朝著更加準確、靈敏、穩健、快捷的目標努力,從而保證質量控制體系的先進性和可靠性。MAH應在申報資料中提供變更分析方法的理由和依據。通常導致分析方法更新的理由可能包括企業自身因素和外部因素。企業因素包括提高方法性能、降低檢驗成本、易于操作、加快產品放行、解決供應鏈問題等,或由于對產品的質量屬性有更深人全面的認識而提出更多分析要求(如抗體中的痕量序列變異體[12])。外部因素包括《中華人民共和國藥典》分析方法的升級或為了符合《中華人民共和國藥典》各論要求、上市后批件遺留問題要求、生物類似藥對應的參照藥質量標準或分析方法升級、實驗動物倫理壓力等。MAH 應根據分析方法迭代更新的具體事項、可能后果和不確定性對預期變更進行風險評估,需要考慮的因素通常包括待檢測質量屬性的等級、技術復雜性和變更程度等。不同質量屬性對于產品質量和療效的影響類型和影響程度需要結合潛在臨床影響(有效性、安全性、藥動學和免疫原性)進行進一步風險評估。MAH 可以通過運用不同的風險評估工具,根據產品特定的研究、同類產品/平臺經驗外部文獻知識確定質量屬性等級。通常情況下,某一質量屬性的等級越高,則用于控制該質量屬性的分析方法變更的風險等級越高。基于動物、細胞和免疫化學的活性分析方法與理化分析方法相比,技術復雜性更高、潛在影響因素更多,因而變更風險等級更高。重組蛋白類產品的電荷變異體通常色譜圖的組分峰復雜,某些峰間分離度較差,需要根據酸堿組分進行合并報告,風險等級較高。外觀(顏色、澄清度)和鑒別項目屬于定性的分析方法,如采用藥典方法或成熟的技術時,與其他用于質量控制的定量分析方法相比技術復雜性較低。分析方法在整個生命周期內均可能發生變更,變更可能為同一分析方法內的參數微調和修改,或者完全替換成新的分析方法。耐用性研究中經驗證的參數變更時,或僅在相同分析方法內進行一個或者多個參數的微調時,風險等級較低。藥典方法是經過充分證明、技術成熟且廣泛應用的分析方法,當將藥典中同一檢項下的一個檢測方法變為另一個檢測方法,或者由企業內部分析方法變為藥典方法時,通常風險等級較低,但仍需要進行研究和評估。某一檢測方法從藥典方法變為非藥典方法時,需要謹慎并進行全面合理的研究與評估。新技術更迭如果涉及分析方法原理變更,由于先驗知識和使用經驗的缺乏,在應用初期存在一些不確定性,風險等級較高。MAH 在確定分析方法變更的風險等級后,可參考相關法規和指導原則制定變更研究策略,開展相關研究。分析方法的迭代更新可以從以下方面開展研究:對新方法進行全面的方法學驗證;采用變更前后的分析方法對代表性樣品進行比對分析,從而確定變更前后分析方法的等效性;根據等效性研究結果評估原質量標準檢測項目的可接受范圍是否適用于更新的分析方法;如不再適用,需要重新擬定質量標準。質量標準的擬定可以參考相關文獻、ICH Q6B 和《中華人民共和國藥典》要求[1,6]。MAH 需要提供質量標準擬定依據及擬定過程,證明質量標準制定的合理性。ICH Q14“分析方法開發(草案)提出了一種分析方法變更評價的示例,見表1。生物制品具有復雜的高級結構、翻譯后修飾和糖基化修飾,同時在貯存中容易發生聚集和降解,產生分子大小異構體和電荷異構體[13]。這些變體的存在可能對產品生物學活性、免疫原性及體內代謝產生影響,通常需要采用多種分析手段對生物制品的純度進行控制。隨著分析檢測技術手段的升級,越來越多重現性好、靈敏度高、自動化程度高的分析方法用于替代傳統分析方法,應用于藥物的質量控制,例如采用毛細管凝膠電泳(capillary electrophore-sis-sodium dodecyl sulfate,CE-SDS)替代還原/非還原十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳( sodiumdodeeyl sulfate-polyacrylamide gel eleetrophoresis , SDS-PAGE)控制藥物的分子大小異構體;采用成像毛細管等電聚焦(imaged capillary isoelectric focusing,iCIEF)毛細管等電聚焦電泳(capillary isoelectricfocusing,cIEF)替換定性的等電聚焦(isoelectric fo-cusing,EF)控制藥物的電荷異構體[14-15]。當與純度相關的分析檢測技術手段發生升級時,通常需要對新方法進行完整的方法學驗證,同時對新舊方法的關鍵方法學性參數(如精密度、準確度、檢測限)進行比較,新方法的靈敏度應不低于舊方法。在此案例中,某企業原本采用 IEF 凝膠分析聯用考馬斯亮藍染色法進行原液和成品的放行與穩定性檢測,以控制電荷異質性,但該產品電荷異質體組分復雜,不能準確定量;擬采用較新的cEF平臺技術替代半定量IEF,以便更為準確地定量測量電荷異構體。研究者進行了方法學驗證,包括專屬性準確度、重復性、中間精密度、線性、范圍、定量限、檢測限、耐用性,并考察了方法的穩定性指示作用。cIEF 峰檢測限為 0.3%,相比之下變更前 IEF 凝膠中條帶的檢測限為1%,擬定分析方法實現了定量檢測,靈敏度更高。研究者需要將現行方法與擬定方法比較,同步采用現行方法和擬定方法分析一定批次的代表性樣品,從而確定變更前后分析方法的等效性。純度和異構體檢測項目通常具有穩定性指示意義,研究者可采用新舊分析方法對穩定性留樣或強制破壞樣品進行同步分析。此外,由于擬定分析方法可能對產品異構體的分離能力更好,研究者還應對新分析方法檢測出的異構體組分峰或新的雜質峰進行分離鑒定和表征研究[16-17]。在此案例中,研究者分離不同的電荷異構體組分峰后,采用液質聯用的方法表征蛋白質一級結構和糖類結構,對富集的電荷異構體進行結構表征和生物學活性檢測,結果證明電荷異質性與C末端賴氨酸含量變化、天冬酰胺脫酰胺化和唾液酸修飾有關。在此案例中,先前的原液和制劑質量標準限度范圍不再適用于新的分析方法,研究者可根據代表性原液和制劑的放行數據、長期穩定性數據和分析方法的變異性擬定變更后檢測方法的質量標準。研究者采用了68個原液批次(包括凍存留樣和商業化批次)確立質量標準,分別計算了歷史12個批次和當前 48 個批次的主峰、酸性峰和堿峰的均值±3SD 區間,擬定了原液放行質量標準范圍。申請人應根據實際申報的具體情況(如質量屬性特點、工藝能力、臨床試驗相關性等)選擇合適的統計學方法。在制定成品的放行和貨架期標準時還需要考慮制劑生產和貯存過程中發生的電荷異構體變化。審評機構將根據變更風險要求申請人基于更新的檢定方法及質量標準與中國食品藥品檢定研究院接洽單項復核檢定事宜。綜上,通過對代表性批次樣品的分析和全面的方法學驗證,研究者證明新方法的靈敏度和分離度有顯著提高且具有穩定性指示意義,并對質量標準限度范圍的適用性進行了重新評估,從而保證了質量控制體系的先進性和可靠性。生物制品的工藝相關雜質通常來源于細胞基質、細胞培養或下游工藝,包括宿主細胞蛋白( hostcell protein,HCP)、宿主細胞殘留 DNA、細菌內毒素、色譜配基、工藝添加物等。工藝相關雜質應盡可能在下游純化工藝中去除,以保障患者安全。風險等級較高的工藝相關雜質通常作為常規監測納入原液放行質量標準。殘留 HCP 具有潛在的免疫原性風險,還可導致蛋白聚集、降低最終產品的質量,影響制劑和處方的穩定性[18]。作為工藝相關雜質的控制重點,下文將對 HCP 殘留量分析方法的變更研究進行探討。生物制品的 HCP 殘留量通常采用酶聯免疫吸附測定(enzyme-linked immunosorbent assay, ELISA)進行定量檢測。ELISA 包被板中的多克隆抗HCP抗體決定了測定法的靈敏度和 HCP 覆蓋率。在產品開發初期,研究者通常采用商業化試劑盒進行HCP 殘留量的檢測。進入關鍵性臨床階段以后,研究者將自行開發基于專屬產品和特定工藝的ELISA分析方法。研究者可采用基于凝膠的分析方法(如2D-PAGE/2D-Western blot)或液質聯用( liquid chro-matography-mass spectrometry,LC-MS)分析方法完成新舊方法 HCP 覆蓋率的檢測。關于擬定方法應達到的最小 HCP 覆蓋率,目前監管機構尚未有明確共識,但新分析方法的 HCP 覆蓋率理論上不應低于原分析方法。例如,某企業申請采用新開發的多克隆抗CHOHCP 家免抗體代替原有的山羊抗體進行EISA 分析,從而實現更好的免疫應答。變更試劑盒抗體來源后,試劑盒對較低分子量和堿性殘留蛋白的檢出效率更高,采用 CHO HCP 標準品進行對比研究,原抗體檢測覆蓋率約68%,擬定方法抗體檢測蓋率約95%。申報資料對95個歷史批次分別采用變更前后的檢定方法檢定 HCP,結果顯示相同批次產品的 HCP 水平整體升高,超出原有質量標準限度和行業標準限度。本品僅進行了 HCP 試劑盒更新,生產工藝等其他方面均未發生變更,產品質量無實質變化,更新的檢測試劑盒 HCP 覆蓋率提高,申請人自檢結果與中國食品藥品檢定研究院檢定結果差異較小,基于充分的變更研究和風險評估,認為修訂該技術標準具有較好的科學基礎。需要關注的是,在分析方法變更的同時如伴隨其他變更,不能判斷產品質量是否發生變化時,放寬 HCP 雜質殘留限度有可能增加患者的安全性風險,研究者需要結合人體暴露量、臨床免疫原性和安全性數據、殘留 HCP 的種類和風險等充分評估放寬 HCP質量標準限度的合理性。當前生物制品殘留 HCP含量的控制依然基于可檢測的宿主殘留蛋白總量。考慮到不同產品的純化工藝對 HCP 的清除能力不同,且各種 HCP 的分子大小、結構、可檢測性和安全性風險存在差異如何使新型 HCP 分析方法和控制手段應用于產品質量控制,實現更精準的基于風險的控制,有待監管機構和工業界共同探討。近年來,基于LC/MS 的HCP 檢測方法在鑒別和定量的性能上逐漸超越了常規免疫測定法。LC/MS分析方法可實現不同HCP的分離鑒定和分別定量,從而更好地針對其安全性風險實施控制,在考察下游純化工藝對 HCP 的清除研究以及 HCP 覆蓋率研究中都具有巨大的應用潛力[19-22] 。當 ELISA 方法檢測到總 HCP 水平升高或其他異常的分析檢測情況時,可采用替代方法對個別潛在高風險 HCP 進行針對性的監測。例如,某些特定 HCP 具有降解制劑中關鍵輔料聚山梨酯80的酶活性,從而影響制劑穩定性;可以開發基于酶活性的檢測方法對特定 HCP 進行監測和控制。此外,研發機構在必要時可采用分離的高風險雜質開展進一步的免疫原性評估和毒理學研究,甚至從工程細胞構建的源頭敲除高風險 HCP 相關基因。生物學活性是產品有效性的評估手段,是產品最關鍵的質量屬性之一。生物制品的生物學活性測定應盡可能反映產品的作用機制。生物學活性的分析方法可用于定性鑒別,也可用于定量檢測。結合不同制品的作用機制差異,研發機構可開發體內動物分析、細胞活性、結合活性等多種活性檢測手段,目前胰島素類產品已經可以用色譜法替代動物法但是一些激素類產品(如生長激素、促卵泡激素等)被《中華人民共和國藥典》收錄的生物學活性仍均基于實驗動物,如小鼠、大鼠或家免等[23]。從體內生物測定法變更到體外生物測定法或理化分析法可減少使用實驗室動物,符合國際實驗動物 3R 原則即reduction(減少)、replacement(替代)、refinement(優化)[24-25]。研究者應說明用體外活性方法替代動物法的科學性和合理性,充分證明2種方法的相關性及體外活性測定方法的可行性。在具有充分依據的情況下,研究者可以申請用細胞活性分析方法替代基于動物的分析方法。替代性的體外活性測定可以根據不同產品的作用機制開發,例如通過測試目的蛋白與膜受體結合的效率,或者通過測量目的蛋白刺激培養目標細胞內酶或輔助信使的能力來實現。報告基因法是待測生物制品的刺激反應元件或作用靶標和熒光素酶基因共同轉染生物學活性測定細胞,當樣品與細胞膜上的受體結合后,通過信號轉導激活反應原件,導致熒光素酶的表達激活或抑制,從而在體外可使用光度計進行定量檢測。某企業申請用葡萄糖-6-磷酸酶熒光素酶啟動子系統代替家免實驗檢測胰島素的生物學活性。研究者評估了方法的線性、重復性、中間精密度、準確度、范圍、樣品/標準溶液穩定性和專屬性,結果滿足驗收標準。如果測得的胰島素活性為不低于 15 U·mg-1,則認為按照美國藥典(USPharmacopeia,USP)生物鑒別方法進行的檢測符合要求。細胞受體檢測方法通過與公司參考標準品比較測定了某個樣品的相對效價百分比。研究者進行了方法學比對研究,結果表明在家免實驗中生物鑒別呈陽性的9個批次(2個原料藥生產廠生產的批次)在細胞受體檢測中也呈陽性。監管方認為變更前后方法學比對研究的批次和數據有限,建議在初期采用2種分析方法并行進行原料藥的生物活性分析,積累足夠的放行檢測數據并充分評估2種分析方法的相關性。此外,研究者需要關注變更后原質量標準是否依然適用。體內法通常為定性檢測,而細胞分析方法作為可量化的指標,其標準限度應設定上限和下限。無菌檢測是生物制品放行檢測中的常規安全性檢測項目,通常根據《中華人民共和國藥典》2020 年版通則 1101 無菌檢查法檢測,以確保產品無微生物污染。傳統的微生物檢測方法需要14d的培養時間,由分析人員目視檢查。對于細胞治療等短效期的產品和用于流行病防控的新型疫苗產品,長達2周的微生物檢測時間可能成為制約產品放行和用于患者的限制因素。制藥行業在過去多年間,不斷致力于開發新型可替代的快速微生物檢驗技術。采用快速微生物檢測技術替代傳統微生物檢測手段具有眾多優勢:可加快產品放行、降低生產成本,實現在線監控、保證數據完整性,同時對生產中的潛在污染更快響應。目前應用較廣泛的快速微生物檢測技術主要基于培養微生物獲取信號、直接測量微生物或分析細胞成分原理。常見的快速無菌檢測系統有 MilliflexCelsis Advanc,BacT/Alert,Bactec 等。Celsis 檢測系統和 Milliflex 檢測系統均基于 ATP 生物發光成像系統,BacT/Alert 檢測系統和 Bactec 檢測系統基于對代謝產物CO,的檢測。不同快速微生物檢測系統的分析檢測時間、測試能力、檢測限存在差異[26-28]。《中華人民共和國藥典》、美國藥典和歐洲藥典均收錄了微生物檢驗替代方法驗證的相關指導原則,研究者可以根據微生物檢驗方法的定性或定量差異,開展替代方法的方法學驗證。微生物檢驗替代方法的驗證可參考《中華人民共和國藥典》2020年版三部“藥品微生物檢驗替代方法驗證指導原則”開展。無菌檢查法的替代驗證屬于定性檢查應至少考察快速檢驗分析方法的專屬性、檢測限、重現性和耐用性。微生物限度檢驗的替代驗證屬于定量檢查,應考察快速檢驗方法的準確度、精密度、專屬性、定量限、線性、范圍、重現性、耐用性。研究者還需要開展方法適用性研究,考察制劑是否存在生長抑制或產品干擾。研究者應證明替代方法與藥典分析方法之間的等效性。等效性研究是一種比較試驗,要求使用相同范圍的微生物平行運行2 種方法。根據2種方法所產生數據的統計處理來證明替代方法結果等效或優于(不劣于)藥典方法。如果替代方法產生的結果優于或等效藥典方法,則認為替代無菌檢查的性能等效。快速無菌檢驗替代方法的驗證總結示例見表2。
微生物檢驗替代方法的方法學驗證和等效性研究所涉及菌株至少應包含微生物限度檢查和無菌檢查法規定的藥典菌株,還應根據替代方法及樣品特點增加相應的菌株。《中華人民共和國藥典》中無菌檢查法的實驗菌株包括金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、生孢梭菌、白念珠菌、黑曲霉;非無菌產品微生物限度檢查(微生物計數法)的實驗菌株包括金黃色葡萄球菌、銅綠假單胞菌、枯草芽孢桿菌、白念珠菌、黑曲霉。此外,研究者可根據產品特點增加一些環境常見菌、生長緩慢并難以檢測的菌株、對患者高風險的菌株和挑戰微生物(如饑餓或應激菌株)。研究者應在申報資料中充分評估微生物種類和選擇的合理性,例如,某公司在申請同步采用藥典方法和替代方法用于產品放行的變更時,未納人2種《中華人民共和國藥典》2020 年版要求的實驗菌株,審評機構建議其進行相關補充研究或就未納人相關實驗菌株的合理性予以解釋。考慮到傳統的微生物檢測方法已應用多年,監管方可能建議在應用替代分析方法的初期,同步采用藥典分析方法和替代分析方法進行放行檢測,從而積累足夠批次的數據作為支持。當然,快速替代微生物檢測方法也存在一些缺點,例如資金投入高單一供應商、難以檢測生長緩慢的菌株或某些特定菌株等。為充分保障用藥者的安全,建議申請人根據替代方法的局限性制訂風險應對措施和質量控制策略。分析方法的生命周期管理將在執行變更后持續進行[29]。研究者需要在日常運行中對更新的方法進行持續監測和定期評估,從而確認分析方法的性能符合預期,促進分析方法的持續改進[30]。持續性監測、工藝驗證并積累商業化數據后,研究者還應對質量標準可接受范圍的合理性進一步評估[31]。分析方法在產品生命周期內的迭代更新應保證質量控制體系的先進性和可靠性[7]。MAH 應基于科學和風險的基礎開展支持性研究,用充分的數據和邏輯支持變更。在分析方法發生變更的同時,如果生產物料和生產工藝沒有發生變化,那么產品質量、安全性和有效性并不會發生實質性變化,更新后的分析方法將更有利于反映產品質量的真實狀況,降低檢測能力限制帶來的不確定性,識別質量屬性出現異常的情況。平臺分析方法的上市后變更面臨著多個產品的同步實施。通常情況下,當待測樣品的結構和屬性相近的情況下,用于檢測不同產品的平臺方法的操作條件、系統適用性和報告方式不會發生顯著變化。當執行變更的風險對于類似多個產品相同或相似時,MAH應根據風險進行備案或申報,同類品種已獲準的變更信息可作為平臺分析方法的支持性數據,同時還應開展產品針對性的分析方法研究。對于在多個國家獲批上市的產品,往往面臨著全球監管策略的差異和復雜性,MAH 在執行變更時需要充分了解各個國家/地區監管要求的差異,合理布局和規劃在各個批準國家/地區的申報策略。聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容