CDE網(wǎng)站顯示,9個(gè)品種擬納入突破性療法。
西達(dá)本胺(商品名:愛譜沙/Epidaza)是微芯生物開發(fā)的一款組蛋白去乙酰化酶(HDAC)抑制劑,是唯一可通過口服的亞型選擇性HDAC抑制劑,其對腫瘤抑制性免疫微環(huán)境具有重新激活作用。2014年12月,西達(dá)本胺首次在中國獲批上市,用于既往至少接受過一次全身化療的復(fù)發(fā)或難治的外周T細(xì)胞淋巴瘤(PTCL)患者。后來,西達(dá)本胺在國內(nèi)的適應(yīng)癥又?jǐn)U大至①聯(lián)合芳香化酶抑制劑用于經(jīng)內(nèi)分泌治療復(fù)發(fā)或進(jìn)展的局部晚期或轉(zhuǎn)移性HR+/HER2-絕經(jīng)后乳腺癌患者和②聯(lián)合R-CHOP(利妥昔單抗、環(huán)磷酰胺、阿霉素、長春新堿和強(qiáng)的松)用于MYC和BCL2表達(dá)陽性的既往未經(jīng)治療的彌漫大B細(xì)胞淋巴瘤(DLBCL)患者。此次西達(dá)本胺擬納入突破性療法的適應(yīng)癥為聯(lián)合信迪利單抗和貝伐珠單抗用于既往≥2線標(biāo)準(zhǔn)治療失敗的晚期MSS/pMMR型結(jié)直腸癌患者。在II期CAPability-01研究中,25例MSS/pMMR型結(jié)直腸癌患者接受該三聯(lián)療法治療后,總緩解率(ORR)為44.0%,中位無進(jìn)展生存期(mPFS)為7.3個(gè)月。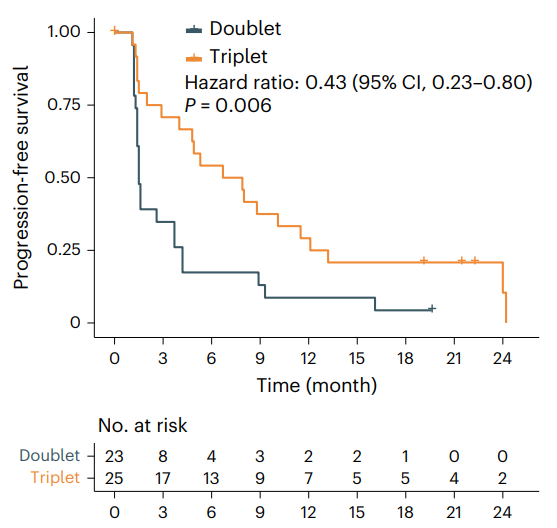
目前,微芯生物的合作伙伴HUYA Bioscience和BMS正在開展西達(dá)本胺聯(lián)合納武利尤單抗一線治療黑色素瘤的全球多中心III期臨床試驗(yàn)。D-1553(格舒瑞昔)是益方生物開發(fā)的一款KRAS G12C抑制劑,也是第二款申報(bào)上市的國產(chǎn)KRAS G12C抑制劑。2023年8月,正大天晴與益方生物簽訂許可與合作協(xié)議,獲得D-1553產(chǎn)品在中國大陸地區(qū)開發(fā)、注冊、生產(chǎn)和商業(yè)化的獨(dú)家許可權(quán)。此次D-1553擬納入突破性療法的適應(yīng)癥為經(jīng)一線治療失敗的伴KRAS G12C突變局部晚期或轉(zhuǎn)移性胰腺導(dǎo)管腺癌患者。I/II期D1553-101研究結(jié)果顯示,10例晚期胰腺癌患者接受治療后,客觀緩解率(ORR)為50.0%,疾病控制率(DCR)為80%,mPFS為8.54個(gè)月。SHR-A1811是恒瑞醫(yī)藥自主研發(fā)的一款HER2 ADC,其可通過與HER2表達(dá)的腫瘤細(xì)胞結(jié)合并內(nèi)吞,在腫瘤細(xì)胞溶酶體內(nèi)通過蛋白酶剪切釋放毒素,誘導(dǎo)細(xì)胞周期阻滯從而誘導(dǎo)腫瘤細(xì)胞凋亡。此次SHR-A1811擬納入突破性療法的適應(yīng)癥為既往至少接受過一種治療方案的HER2+不可切除或轉(zhuǎn)移性膽道癌(BTC)患者。I期研究結(jié)果顯示,15例BTC患者接受治療后,ORR為60.0%。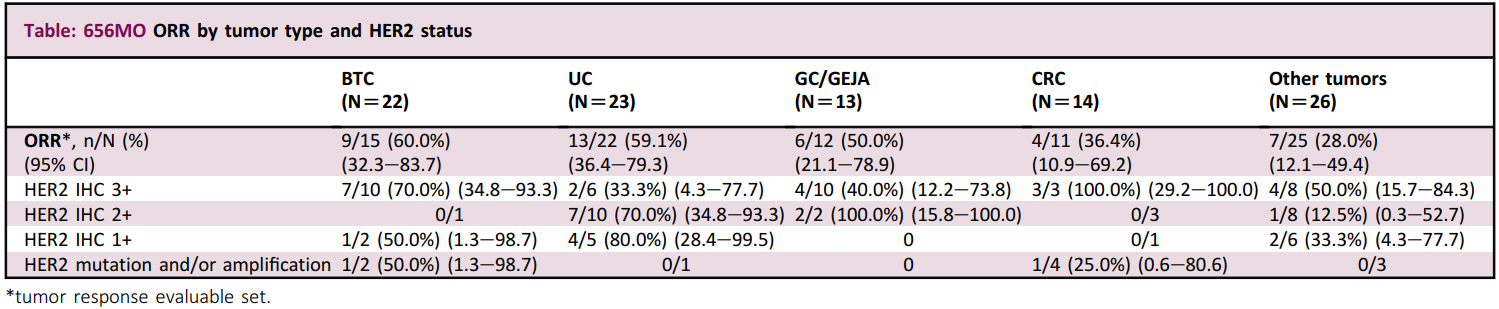
此前,SHR-A1811也多次被納入突破性療法,包括①單藥治療既往含鉑化療失敗的HER2突變的晚期非小細(xì)胞肺癌(NSCLC);②HER2低表達(dá)的復(fù)發(fā)或轉(zhuǎn)移性乳腺癌;③HER2陽性晚期結(jié)直腸癌;④HER2陽性復(fù)發(fā)或轉(zhuǎn)移性乳腺癌;⑤HER2陽性晚期胃癌或胃食管結(jié)合部腺癌。ZVS101e是中因科技開發(fā)的一款用于治療結(jié)晶樣視網(wǎng)膜變性(BCD)的基因療法,于2021年1月首次進(jìn)入臨床階段。BCD是一種特殊類型的視網(wǎng)膜變性,典型改變?yōu)辄S白色閃光結(jié)晶樣物質(zhì)沉積于視網(wǎng)膜,伴有視網(wǎng)膜色素上皮細(xì)胞和脈絡(luò)膜毛細(xì)血管層萎縮,嚴(yán)重危害視力。BCD是工作年齡人群致盲的重要病因,其全球發(fā)病率為1/57600,中國發(fā)病率約為1/25000。該疾病目前尚無有效治療手段。已知80-90%的BCD患者是由CYP4V2基因突變所致,ZVS101e主要通過rAAV病毒將正常的CYP4V2基因拷貝攜帶到患者視網(wǎng)膜細(xì)胞中,補(bǔ)充視網(wǎng)膜細(xì)胞中正常CYP4V2基因的表達(dá)量,恢復(fù)視網(wǎng)膜細(xì)胞功能,以達(dá)到治療的目的。此次ZVS101e擬納入突破性療法的適應(yīng)癥即為BCD。I期研究結(jié)果顯示,12例BCD患者接受治療一年后,最佳矯正視力(BCVA)提高了11個(gè)字母。
BAY 2927088是拜耳開發(fā)的一款口服可逆酪氨酸激酶抑制劑,于2021年10月首次啟動I期臨床試驗(yàn)。此次BAY 2927088片和BAY 2927088溶液擬納入突破性療法的適應(yīng)癥為攜帶HER2(ERBB2)激活突變且既往接受過一種全身性治療的不可切除或轉(zhuǎn)移性NSCLC。I期研究結(jié)果顯示,69例NSCLC患者接受治療后,整體ORR為26.0%,其中攜帶HER2 exon 20突變的人群的ORR為60.0%。奧希替尼是阿斯利康開發(fā)的一種不可逆的第三代EGFR-TKI,具有抗CNS轉(zhuǎn)移的臨床活性。2015年11月,奧希替尼首次在美國獲批上市。截至目前,該藥物在美國已獲批4項(xiàng)適應(yīng)癥:此次奧希替尼擬納入突破性療法的適應(yīng)癥為在接受含鉑根治性放化療后未出現(xiàn)疾病進(jìn)展、具有Ex19del或外顯子21(L858R)置換突變的局部晚期不可切除III期NSCLC患者。在III期LAURA研究中,143例NSCLC患者接受治療后,PFS達(dá)到了39.1個(gè)月,疾病進(jìn)展風(fēng)險(xiǎn)降低了84%。Lorlatinib(洛拉替尼)是輝瑞和基石藥業(yè)合作開發(fā)的一款ROS1/ALK抑制劑,于2018年9月首次在日本獲批上市。2022年4月,該藥物在中國獲批上市,用于治療ALK陽性的局部晚期或轉(zhuǎn)移性NSCLC患者。此次Lorlatinib擬納入突破性療法的適應(yīng)癥為經(jīng)克唑替尼和含鉑化療治療后的局部晚期或轉(zhuǎn)移性ROS1陽性NSCLC患者。一項(xiàng)II期研究結(jié)果顯示,32例ROS1陽性NSCLC患者接受治療后,ORR為69%,PFS為35.8個(gè)月。經(jīng)治和初診患者亞組的ORR分別為46%和81%。Telisotuzumab vedotin是艾伯維開發(fā)的一款靶向c-Met的first-in-class ADC,由抗c-Met人源化單抗ABT-700通過纈氨酸-瓜氨酸連接子偶聯(lián)于細(xì)胞毒素單甲基澳瑞他汀E(MMAE)構(gòu)成。此次Telisotuzumab vedotin擬納入突破性療法的適應(yīng)癥為在鉑類藥物治療期間或治療后發(fā)生疾病進(jìn)展的c-Met蛋白高表達(dá)晚期/轉(zhuǎn)移EGFR野生型非鱗狀非NSCLC患者。II期LUMINOSITY研究結(jié)果顯示,172例NSCLC患者接受治療后,整體人群的ORR為28.6%,緩解持續(xù)時(shí)間(DOR)為8.3個(gè)月;c-Met中表達(dá)和c-Met高表達(dá)人群的ORR分別為22.9%和34.6%,DOR分別為7.2個(gè)月和9.0個(gè)月。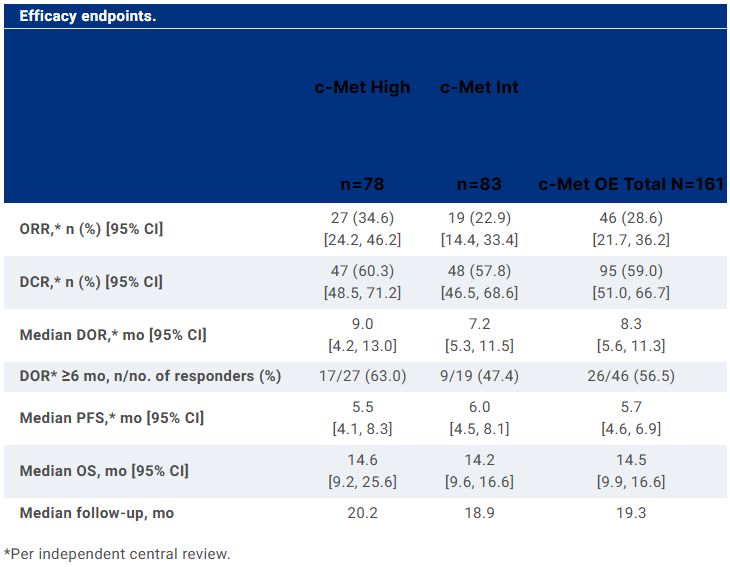 來源:ASCO 2024大會目前,全球尚無c-Met ADC獲批上市,而Telisotuzumab vedotin是在研藥物中開發(fā)進(jìn)度最快的c-Met ADC。
來源:ASCO 2024大會目前,全球尚無c-Met ADC獲批上市,而Telisotuzumab vedotin是在研藥物中開發(fā)進(jìn)度最快的c-Met ADC。聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點(diǎn)。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時(shí)間刪除內(nèi)容




 來源:ASCO 2024大會
來源:ASCO 2024大會