
2024-05-20 00:00:00來源:微譜醫藥技術服務瀏覽量:183
2024年5月17日,微譜正式收到來自美國食品藥品監督管理局(FDA)的函件通知和現場檢查報告,圓滿通過FDA現場檢查。這標志微譜醫藥實驗室質量管理體系經FDA確認滿足美國市場申報需要的GMP及相關法規要求,可持續為全球醫藥企業提供符合中美雙報的項目報告。
常態化合規,高質量運營。目前,微譜著力打造的近30000㎡醫藥實驗室正以滿足NMPA、FDA、EMA、WHO等國家和區域的監管要求為基本準則,持續助力海內外醫藥客戶高效推進中外多報項目的國際化進程!

▲?圖源?| FDA官網

▲?圖?| 微譜醫藥實驗室
此次順利通過FDA現場檢查,不僅表明了微譜醫藥實驗室可以滿足FDA?cGMP質量管理體系的要求,更進一步證明了微譜早已擁有為醫藥企業持續提供中美雙報項目報告的體系化專業能力。伴隨更多醫藥企業加快國際化戰略布局的腳步,微譜將持續打造滿足NMPA、FDA、EMA、WHO等國家和區域的監管要求的服務平臺,全速助力客戶產品高效推進中美歐等項目多報。
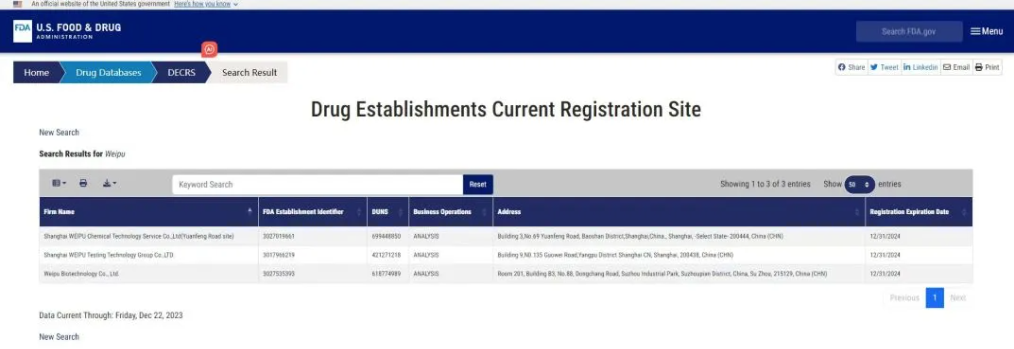
▲微譜醫藥實驗室FDA備案2024版丨圖源:FDA官網