上期文章中,鼎泰集團對第3款已上市 siRNA 藥物 —— Lumasiran(Oxlumo?,點擊查看原文) 的臨床開發路徑進行了復盤分析。可以看出, Lumasiran 之所以能在2個年齡段的人群中同時快速獲批,離不開科學合理的臨床試驗設計和周密的臨床研究規劃:
- 在 Ⅰ/Ⅱ 期臨床試驗中同時納入了健康受試者和 PH1 患者。健康受試者的數據為 PH1 患者的給藥劑量和給藥間隔設計提供了依據;
- Ⅱ 期 OLE 試驗無縫銜接 Ⅰ/Ⅱ 期,將 Ⅰ/Ⅱ 期中納入的 PH1 患者繼續納入研究,開展更長周期的試驗;
- 2項 Ⅲ 期試驗分別在6歲及以上患者、6歲以下嬰幼兒患者中進行。在試驗未完全結束時(僅提供初始6個月的數據),即獲得上市批準。
本期內容將介紹助力 Lumasiran 快速上市的另一個重要因素 —— 與監管機構的良好互動、備受關注的臨床生物分析、臨床與非臨床相關性評估等。這些因素為 siRNA 藥物如何運用臨床前研究結果指導臨床開發,以及全局視角優化研發策略提供了參考和啟發。
| |
| |
| 臨床開發路徑 關鍵詞:I/II 期無縫隙設計;2項關鍵III期 |
| 監管互動里程碑 關鍵詞:EOP2;幼齡動物研究;致癌性研究 |
| |
| |
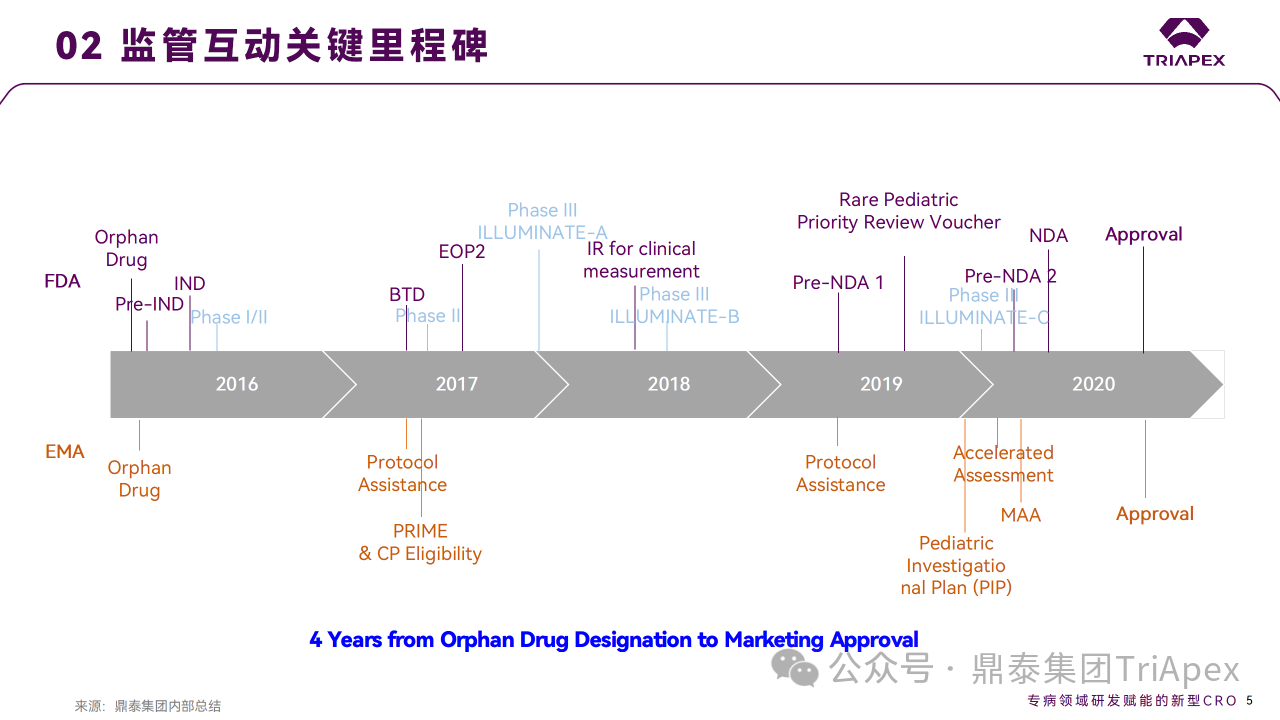
在 2018 年 4 月 26 日召開的 EOP2 會議上, Alnylam 主要就非臨床和臨床藥理開發計劃與 FDA 進行溝通。2018 年 2 月 23 日獲得 BTD 認定,本次會議也作為首次 BTD 后會議。

幼齡動物研究:
FDA 同意鑒于已進行的包含 TK 評估和標準的組織病理學評估的 pilot neonate-juvenile study (PND 4~PND 32 給藥,約為從新生兒到約6歲的人類年齡human equivalent age from newborn to approximately 6 years of age,劑量為0、10、30、100 mg/kg)和 8 周重復給藥毒性試驗中均未發現任何重大不良反應,且幼鼠的 PK/PD 特征與成年大鼠相似,申請人無需開展進一步的非臨床研究以支持 6 歲以下兒科患者給藥和 NDA 提交。值得一提的是,EMA 在 summary of product characteristics 中指出,對于1歲以下的患者,可獲得的數據有限,因此在治療這些患者時應謹慎。

致癌性試驗:
申請人基于對文獻和現有數據的評估,認為預期的作用機制(抑制 HAO1 mRNA)不存在致癌性方面的擔憂,申請在獲批上市后完成致癌性研究。FDA 認為該產品并不是完全不存在潛在的致癌性風險,可能的因素包括對 HAO1 mRNA 的抑制和/或 siRNA 的脫靶或非特異性效應,特別是在長時間給藥的情況下。因此,在對 CAD(carcinogenicity assessment document) 進行審查之前,應提交致癌性研究方案并獲得同意,并在提交 NDA 之前啟動研究。
臨床藥理:
FDA 同意可不在非 PH1 患者中進行 DDI 研究、人類放射性標記 PK 研究、專門的肝功能和腎功能損傷患者的研究。需要提交相關文件(如 SAP、IB、方案、CRF、SAS 等)以評估是否需要進行 TQT 研究。

在 pre-NDA2 會議中, FDA 就上市后 CMC 變更(在提交給 NDA 的原始文件中包含可比性 protocol )相關問題、擬提交的 clinical data package 是否足以支持 Lumasiran 用于成人和兒童 PH1 治療等問題給出回復。
在前述所有的臨床試驗中都采用經驗證的 ELISA 法檢測血清中抗 Lumasiran 的 ADA,評價免疫原性。該方法檢測針對 Lumasiran DS(即雙鏈 GalNac-siRNA,包含 GalNAc 元件和 linker) 的 ADA。在 Lumasiran 的所有臨床研究中,包括 PH1 患者和健康受試者,共6/100 (6%)檢測出 ADA 陽性。ADA 最早在 D29 出現,但滴度較低,均為一過性。比較了 ADA 陽性和陰性 PH1 患者尿液和血漿草酸水平以及健康受試者血漿乙醇酸水平。Lumasiran 的安全性、藥代動力學和藥效學指標未見有臨床意義的顯著差異,因此未對 ADA 的中和活性進行檢測。上述結果表明,Lumasiran 具有較低的免疫原性,且不會對療效和安全性產生影響。
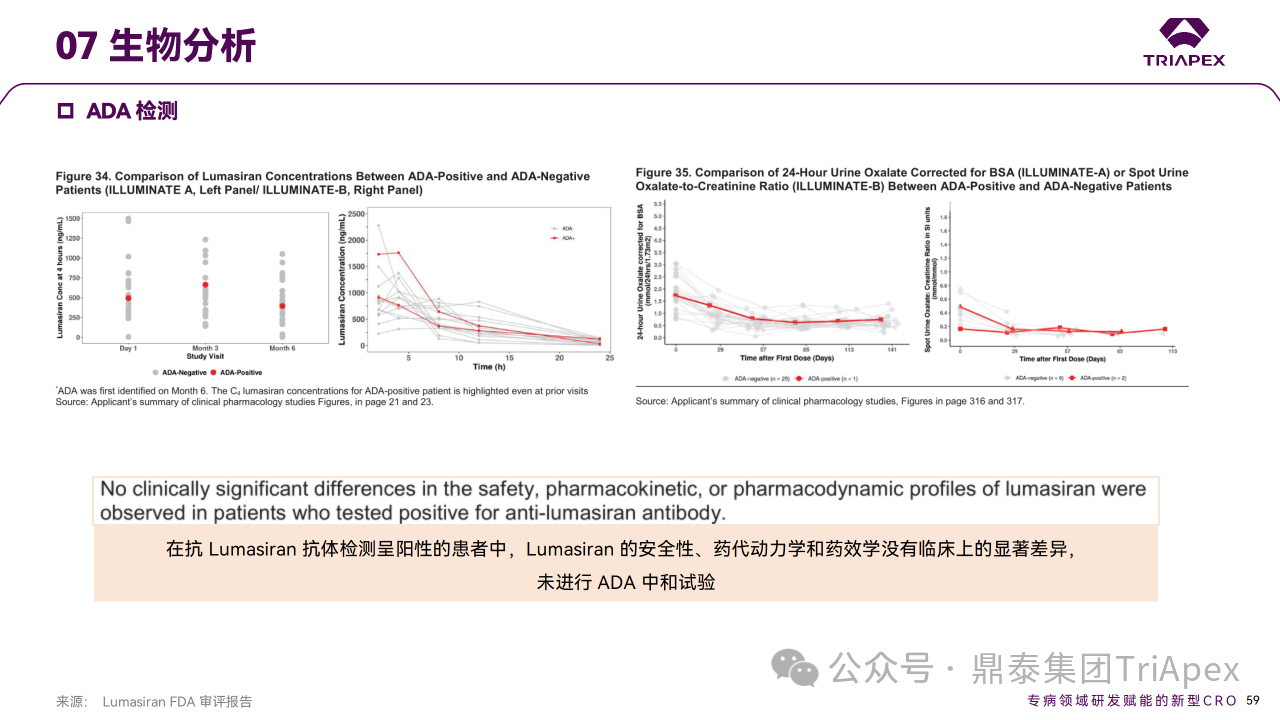
免疫原性檢測方法和結果
Lumasiran 主要經核酸外切酶或內切酶進行降解。體外試驗顯示,Lumasiran 在大鼠、猴和人中均較穩定, AS(N-1)3′ 是主要代謝產物。通過分析給藥后人的血漿和尿液(來源于臨床研究 ALN-GO1-001),評價了 Lumasiran 在人體內的代謝情況。結果表明,尿液和血漿中主要代謝產物 AS(N-1)3’ 的比例<10%。筆者對上述試驗所采用的生物分析方法進行了調研,檢測方法為 LC-TOF-MS 法,分離方法為 SPE ,最低檢出濃度為10 ng/mL,待測物包括 Lumasiran AS/SS 和代謝物。針對 siRNA 原形和代謝產物的檢測,鼎泰集團內部已建立穩健的 SPE 和 LLE 分離手段、LC-MS/MS 檢測方法,且具有更高的靈敏度。
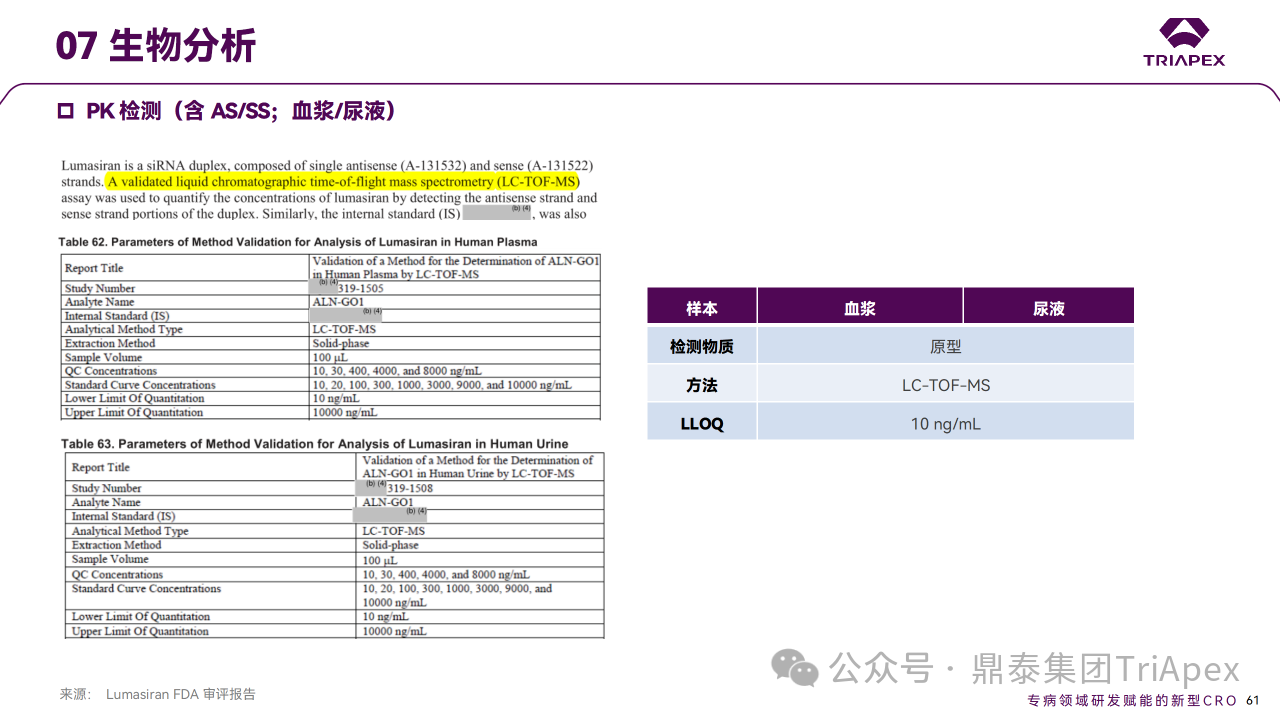
藥代動力學檢測方法學主要參數
非臨床研究的結果可以為臨床試驗的設計提供重要的依據,能夠給臨床試驗帶來參考和指導。此外,非臨床研究還可以發現潛在的藥物不良反應,為臨床試驗的安全性和有效性提供保障。
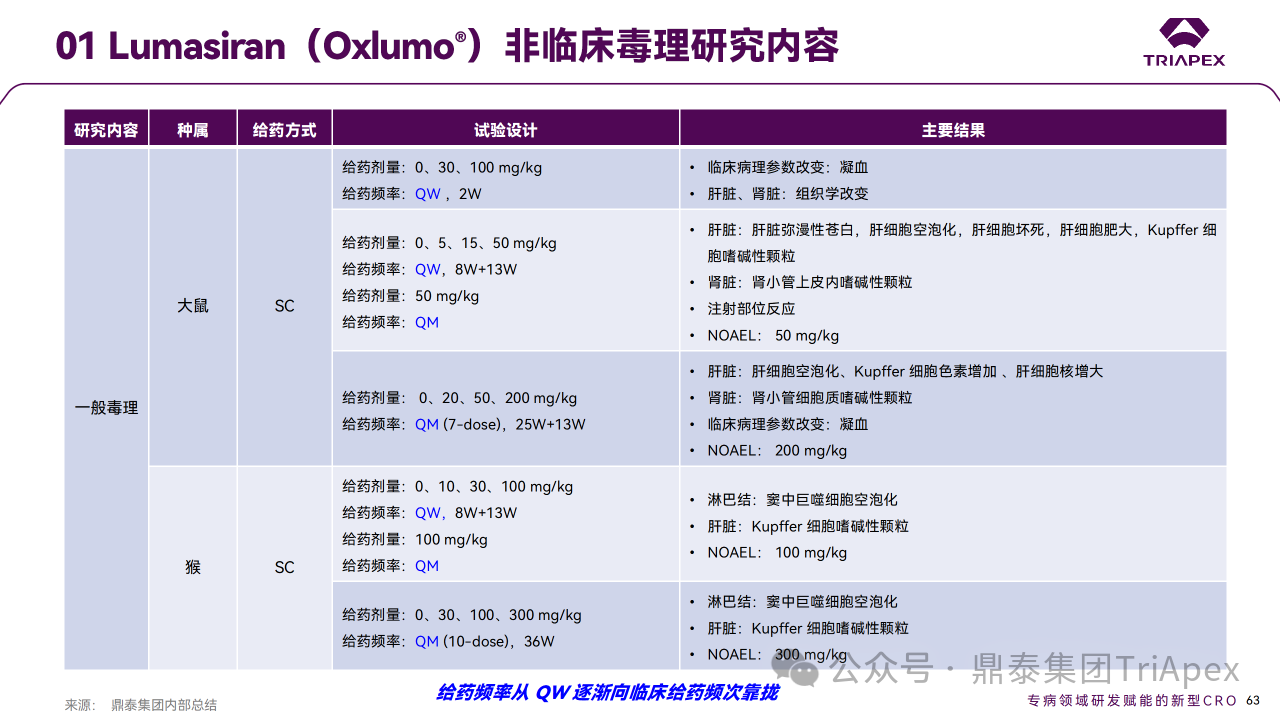

非臨床研究與臨床試驗 PD marker 相關性分析
非臨床藥效學和毒理學研究結果為 FIH 提供了劑量設計依據。① NHP 中,1 mg/kg 顯示中度肝臟 HAO1 mRNA 沉默,尿乙醇酸也相應升高,預期0.3 mg/kg 在人體中有低水平的藥理學活性;② 根據 BSA 轉換,無論 QW 還是 Q4W 給藥,大鼠和 NHP 的 NOAEL 相對于該起始劑量的安全窗分別為 26.7 倍和 106.7 倍。
在非臨床毒理學發現的 AE 可能預示藥物在臨床使用中會出現類似反應。在 Lumasiran 非臨床中發現的注射部位反應在臨床上也有表現。非臨床試驗數據和臨床反應相結合,全面評估藥物的安全性和風險。

Lumasiran 作為 FDA 批準的首款兒科用藥的 siRNA 藥物,縱觀其上市歷程和臨床開發路徑不難發現:與 FDA 的良好溝通互動,以及卓越的臨床研究策略對于加快臨床轉化和推動產品上市至關重要。借助高效的藥政策略,Alnylam 與 FDA 就產品上市歷程中的關鍵問題進行了充分的溝通,并獲得了 FDA 的認同和支持(如延后致癌性試驗的完成時間、減少正式的幼齡動物研究),以及積極的開發建議。巧妙的臨床研究規劃既節省了患者數量(罕見病),又使得各項試驗無縫隙銜接。此外,來自非臨床研究積累的轉化醫學證據也為臨床試驗的設計提供了重要的參考,如起始劑量和給藥間隔的設定、有助于提示療效和/或毒性且可監測的生物標志物等。綜上,Lumasiran 的成功經驗為 siRNA 藥物的研發提供了寶貴的借鑒,如重視與監管機構的溝通、優化臨床試驗設計、充分利用非臨床研究結果指導臨床等。這些策略和做法也為后續 siRNA 藥物的研發提供了寶貴的經驗和啟示。
[1] Lumasiran: First Approval
[2] US FDA. FDA approves first drug to treat rare metabolic disor-der. 2020.
[3] US FDA. 214103Orig1s000, ADMINISTRATIVE and CORRESPONDENCE DOCUMENTS.
[4] US FDA. 214103Orig1s000, INTEGRATED REVIEW.
[5] European Medicines Agency. Oxlumo 94.5 mg/0.5 mL, solution for injection: summary of product characteristics. 2020.
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容
