
2024-05-13 00:00:00來源:陶術生物瀏覽量:404
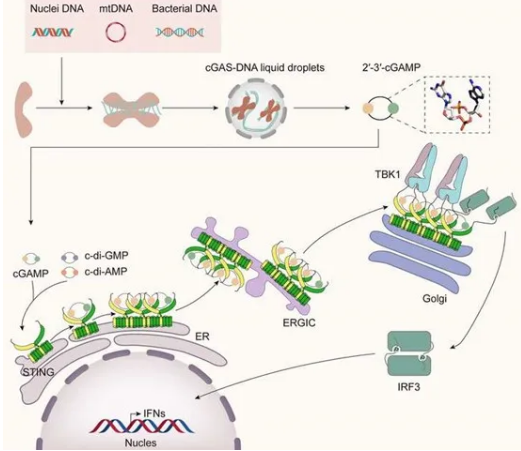
干擾素基因刺激因子(STING)通路是一個關鍵的DNA感應過程,可誘導對微生物和基因的先天免疫。STING位于內質網(ER)的膜上,含有379個氨基酸,包括4個跨膜螺旋和一個延伸到細胞質的球形C端結構域(CTD)。STING作為一種細胞內識別受體,通過激活cGAS-STING信號通路,在調節許多保衛基因的轉錄中發揮重要作用。自2008年STING的發現以來,大量研究已經仔細分析了STING的結構,形成了一個優雅的STING激活模型,在這個模型中,cGAMP結合后,STING向內旋轉至配體結合口袋,關閉其配體結合口袋,并釋放其C-末端以招募TBK1和IRF3。2013年,發現了cGAS在哺乳動物細胞中的存在,并揭示其合成cGAMP作為第二信使直接激活STING的能力。此后,cGAS-STING通路被發現廣泛參與各種生理和病理過程。
 ?
?
cGAS-STING通路
cGAS
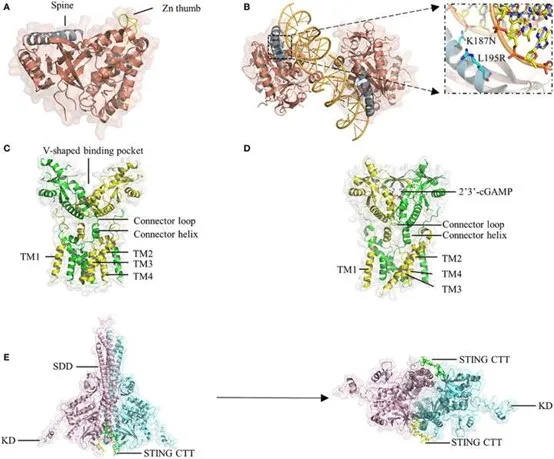
cGAS屬于結構上保守的cGAS/DncV樣核苷酸轉移酶(CD-NTase)超家族,包括一個N-末端結構域和一個C-末端催化結構域。催化結構域包括NTase核心和Mab21結構域,并采用一個雙葉狀結構,包括一個中央催化結構域和兩個不同的帶正電表面。催化結構域的N-末端有一條長螺旋"脊柱",連接N-末端葉狀結構,具有NTase折疊,以及C-末端葉狀結構,其中包含一個緊密的螺旋束。cGAS的兩個葉狀結構之間的深槽的邊緣是催化位點。一旦cGAS的帶正電的表面以一種與序列無關的方式與dsDNA相互作用,就會發生顯著的結構切換,使cGAS的催化口被重新排列以啟動三磷酸鳥苷(GTP)和三磷酸腺苷(ATP)的環化過程。
STING
作為適配蛋白,STING是先天免疫應答信號級聯的核心組成部分。這個小蛋白(約40 kDa)由一個包含四個跨膜螺旋(TM1-4)的N-末端部分錨定在ER膜上。STING的C-末端結構(CTD)包括一個配體結合結構域(LBD),負責與2’3’-cGAMP和CDNs結合,以及一個能夠結合TBK1的C-末端尾巴(CTT),兩者都面向細胞質。STING在無配體狀態下存在為二聚體,通過組織八個跨膜螺旋和兩個CTD采用了一個領域交換的架構。在二聚體的TM結構中,一個層是由TM2和TM4形成的中央層,另一個層是由TM1和TM3組成的外層。LBD結構域包含五個β鏈和四個α螺旋,其中α螺旋1通過連接螺旋(殘基141-149)和連接環(殘基150-156)與TM4相連。兩個STING CTD主要通過疏水相互作用發生二聚化,形成一個V形的結合口袋。在cGAMP結合時,STING的配體結合口袋上形成一個四鏈β-片狀的蓋子狀結構,將cGAMP牢牢地固定住;這被描述為“封閉”構象。
 ?
?
cGAS、STING的晶體結構
cGAS-STING通路的激活
病原體感染、自身DNA損傷和腫瘤DNA是引起cGAS-STING信號激活的三個關鍵因素。大多數DNA病毒,如人類巨細胞病毒(HCMV)、單純皰疹病毒1型(HSV-1)(14)和乙型肝炎病毒,都能激活cGAS/STING途徑并啟動抗病毒免疫應答。登革熱RNA病毒也已被證實能誘導感染細胞線粒體DNA(mtDNA)在細胞質中暴露,從而誘導cGAS-STING信號。還有研究表明,在慢性STING激活的條件下,癌細胞中高水平的ISG表達可能使腫瘤處于一種轉錄狀態,用于應對由于傳感器水平增加導致的異常dsRNA積累,這表明cGAS可能作為dsRNA的間接傳感器并發揮抗腫瘤作用。當cGAS檢測到各種來源的dsDNA(例如病毒、細菌DNA,線粒體DNA等)時,它被激活并通過一系列催化反應和構象變化催化2′3′-cGAMP的形成。這些反應可分為兩個步驟:在第一步中,cGAS使用三磷酸腺苷(ATP)和三磷酸鳥苷(GTP)作為前體,并將ATP移動到GTP的2′-OH位置以生成線性異二核苷酸磷酸pppG(2′–5′)pA,作為第二步的基礎材料;第二步中,cGAS將GTP轉移到腺苷酸磷酸的3′-OH,最終生成cGAMP。cGAS的激活在轉錄水平上不受調控,而是在翻譯后水平上被修飾,涉及泛素化、乙酰化、磷酸化和由半胱氨酸酶剪切。這些修飾通過不同的機制調節cGAS的活性。cGAS-STING途徑的下游信號控制干擾素(IFN)和NF-κB(驅動炎癥基因表達,包括細胞因子和趨化因子)的表達,并促進炎癥分子的活化。激活的IFN可以導致數百種干擾素刺激基因(ISG)的上調,進而促使數種炎癥細胞因子的分泌。這些物質可以限制病毒復制并誘導細胞凋亡。
臨床開發中的STING激動劑
在臨床前廣泛使用的最顯著的STING激動劑是?DMXAA,這是一種以血管破壞為特點的藥物,被認為具有抗腫瘤活性。在一項隨機的II期臨床試驗中,評估了將DMXAA添加到紫杉醇和卡鉑的標準治療方案中對于未曾接受治療的晚期非小細胞肺癌患者的可行性和安全性。結果顯示DMXAA耐受性良好。在后續的一項更大的III期隨機試驗中,該試驗評估了在晚期非小細胞肺癌患者中,紫杉醇和卡鉑與或不與DMXAA聯合治療的療效,DMXAA處理組與安慰劑組在總生存和無進展生存方面沒有觀察到差異,導致在中期分析期間由于缺乏療效而終止了試驗。這與使用小鼠模型進行的臨床前研究相反,在這些研究中,DMXAA的腫瘤內注射被證明能夠引發強有力的抗腫瘤免疫應答。后續對DMXAA功能的詳細研究表明,盡管DMXAA是小鼠STING的直接配體,但人STING蛋白的多態性導致DMXAA無法結合,使其在人體中無效。隨后的工作重點轉向開發合成激動劑化合物,這些化合物具有改進的穩定性和較低的酶降解敏感性,能夠結合人STING的所有已知等位基因。
![]() ?
?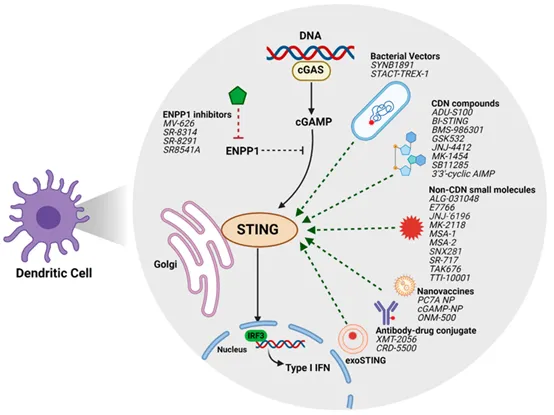
正在開發的新型STING激動劑
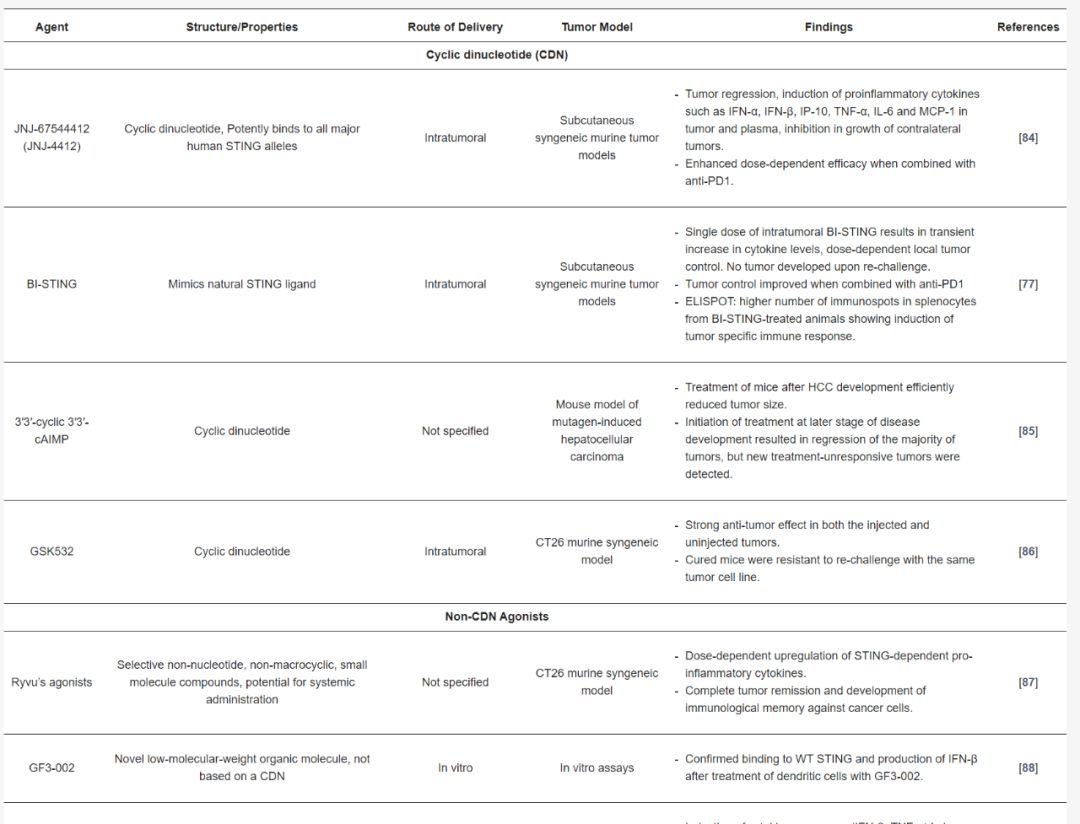
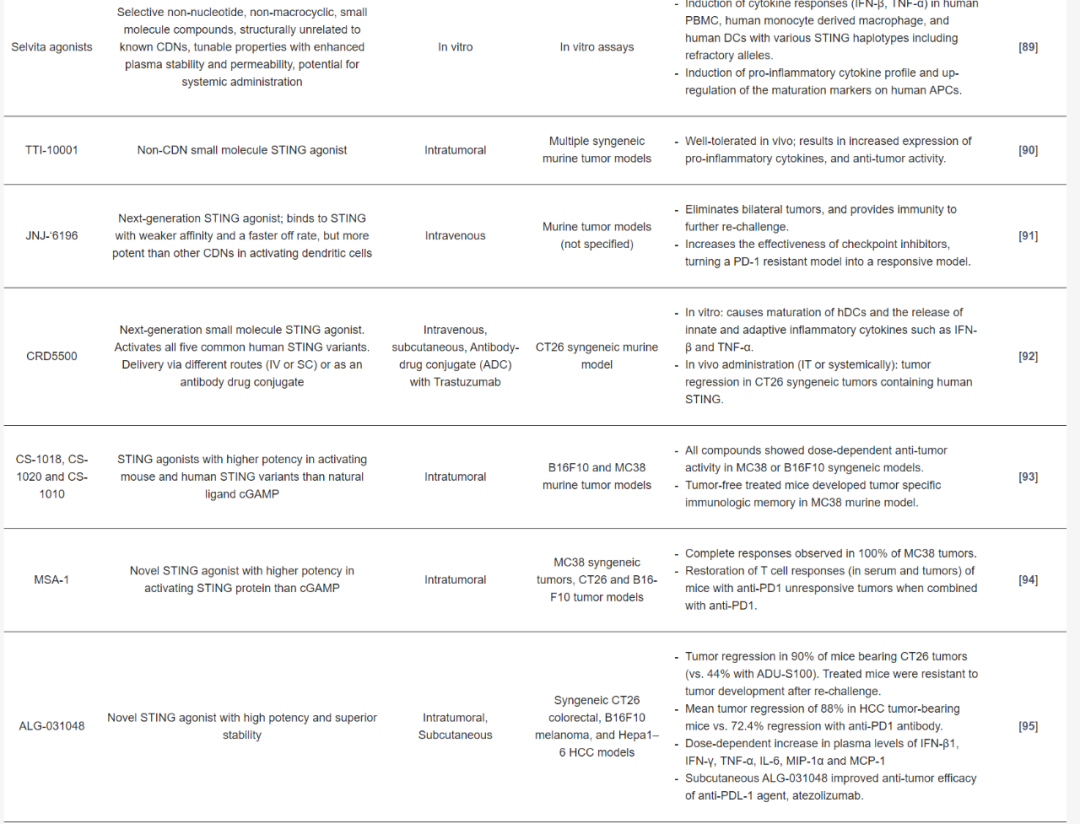
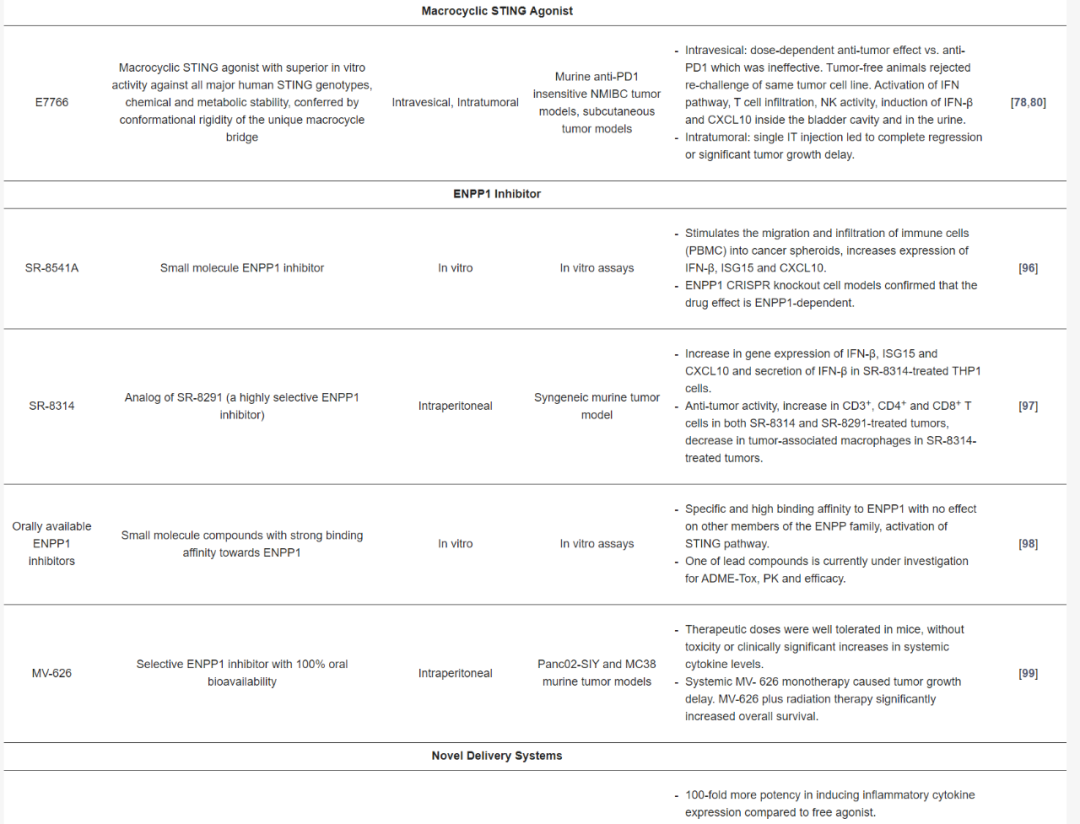
STING激動劑在臨床前評估中的應用
許多臨床開發的STING激動劑的化學結構和穩定性限制了它們作為全身免疫治療的使用。在過去幾年中,已經鑒定出一些具有改進結構特性、更高效力和與人STING親和力更強的新型環狀CDN和非CDN STING激動劑化合物,并在臨床前研究中展現出有希望的結果。
?
 ?
?
 ?
?
 ?
?
 ?
?
小結
cGAS-STING信號通路是細胞質DNA感應的重要過程,在調控病原體感染、腫瘤免疫和自身免疫性疾病中具有關鍵作用。cGAS-STING通路的激活可以誘導I型IFNs和其他細胞因子的表達,并將信號傳導到細胞核,這使得cGAS-STING通路成為癌癥免疫治療的有前途的靶點。自STING的最初發現以及在臨床前環境中激活該通路的效力后,科學家們正在加速STING激動劑的開發進程。人體自身免疫表型(SAVI)的存在和不斷增多的臨床前和臨床研究支持多種STING激動劑化合物在增強抗腫瘤免疫和提高現有免疫療法效果方面的潛力。盡管如此,對于臨床靶向cGAS-STING通路仍存在重大障礙。目前正在進行大量研究,以開發具有改進特性、穩定性適合全身輸送的化合物。
?
參考文獻:[1]Amouzegar A, Chelvanambi M, Filderman JN, Storkus WJ, Luke JJ. STING Agonists as Cancer Therapeutics. Cancers (Basel). 2021;13(11):2695. Published 2021 May 30. doi:10.3390/cancers13112695[2]Luo K, Li N, Ye W, Gao H, Luo X, Cheng B. Activation of Stimulation of Interferon Genes (STING) Signal and Cancer Immunotherapy. Molecules. 2022;27(14):4638. Published 2022 Jul 20. doi:10.3390/molecules27144638[3]Liu N, Pang X, Zhang H, Ji P. The cGAS-STING Pathway in Bacterial Infection and Bacterial Immunity. Front Immunol. 2022;12:814709. Published 2022 Jan 13. doi:10.3389/fimmu.2021.814709[4]Gan Y, Li X, Han S, et al. The cGAS/STING?Pathway: A Novel Target for Cancer Therapy. Front Immunol. 2022;12:795401. Published 2022 Jan 3. doi:10.3389/fimmu.2021.795401[5]Huang C, Shao N, Huang Y, et al. Overcoming challenges in the delivery of STING agonists for cancer immunotherapy: A comprehensive review of strategies and future perspectives. Mater Today Bio. 2023;23:100839. Published 2023 Oct 21. doi:10.1016/j.mtbio.2023.100839