在他山之石系列文章-1中,鼎泰集團(tuán)對第1款 siRNA 藥物 Patisiran(Onpattro?)的上市歷程及臨床開發(fā)路徑進(jìn)行了復(fù)盤分析(點擊查看原文),為我們清晰、全面地呈現(xiàn)了一款 siRNA 藥物如何從非臨床向臨床轉(zhuǎn)化,以及借助無縫銜接的臨床研發(fā)策略在 IND 后的短短 6 年內(nèi)獲批上市的經(jīng)典案例。
在他山之石系列文章-2中,在對第2款已上市siRNA 藥物 — Givosiran(Givlaari?) 的上市歷程及臨床開發(fā)路徑進(jìn)行復(fù)盤分析的同時,增加了更多與臨床轉(zhuǎn)化有關(guān)的內(nèi)容,以期為指導(dǎo) siRNA 藥物的非臨床研究、運用臨床前研究結(jié)果支持臨床開發(fā),以及全局視角的研發(fā)策略的制定提供參考和啟發(fā)。
推文發(fā)出后,很多熱心專家和老師在后臺積極互動,并提出了許多寶貴的意見和建議,這激勵我們團(tuán)隊有必要對前期內(nèi)容進(jìn)行進(jìn)一步的補(bǔ)充和改進(jìn)。在此,鼎泰團(tuán)隊特別感謝關(guān)注我們成長和努力的朋友們和老師們。
本次更新的內(nèi)容主要包括:進(jìn)一步細(xì)化了FIH 起始劑量的設(shè)計依據(jù),補(bǔ)充了代謝產(chǎn)物評估以及藥代動力學(xué)和免疫原性檢測相關(guān)的內(nèi)容。
Givosiran是由 Alnylam Pharmaceuticals 開發(fā)的首個 GalNAc 偶聯(lián)的 siRNA 藥物(GalNac-siRNA),能夠特異性遞送至肝臟細(xì)胞并靶向降解編碼ALAS1蛋白的 mRNA,從而降低神經(jīng)毒性前體 δ -氨基乙酰丙酸(ALA)和膽色素原(PBG)的水平,減少疾病發(fā)作[1]。
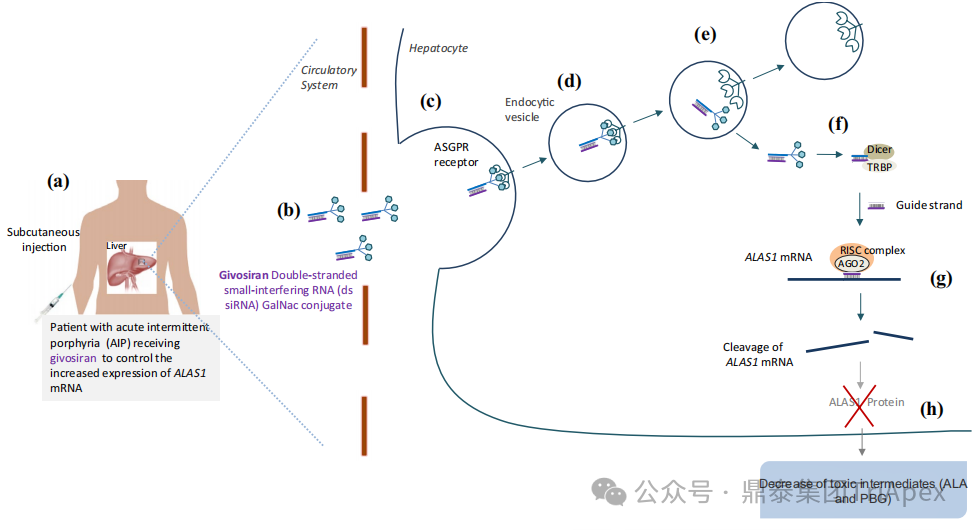
2015年8月13日,Givosiran 向FDA提交了首個IND申請。2019年11月20日,在提交NDA申請后的不足4個月(比預(yù)期的PUDUFA時間提前了近3個月)內(nèi)即獲得FDA批準(zhǔn)用于治療成人急性肝卟啉癥(AHP)。然后分別于2020年3月2日和2021年6月23日獲得 EMA 和 PMDA 批準(zhǔn)上市。該適應(yīng)癥的批準(zhǔn)是基于關(guān)鍵性III 期臨床試驗(NCT03338816,代號ENVISION)的積極結(jié)果。Givosiran的成功上市不僅為AHP患者帶來了新的治療選擇,也為RNAi技術(shù)在治療罕見疾病領(lǐng)域的應(yīng)用提供了新的范例。
AHP 是由于血紅素生物合成途徑中第3個[表現(xiàn)為急性間歇性肝卟啉癥(AIP)]、第6個[家族性卟啉原卟啉酸尿癥(HCP)]或第7個[變異卟啉病(VP)]酶的常染色體顯性失活,或在非常罕見的情況下,由常染色體隱性遺傳導(dǎo)致的一種罕見、嚴(yán)重、可能危及生命的遺傳性疾病。這些染色體的異常變化導(dǎo)致 ALA 和 PBG 的積累,進(jìn)而導(dǎo)致急性卟啉癥發(fā)作,主要表現(xiàn)為腦脊髓與交感神經(jīng)系統(tǒng)的癥狀,如腹痛(主要癥狀)、急性神經(jīng)病變等。大多數(shù)有癥狀的患者在其一生中很少發(fā)作,然而,也有8 %的患者會出現(xiàn)病情加重,反復(fù)發(fā)作(≥ 4次/年)。最常見的急性肝卟啉癥是 AIP,其患病率估計為5.4 /百萬人。靜脈注射血紅素是當(dāng)時歐盟和美國推薦的用于 AHP 急性發(fā)作的治療方案。然而,使用血紅素治療還有諸多限制,除了在水溶液中不穩(wěn)定外,還包括重復(fù)給藥可能引起的潛在毒性,如靜脈血栓性靜脈炎、速效耐藥性、凝血異常和繼發(fā)性鐵負(fù)荷等。因此,迫切需要更加安全、有效的治療方案來應(yīng)對急性肝卟啉癥的發(fā)作并減少長期并發(fā)癥。
無縫銜接、駕輕就熟的臨床開發(fā)路徑是 Givosiran 成功上市的重要支撐。1項I期劑量/給藥頻率探索試驗、1項無縫銜接的I/II 期開放標(biāo)簽擴(kuò)展(OLE)試驗和1項III期關(guān)鍵性臨床試驗為 Givosiran 的NDA申請和獲批上市提供了充分的臨床數(shù)據(jù)支持。

Ⅰ 期臨床試驗
(NCT02452372,跨地區(qū)多中心)
2015年,Givosiran 的首次人體試驗(FIH)啟動。這是1項多中心、隨機(jī)、安慰劑對照的劑量遞增試驗,旨在評估 Givosiran 在 AIP 患者中的安全性、耐受性及藥代動力學(xué)/藥效動力學(xué)特征。
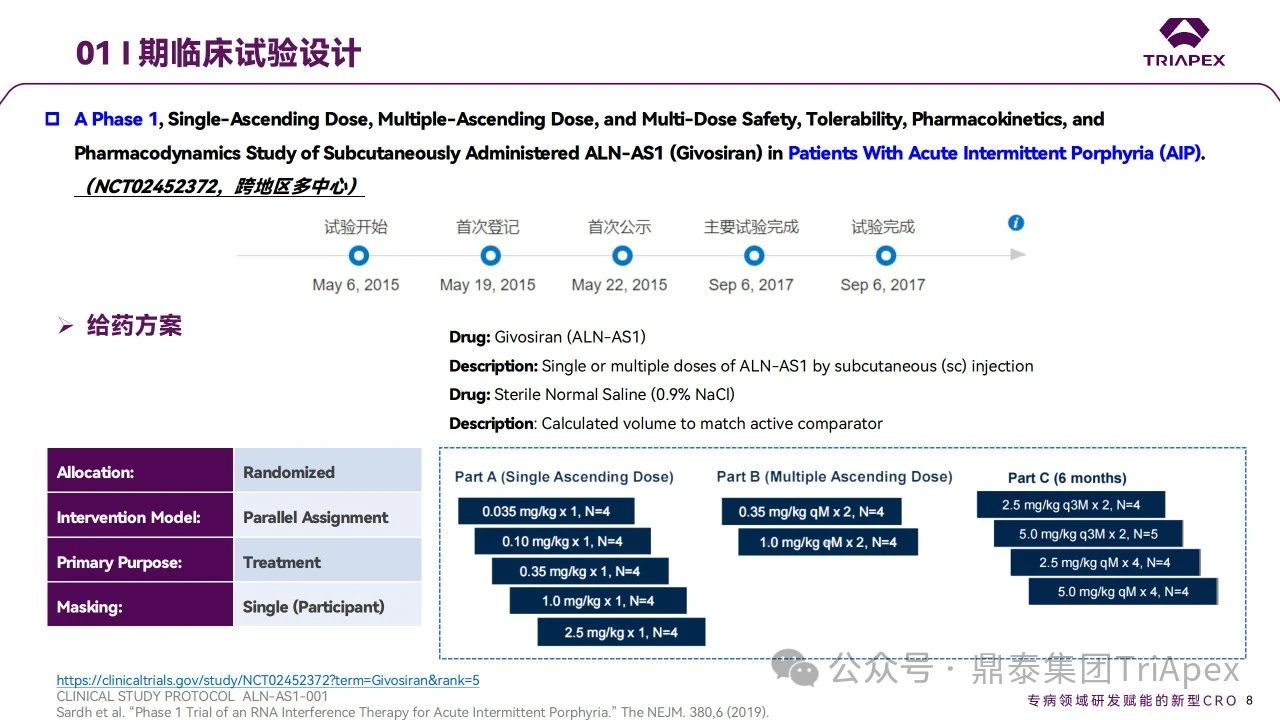
Ⅰ 期試驗臨床試驗設(shè)計
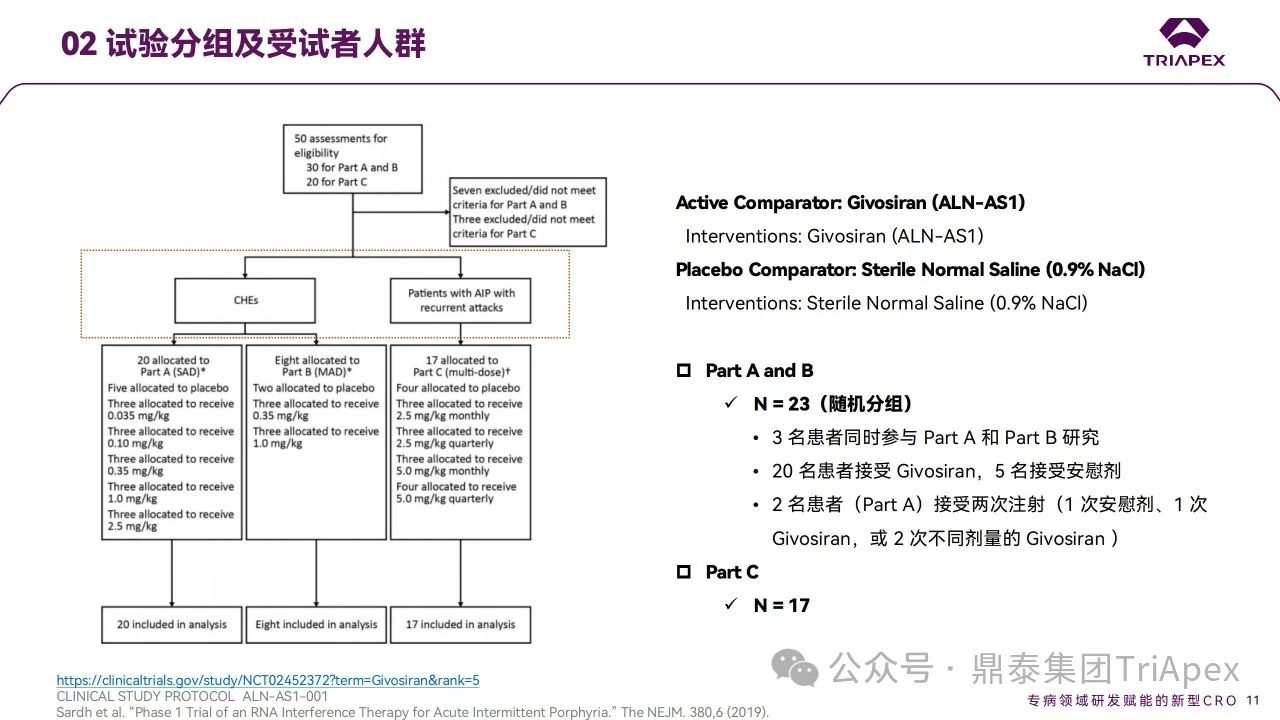
試驗分3部分進(jìn)行,共入組了40人,均為皮下注射給藥:
A和B部分共入組23人。其中,A部分(SAD;0.035、0.10、0.35、1.0、2.5 mg/kg,42天)和B部分(MAD;QM,0.35、1.0 mg/kg,70天)為單盲試驗,受試者為尿ALA和PBG水平升高但近期未發(fā)作(定義為在給藥前6個月內(nèi)沒有發(fā)作)的 AIP 患者
C部分(2.5、5.0 mg/kg,Q3M或QM)入組17人,采用雙盲設(shè)計,受試者為反復(fù)發(fā)作的 AIP 患者
主要終點為給藥后發(fā)生 AEs、SAEs及中斷用藥的受試者比例;次要終點為 Givosiran 藥代動力學(xué)參數(shù)(Cmax、tmax、t1/2、AUC)以及對尿中ALA和PBG水平的影響。起始劑量設(shè)計是從非臨床研究向臨床轉(zhuǎn)化的第一步。本試驗中起始劑量主要依據(jù):◆ 非臨床藥效學(xué)數(shù)據(jù)(點擊查看往期內(nèi)容):
(1)大鼠AIP模型中,Givosiran 以0.3、1或3 mg/kg(QW*4)皮下注射給藥后,可劑量依賴性降低 ALAS1 mRNA 水平,同時伴隨著尿液中 ALA 和 PBG 水平的下降;
(2)小鼠AIP模型中,Givosiran 在 1 mg/kg 劑量下,血清 ALA 和 PBG 水平分別降低80% 和 68%;
(3)食蟹猴模型中,Givosiran 以1 mg/kg 皮下注射給藥后,ALAS1 mRNA 水平僅降低20%。根據(jù)申請人前期開發(fā)的產(chǎn)品Revusiran(ALN-TTRSC siRNA)的經(jīng)驗,從NHP到人按1:1 進(jìn)行劑量外推,認(rèn)為0.10 mg/kg 為Givosiran無藥理活性劑量。
Givosiran非臨床藥效部分?jǐn)?shù)據(jù)
◆ 非臨床毒理學(xué)數(shù)據(jù):
根據(jù)大鼠和食蟹猴重復(fù)給藥毒理學(xué)試驗中確定的 NOAEL 計算安全系數(shù),最終采信了相對保守的基于 BSA 估算的安全系數(shù)。基于以上非臨床研究結(jié)果,申請人在最初的臨床方案中確定的FIH 起始劑量為 0.10 mg/kg。在完成0.10 和 0.35 mg/kg 劑量組的入組后,增加了更低的0.035 mg/kg 劑量,筆者尚未查到具體原因。如有專家有相關(guān)信息,敬請不吝指正。研究結(jié)果顯示,對反復(fù)發(fā)作的 AIP 患者,經(jīng) QM 給藥后的主要AEs均為輕度 AEs;可降低 ALAS1 mRNA 水平,ALA和PBG的水平接近正常,發(fā)作率低于安慰劑組[2]。采用經(jīng)驗證的 LC-MS/MS 方法檢測了血漿中 Givosiran(詳細(xì)的方法學(xué)內(nèi)容詳見后文)。0.035 和 0.1 mg/kg 劑量組血漿中 Givosiran 濃度均低于定量下限;0.35~5.0 mg/kg劑量范圍內(nèi),Givosiran 呈線性藥代動力學(xué)特征,Tmax為0.5~5 h,24 h 內(nèi)血漿濃度迅速下降,t1/2為4~10 h。◆ 代謝產(chǎn)物安全性評估:
對于siRNA藥物的代謝產(chǎn)物是否需要進(jìn)行檢測,以及如何評估代謝產(chǎn)物的安全性一直是業(yè)界思考和關(guān)注的問題。本文著重對Givosiran及其代謝產(chǎn)物的非臨床和臨床研究結(jié)果進(jìn)行了分析,或許能為寡核苷酸藥物代謝產(chǎn)物的評價提供一定的參考。AS 3′( N-1 )是Givosiran主要的代謝物(>總物質(zhì)的10%),在血漿中迅速形成,臨床結(jié)果顯示AS 3′( N-1) tmax為1-8 h,t1/2 與 Givosiran 相當(dāng),在人體內(nèi)具有一定的暴露水平。通過與重復(fù)給藥 13 周毒性試驗中暴露量的比較發(fā)現(xiàn),NOAEL劑量下AS 3′( N-1)的暴露量遠(yuǎn)高于臨床有效劑量下的暴露量,因此未開展額外的代謝產(chǎn)物研究。

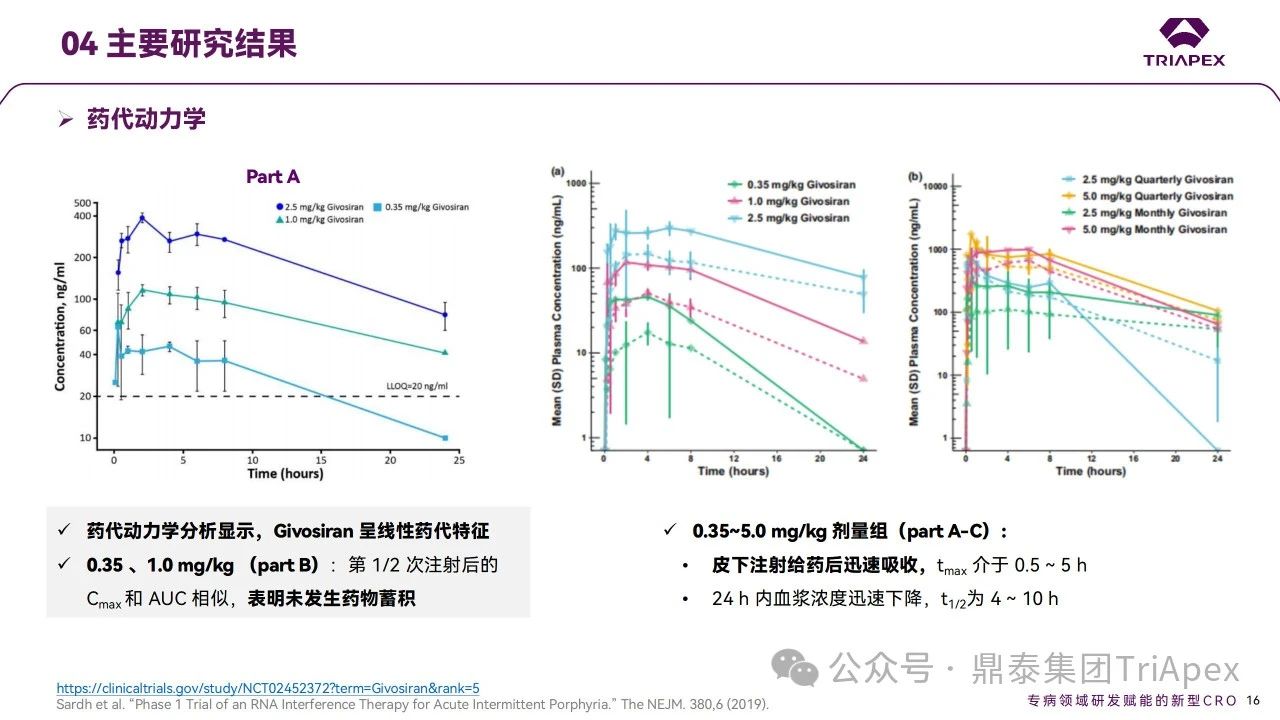
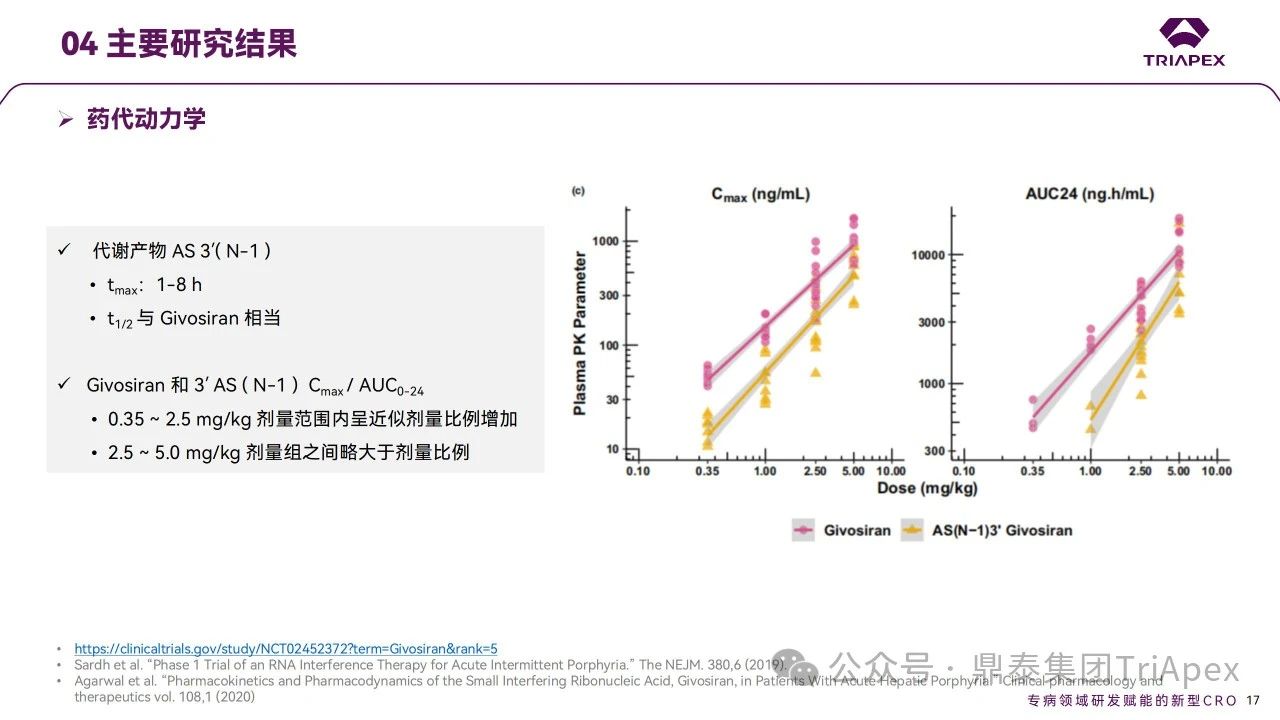
Ⅰ 期試驗安全性和藥代動力學(xué)(含代謝產(chǎn)物檢測)研究結(jié)果
2016年,啟動了 Ⅰ/Ⅱ 期臨床試驗。這是1項多中心、開放標(biāo)簽擴(kuò)展(OLE)研究,旨在評估皮下注射 Givosiran 的長期安全性和臨床活性,受試者為16名已完成前述I期臨床試驗(NCT02452372)C部分的 AIP 患者。主要終點為截至 49 個月時的 AEs 發(fā)生率;次要終點為截至 48 個月時尿液中 ALA 和 PBG 水平的變化、卟啉病發(fā)作的頻率和特點以及截至 49 個月時血紅素給藥情況的變化。

該試驗給藥劑量為2.5 mg/kg,QM皮下注射。根據(jù) Ⅰ 期臨床試驗結(jié)果,Givosiran 2.5 mg/kg 單次給藥耐受性良好,但沒有完全使 ALA 和 PBG 水平正常化;Givosiran 2.5 mg/kg Q3M給藥顯示一定的臨床活性,但部分患者在治療期間仍持續(xù)出現(xiàn)嚴(yán)重卟啉病發(fā)作,這提示需要更高的給藥劑量。研究結(jié)果顯示,Givosiran 2.5 mg/kg 安全性良好,大多數(shù)AEs為輕度至中度;長期使用 Givosiran 使 ALA 和 PBG 水平持續(xù)降低,沒有卟啉癥發(fā)作和不需要使用血紅素的患者比例隨著時間推移增加;安全性和有效性結(jié)果與下文所述的 Ⅲ 期臨床試驗(ENVISION)的結(jié)果一致[3]。
Ⅲ 期臨床試驗
(NCT03338816,代號ENVISION)
2017年,1項隨機(jī)、雙盲、安慰劑對照的6個月多中心 Ⅲ 期臨床試驗啟動(雙盲期后進(jìn)行30個月開放標(biāo)簽擴(kuò)展試驗)。該研究共完成36個月的數(shù)據(jù)分析,旨在評估 Givosiran 治療急性肝卟啉病患者的療效和安全性,受試者共94人。ENVISION 試驗在18個國家/地區(qū)的36個研究地點進(jìn)行研究,是AHP進(jìn)行的最大規(guī)模的治療研究。
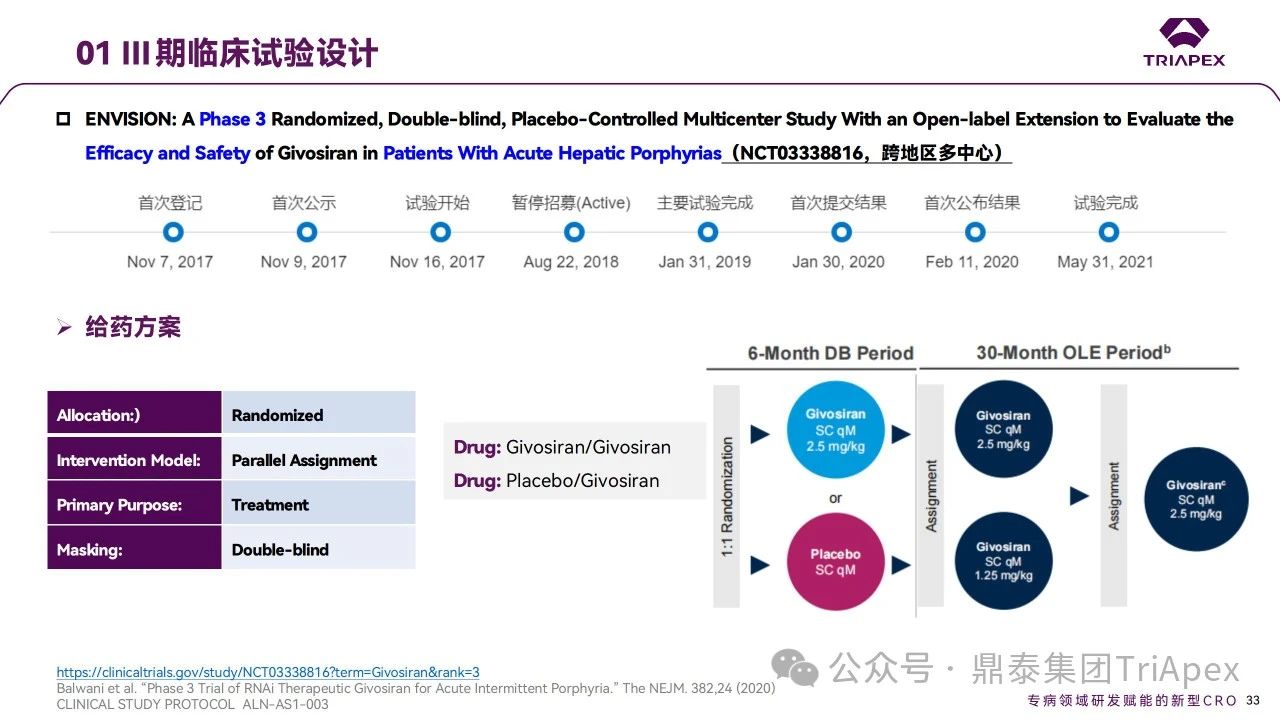
ENVISION試驗中給藥劑量為 2.5 mg/kg(QM),劑量設(shè)計主要基于對前期試驗結(jié)果的考量:相較于 Q3M,QM 給藥使尿中 ALA 的降低程度更高且持續(xù)時間更長,且該降低與卟啉病發(fā)作、血紅素使用和無發(fā)作間隔的顯著減少相關(guān)聯(lián)。主要終點為需要住院、緊急醫(yī)療就診或在家接受靜脈血紅素治療的卟啉病發(fā)作的年化發(fā)作率(AAR);次要終點為3、6個月時尿ALA水平,6個月時尿PBG水平、血紅素使用的比例、簡明疼痛量表(BPI-SF)及 SF-12 健康調(diào)查量表等。ENVISION試驗獲得了支持Givosiran用于AHP治療的有效性證據(jù)[4]:
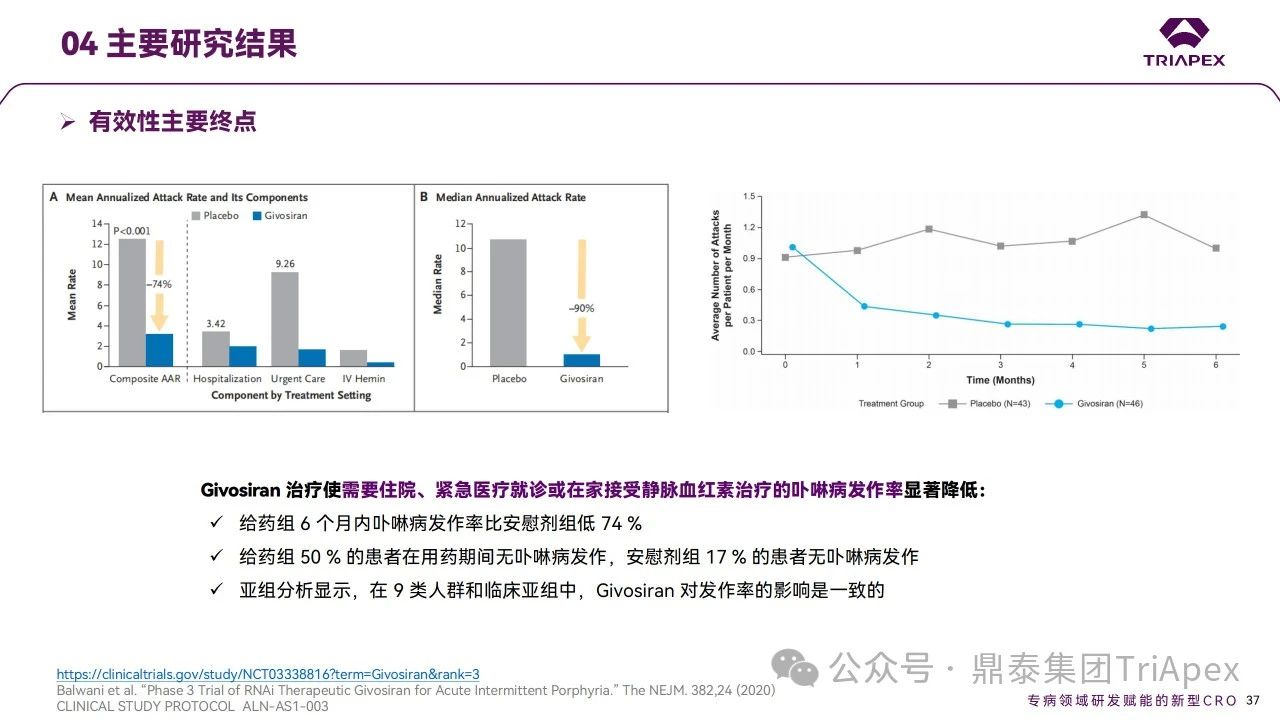

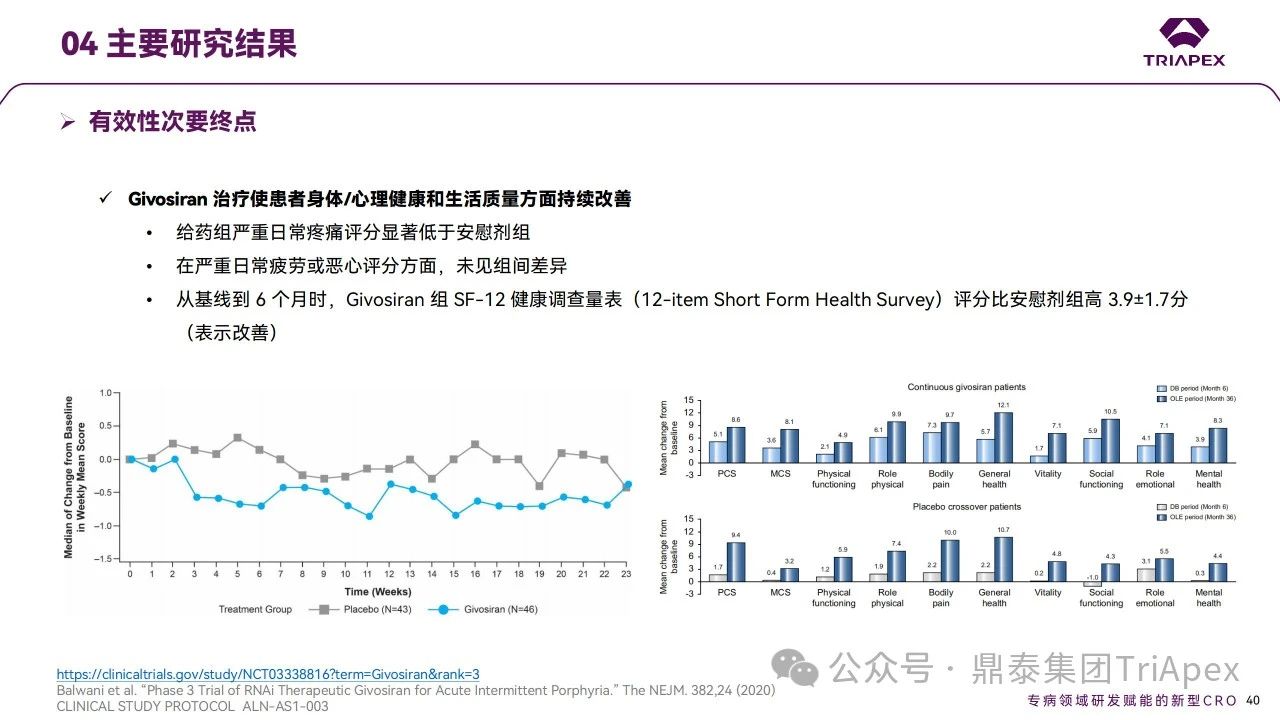
ENVISION試驗有效性研究結(jié)果
除了成功的臨床開發(fā)計劃外,Givosiran 驚人的上市歷程還受益于與監(jiān)管機(jī)構(gòu)的有效溝通。基于Ⅰ期臨床試驗結(jié)果,Alnylam 于2017年6月14日申請召開 Pre-Phase 3會議(此時I/II 期 OLE 試驗已啟動),主要就擬開展的 Ⅲ 期試驗設(shè)計征求 FDA 的建議。FDA 認(rèn)為申請人提出的劑量設(shè)計以及主要/次要終點是合理的,建議考慮將接受 Givosiran 治療的 AHP 患者的患者報告結(jié)局(Patient Reported Outcomes,PRO)的改善作為一個關(guān)鍵終點。通過本次溝通交流獲得的建議,使ENVISION 試驗的有效性結(jié)果更快地獲得了FDA的認(rèn)可。

此外,在從IND和NDA的過程中,還有一系列其他的監(jiān)管互動,如ODD、BTD、B類會議、優(yōu)先審評等。監(jiān)管里程碑關(guān)鍵節(jié)點
pre-NDA 會議中,F(xiàn)DA 問及免疫原性對暴露、療效和安全性的影響,可見FDA對siRNA藥物免疫原性的關(guān)注。通過對臨床試驗中ADA及藥代檢測方法的梳理,可更好地指導(dǎo)非臨床研究中生物分析工作的開展,并提高其臨床轉(zhuǎn)化價值。與所有寡核苷酸類藥物一樣,Givosiran 給藥可能存在免疫原性,在上述臨床試驗中,ADA作為探索性試驗終點進(jìn)行檢測:通過經(jīng)驗證的ELISA法,其血清中最低檢出濃度(靈敏度)為 37.4 ng/mL,最小要求稀釋倍數(shù)(MRD)為50倍。臨床結(jié)果顯示,Givosiran 經(jīng)皮下注射給藥后,ADA陽性率較低,如 Ⅲ 期 DB 階段安慰劑組和Givosiran 組 ADA 陽性率分別有 1/46和 2/48患者在基線時檢測到 ADA 陽性(滴度≤100);DB 和 OLE 階段,Givosiran 組有1/94患者產(chǎn)生新的 ADA,抗體滴度低且呈一過性,隨后檢測均為陰性。ADA 的發(fā)生對 Givosiran 的 PK,PD 沒有影響;對Givosiran 及其代謝產(chǎn)物的濃度未見影響。以上結(jié)果提示,Givosiran具有非常低的引發(fā)免疫反應(yīng)的風(fēng)險。同時對藥代生物分析進(jìn)行梳理,通過經(jīng)驗證的LC-MS/HRAM、LC-MS/MS法,其血漿中最低檢出濃度為 10、20 ng/mL,其尿液中最低檢出濃度為 50 ng/mL,評估 Givosiran 及其代謝產(chǎn)物的濃度。檢測時間點與 ADA 檢測時間點幾乎一致。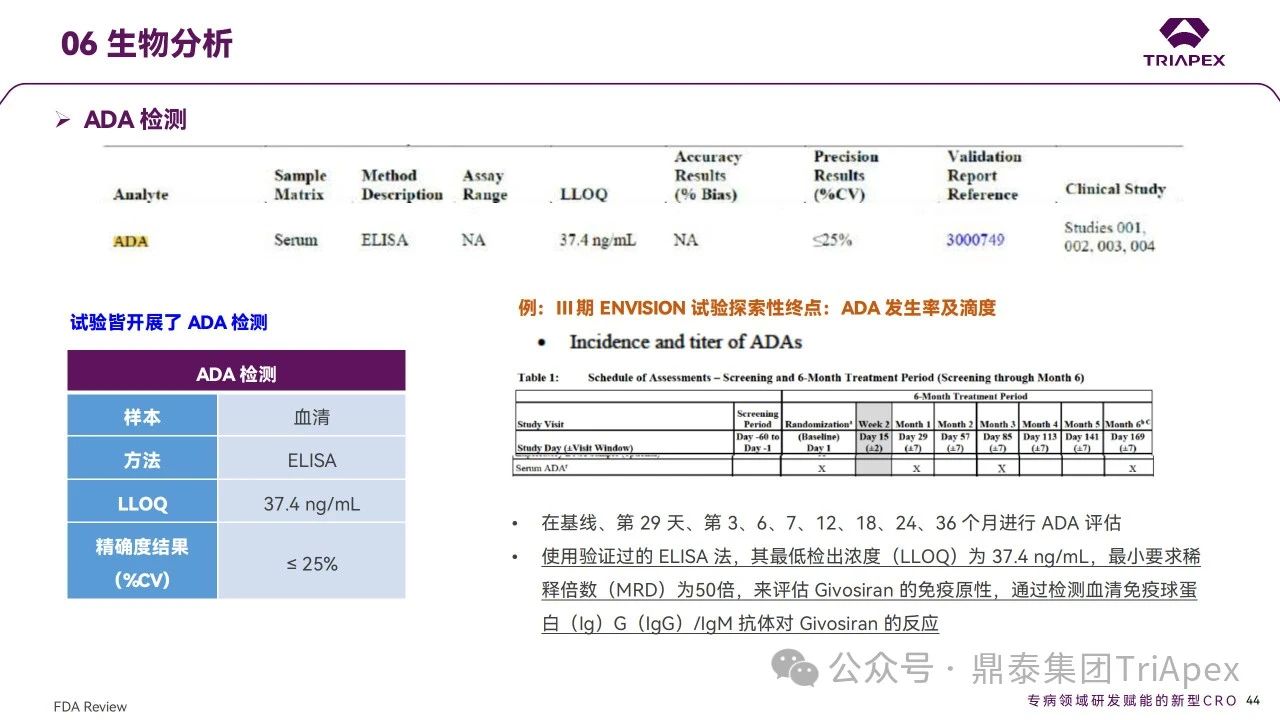
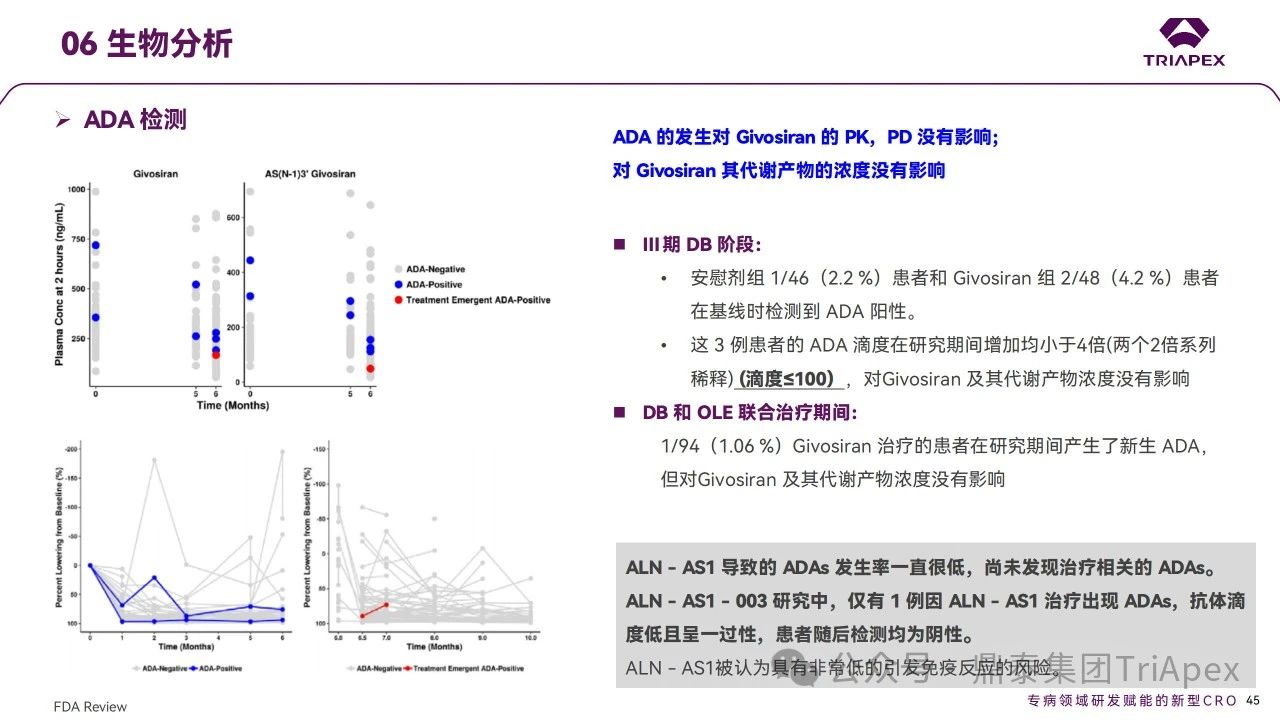
免疫原性檢測方法學(xué)和檢測結(jié)果
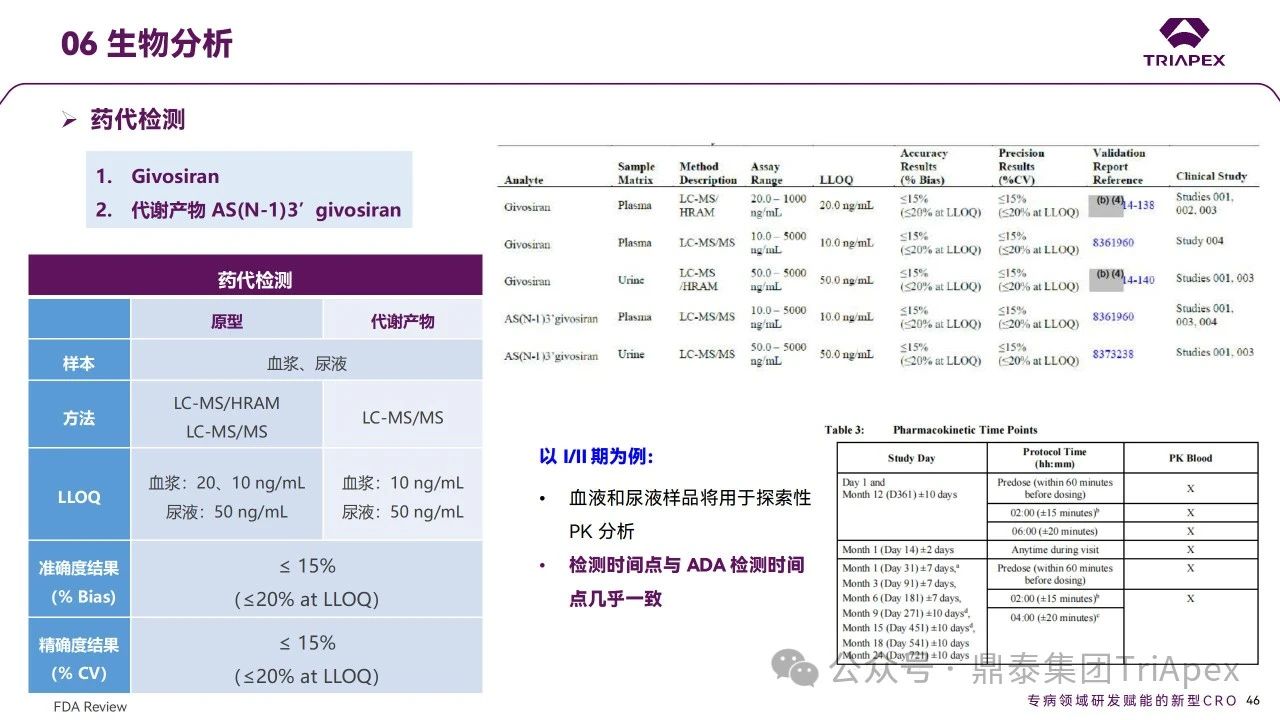
藥代動力學(xué)檢測方法學(xué)主要參數(shù)
在非臨床藥效學(xué)研究中,對于Givosiran作用機(jī)制相關(guān)的藥效學(xué) Biomarker 的變化規(guī)律進(jìn)行了探索,這些研究不但支持了FIH起始劑量的設(shè)計,也為臨床試驗中藥效動力學(xué)檢測指標(biāo)和監(jiān)測時間的確立提供了依據(jù)。采用嚙齒類和非人靈長類動物模型進(jìn)行的AHP非臨床研究中:以0.3、1或3 mg/kg(QW*4)劑量大鼠AIP模型皮下給藥后,與單次給藥類似,對 ALAS1 mRNA 的抑制具有劑量依賴性,同時伴隨著尿液中ALA和PBG水平的相應(yīng)下降;
以 2.5、5 mg/kg(QW*8)劑量食蟹猴皮下注射 Givosiran 后,血清中 ALAS1 mRNA 水平最大減少約 80%。這些試驗不但考察了 Givosiran 用于AHP治療的作用機(jī)制,也為臨床試驗中合理的可用于監(jiān)測和提示預(yù)期療效的Biomarker的確立提供了參考。
依賴于對 Givosiran 作用機(jī)制的理解以及非臨床研究結(jié)果,在I期、I/II臨床OLE期和 III期臨床試驗中均考察了給藥后ALAS1 mRNA、ALA及PBG水平等藥效學(xué)標(biāo)志物的變化,并將其作為劑量和給藥頻率選擇的依據(jù)。結(jié)果顯示, Givosiran 在 2.5 mg/kg劑量下,經(jīng)SC給藥能夠降低肝臟中ALAS1的水平,同時尿中 ALA 和 PBG 的水平也降低到了正常范圍。該結(jié)果與臨床前藥效學(xué)研究結(jié)果具有較好的相關(guān)性,從側(cè)面提示了非臨床藥效學(xué)研究對于提示臨床試驗設(shè)計的重要性。非臨床研究與臨床試驗PD marker相關(guān)性分析
肝臟毒性是非臨床和臨床對應(yīng)關(guān)聯(lián)的毒性表現(xiàn),可在臨床階段進(jìn)行密切監(jiān)控,全面評估藥物的安全性和風(fēng)險:非臨床結(jié)果顯示肝細(xì)胞單細(xì)胞壞死、肝細(xì)胞嗜堿性顆粒等;臨床中也有一定肝毒性結(jié)果。
對于寡核苷酸藥物,非臨床研究中發(fā)現(xiàn)的毒性與臨床試驗中出現(xiàn)的 AE 具有較高的關(guān)聯(lián)性。Givosiran 非臨床結(jié)果顯示肝細(xì)胞單細(xì)胞壞死、肝細(xì)胞嗜堿性顆粒等,臨床中則可見轉(zhuǎn)氨酶升高和肝臟毒性,并在說明書中給予警示。上述關(guān)聯(lián)性提示,非臨床研究對于評估臨床安全性和指導(dǎo)風(fēng)險控制計劃的制定具有重要價值。
綜上所述,非臨床研究為臨床試驗設(shè)計提供了依據(jù);科學(xué)的劑量和給藥方案探索、無縫銜接的臨床研究規(guī)劃、合理的III期臨床試驗設(shè)計是 Givosiran 快速獲得監(jiān)管機(jī)構(gòu)上市批準(zhǔn)的重要保障。此外,基于穩(wěn)健的前期數(shù)據(jù),與監(jiān)管機(jī)構(gòu)進(jìn)行有效的溝通也是必不可少的藥政策略。Givosiran 的上市歷程和臨床開發(fā)路徑的復(fù)盤分析為 siRNA 藥物的研發(fā)提供了寶貴的經(jīng)驗和啟示。
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容
