
2024-04-15 00:00:00來源:陶術生物瀏覽量:164
說到脂肪肝(Fatty liver disease, FLD),大家一定不陌生,每年體檢,被查出脂肪肝的大有人在,但由于脂肪肝初期并沒有明顯的癥狀,很多人對此并不重視,還是該吃吃該喝喝,等到進展成肝炎、肝癌了才追悔莫及。
?
脂肪肝是由于多種原因引起的肝臟細胞內脂肪堆積過多(主要是由甘油三酯 ,TG)而產生的常見肝臟病變,已成為全球肝損傷的主要原因。
脂肪肝進展到晚期可導致肝硬化和肝細胞癌,對公共健康造成重大威脅,目前還沒有藥物被批準用于治療 FLD,因此,迫切需要開發新的藥物靶點和有效療法。
?
2024年1月31日,一篇發表在?PNAS?題為?The ubiquitin E3 ligase BFAR promotes degradation of PNPLA3?的研究論文引起廣泛關注,該文研究團隊發現泛素 E3 連接酶 BFAR ,可以促進 FLD 的重要遺傳危險因素 PNPLA3 的降解,為 FLD 治療提供了新靶點。
 ?
?
▲點擊圖片可跳轉原文
實驗中,研究團隊首先鑒定并確認了細胞凋亡調節因子 BFAR 作為 PNPLA3 的 E3 泛素連接酶,可以發揮對 PNPLA3 的調節作用。
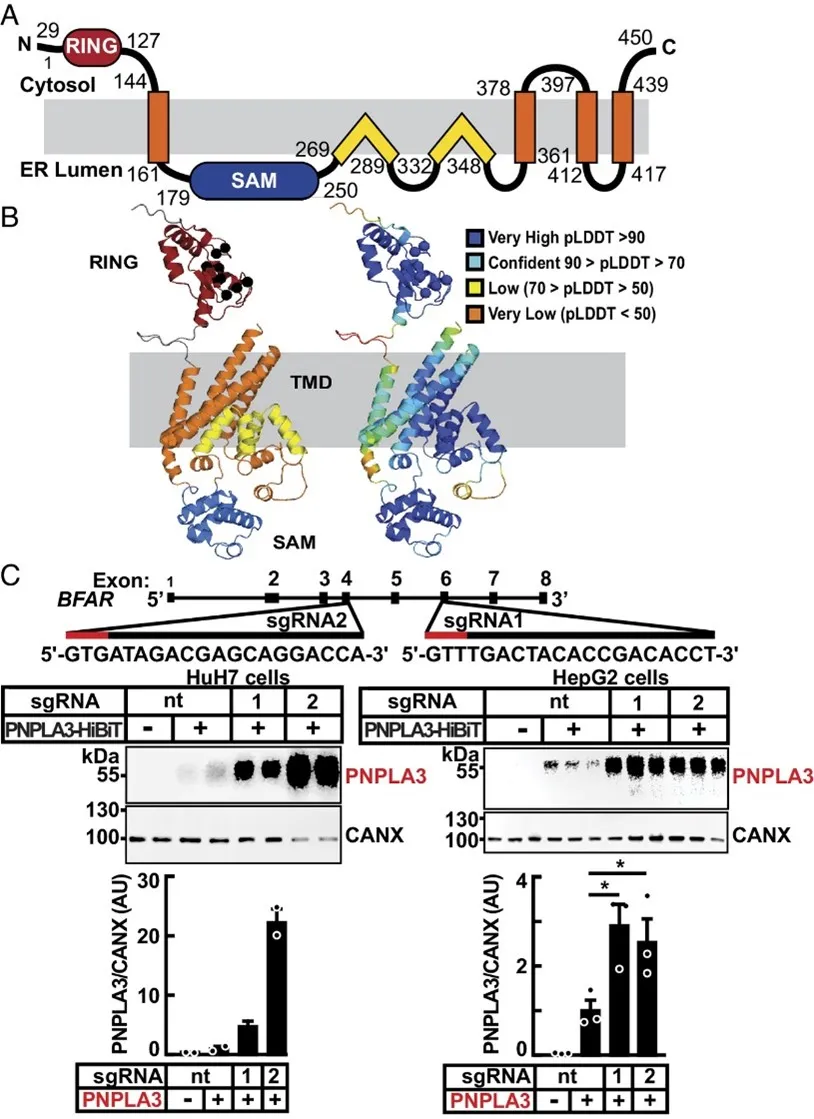
而后,使用 siRNA 敲除了穩定表達 PNPLA3 的 HuH7 細胞中的 BFAR,發現處理后細胞 PNPLA3 蛋白水平提高了 2.8 倍。通過解析 BFAR 的重組形式,并使用 CRISPR-Cas9 技術生成 BFAR 表達失活的細胞系,通過 Sanger 測序確認失活突變。
結果表明 ,在 BFAR 失活的細胞中,PNPLA3-HiBiT(用于檢測和追蹤PNPLA3水平的融合蛋白)的水平增加了 5 倍至 20 倍,說明?BFAR 的耗竭可以增加培養的肝細胞中的 PNPLA3 水平。
? ?
?
?▲肝細胞中 BFAR 的結構域組織、結構模型和BFAR失活
進一步的驗證實驗也顯示,BFAR?的過表達可以降低培養肝細胞中?PNPLA3?蛋白水平。此外,通過使用重組 PNPLA3 和 BFAR 進行的下拉試驗,顯示這兩種蛋白之間存在相互作用,并在細胞中觀察到它們的免疫共沉淀作用。
?
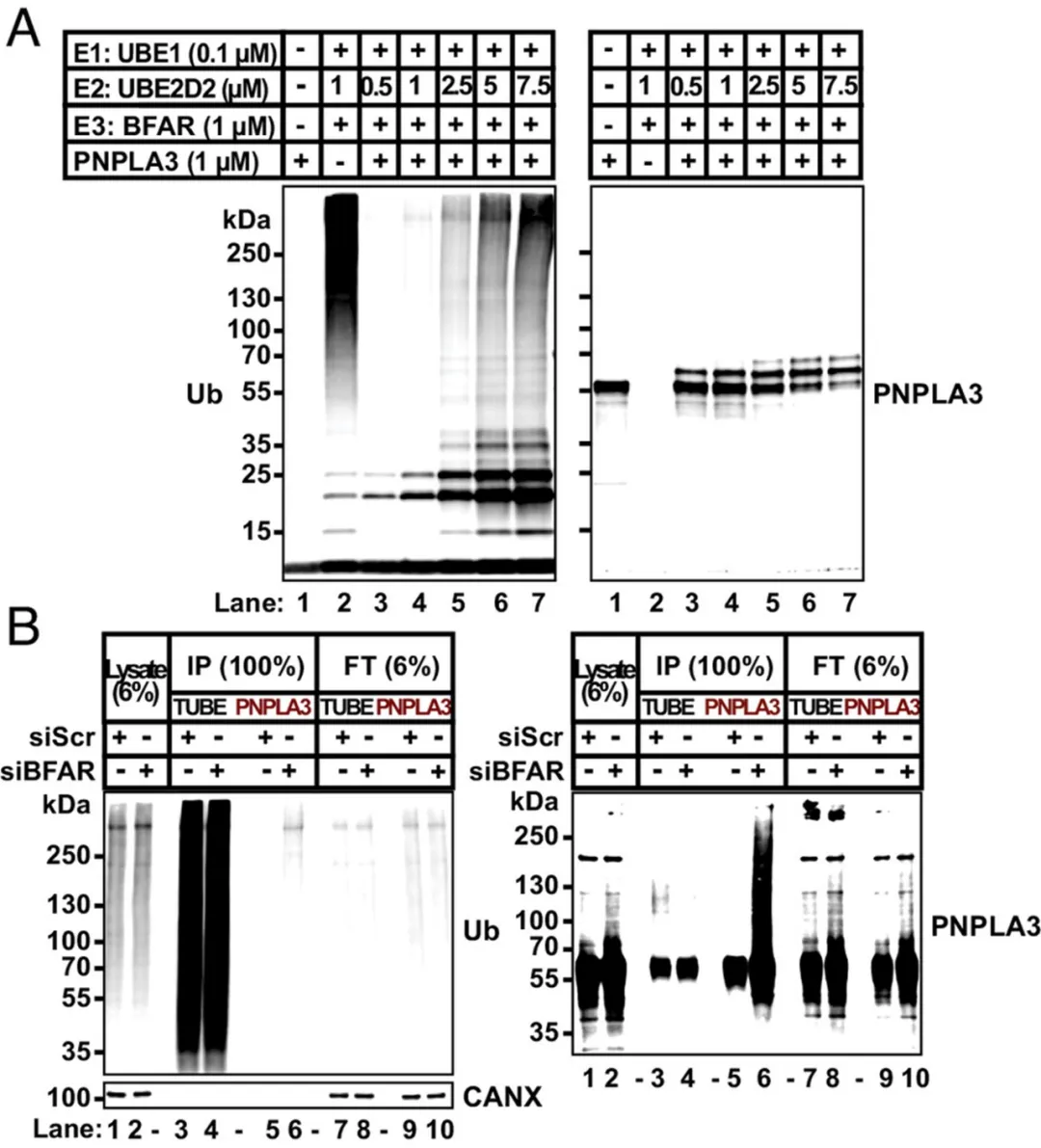
為了測試 BFAR 是否可以泛素化 PNPLA3,研究團隊使用重組蛋白進行了體外測定證實和細胞實驗驗證,體外測定發現?BFAR 可以作為 E3 泛素連接酶用于 PNPLA3 的單泛素化;細胞實驗中敲除 BFAR 不會導致 PNPLA3 泛素化減少,但細胞中 PNPLA3 有增加的趨勢。
?
 ?
?
▲BFAR 對 PNPLA3 的泛素化
?
研究人員還通過 CRISPR-Cas9 技術構建了 Bfar?/?鼠,與? WT 小鼠進行免疫印跡對照實驗,發現 Bfar?/?小鼠肝臟中 PNPLA3 水平高出 WT 小鼠 2 倍。然而,盡管高水平的 PNPLA3 蛋白在脂滴上的積累與肝臟 TG 的增加相關,但在 Bfar 基因敲除小鼠中未觀察到肝臟 TG 的增加。這表明 PNPLA3 的積累可能與肝臟 TG 水平的變化有關,但具體機制仍需進一步研究。
?
同時,研究還發現肝臟 BFAR 水平不會因小鼠食物攝入量而變化。
在 WT 小鼠中,蔗糖喂養可增加 PNPLA3 mRNA 和蛋白的水平。為了確定 BFAR 表達是否也受到喂養的調節,團隊測量了禁食小鼠肝臟中 BFAR 蛋白和 mRNA 的水平,發現在禁食和喂食小鼠肝臟中 BFAR 蛋白水平無差異。
?
?
綜上,這項研究發現,PNPLA3的突變形式在脂滴上積累,干擾肝臟三酰甘油的積累 ,從而促使脂肪肝病的發展。BFAR作為一個E3泛素連接酶,通過促進PNPLA3的降解來調節其水平。實驗結果表明,BFAR的失活導致PNPLA3水平增加,而BFAR的過表達則降低PNPLA3水平。這些發現揭示了BFAR在調控肝細胞中PNPLA3水平的作用機制,為治療FLD的研究提供了新思路。
?
科研助力? |
Dihydrocurcumin(截至5月8日限時58折) 可調控SREBP-1C,PNPLA3 和 PPARα 的 mRNA 和蛋白表達水平,具有減少脂肪積累和減少氧化應激反應的作用; |
Alirocumab(截至5月8日限時58折) 能夠特異性結合肝臟低密度脂蛋白 (LDL) 受體的下調劑 PCSK9,增強肝臟結合 LDL-膽固醇 (LDL-C) 的能力,降低血液中的 LDL-C 水平; |
CX08005(截至5月8日限時58折) 一種蛋白酪氨酸磷酸酶 1B 抑制劑,可減輕與非酒精性脂肪肝相關的肝臟脂質蓄積和微循環障礙; |
HX 531(截至5月8日限時58折) 能減少高脂飲食小鼠的骨骼肌、白色脂肪組織和肝臟中的甘油三酯含量; |
Ervogastat(截至5月8日限時58折) 可降低非酒精性脂肪性肝炎 (NASH) 中的脂肪變性和肝臟甘油三酯水平; |
參考資料:
[1] Das A, Cheng H, Wang Y, Kinch LN, Liang G, Hong S, Hobbs HH, Cohen JC. The ubiquitin E3 ligase BFAR promotes degradation of PNPLA3. Proc Natl Acad Sci U S A. 2024 Feb 6;121(6):e2312291121. doi: 10.1073/pnas.2312291121. Epub 2024 Jan 31. PMID: 38294943; PMCID: PMC10861911.
?