
2024-03-18 00:00:00來源:陶術生物瀏覽量:169
在腫瘤發生過程中,許多癌細胞會高度依賴線粒體的氧化代謝,以維持自身快速的增殖。因此,靶向線粒體功能也是癌癥治療的一個方向。
?
以急性髓系白血病(AML)為例,AML細胞對氧化磷酸化和脂肪酸氧化等線粒體代謝過程依賴較高,而線粒體功能異常可能會影響AML的發展和治療效果。
在新一期?Nature Metabolism?中,科學家發現預后較差的 AML 患者有一種叫做?SLC25A51?的細胞轉運蛋白水平升高。在健康細胞中,這種轉運蛋白負責為細胞過程提供能量,而在 AML 細胞中,其水平升高就像給汽車踩上了油門,使細胞復制進入超速狀態,降低 SLC25A51 水平則可以控制疾病進展。
 ?
?
▲點擊圖片可跳轉原文
小貼士
SLC25A51作為線粒體煙酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide, NAD+)轉運蛋白,能夠將游離氧化態NAD+輸入到線粒體中,從而維持NAD+水平的穩定,促進各項代謝活動的正常進行。
NAD+是細胞內重要的活性分子,它不僅是糖酵解、糖異生和三羧酸循環中多種代謝酶的輔因子,還直接作為底物參與多種蛋白質翻譯后修飾過程。AML細胞可通過上調NAD+水平來維持自身的快速增殖。
?
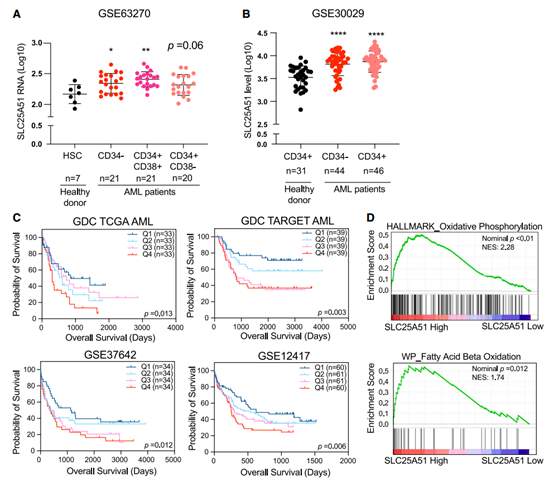
在這項研究中,研究人員首先從 AML 患者的轉錄組數據中評估了 SLC25A51 的相對表達,發現在四個不同的 AML 患者隊列中,SLC25A51 水平越高的患者,他們的治療效果往往也越差。隨后的細胞周期分析還顯示,SLC15A51 是 AML 細胞增殖和存活所必須的條件。
?
 ?
?
▲AML患者SLC25A51表達升高
?
有了這些發現,那敲除/抑制 SLC25A51 的表達是否能減弱 AML 細胞的增殖/存活呢?
研究團隊隨后在體內通過正交異種移植和單核性 AML 細胞來監測腫瘤發生。發現在 NSG 小鼠中,通過誘導表達靶向 SLC25A51 的 shRNA,導致腫瘤負擔減輕、防止了脾臟增大,并延長小鼠的總體存活時間。
此外,在已建立的腫瘤模型中使用?Doxycycline(多西環素)耗竭 SLC25A51 導致腫瘤明顯減退,改善了存活率,突顯了 SLC25A51 在 AML 細胞在體內建立和維持中的關鍵作用。并且,降低 SLC25A51 不會損害正常的骨髓細胞,只會損害癌細胞。
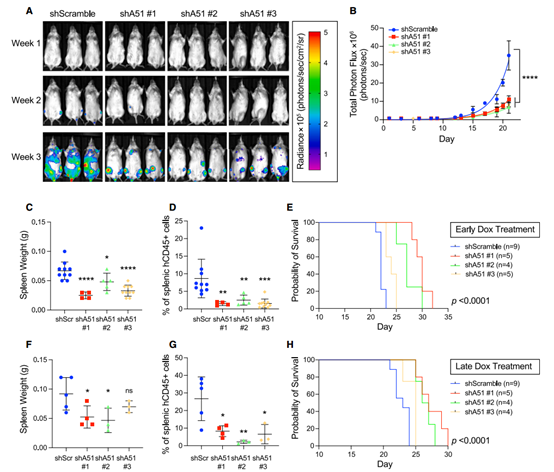
▲SLC25A51的缺失可限制AML細胞的擴增
SLC25A51 的耗竭還會導致線粒體超氧化物水平升高。研究發現,SLC25A51 的耗竭導致線粒體 NAD+/NADH 比率降低,特異性丟失還原的泛醌,進而降低氧化比率并破壞電子傳遞鏈的流動,與這些細胞中氧化呼吸的損失一致。此外,SLC25A51 對于支持 TCA 循環和氧化 TCA 通量是必需的,其耗竭導致非谷氨酰碳源的使用增加,支持 TCA 循環。
通過調控線粒體 NAD+/NADH 比率,SLC25A51 可控制 TCA 循環通量,從而在 AML 細胞中調控氧化 TCA 代謝。
目前對于 AML 患者的一個治療難點是部分患者只能使用?Azacytidine?單藥治療,且緩解率和存活率較低,因此研究人員探究了 SLC25A51 是否能與 AML 治療藥物相結合,從而提高療效。
?
實驗首先在體外處理 U937 細胞以確定其對 5-azacytidine 的 IC50,發現?SLC25A51 耗竭會使 U937 細胞對 5-azacytidine 的治療呈劑量依賴性敏感。隨后,在小鼠模型中,SLC25A51 耗竭與 5-azacytidine 治療的組合導致?腫瘤負擔降低,骨髓中白血病細胞的百分比降低,脾重和浸潤性腫瘤細胞也減少,同時延長了小鼠的總體存活時間。
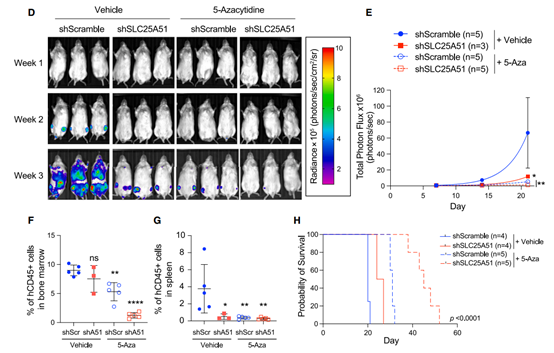
▲shSLC25A51與藥物結合可以降低小鼠的腫瘤負擔
綜上,研究表明,SLC25A51 轉運蛋白對 維持線粒體 NAD+ 水平至關重要,代謝通量分析顯示,較高的 SLC25A51 水平促進了 TCA 循環中的氧化通量,從而提供了一個證據,解釋了降低的 SLC25A51 水平如何影響 AML 的擴張。通過靶向 SLC25A51,有望減少疾病的適應性、耐藥性和復發,并使 AML 細胞對化療藥物更敏感。了解 NAD+ 補充方法的廣泛影響以及靶向 SLC25A51 也可能為其他具有類似代謝依賴性的癌癥提供新的治療選擇。
?
此外,該研究涉及的?Doxycycline?、?5-Azacytidine?以及?NAD+?陶術限時58折,助力您抗腫瘤領域相關的研究,歡迎私信咨詢~
 ?
?
 ?
?
 ?
?
參考文獻:
[1] Mu-Jie Lu et al, SLC25A51 decouples the mitochondrial NAD+/NADH ratio to control proliferation of AML cells, Cell Metabolism (2024). DOI: 10.1016/j.cmet.2024.01.013
?