據悉,這是首款獲批的TIL療法,也是首款獲批治療實體瘤的T細胞療法。Amtagvi 是一種腫瘤衍生的自體 T 細胞免疫療法。在治療前的外科手術中切除患者的一部分腫瘤組織,將患者的T細胞從腫瘤組織中分離出來,進一步制造,然后以單劑量輸注的形式返回給同一患者。單劑量的Amtagvi包含7.5億到72億個活細胞,從收到腫瘤組織到完成Amtagvi制備大約34天。Amtagvi 2期臨床試驗顯示:在中位隨訪時間為27.6個月時,患者客觀緩解率(ORR)為31.4%,包含8位患者達完全緩解(CR)與40位患者達部分緩解(PR)。后來,Iovance4年隨訪數據顯示,最長緩解持續時間為55.8個月。
臨床試驗安全性數據:
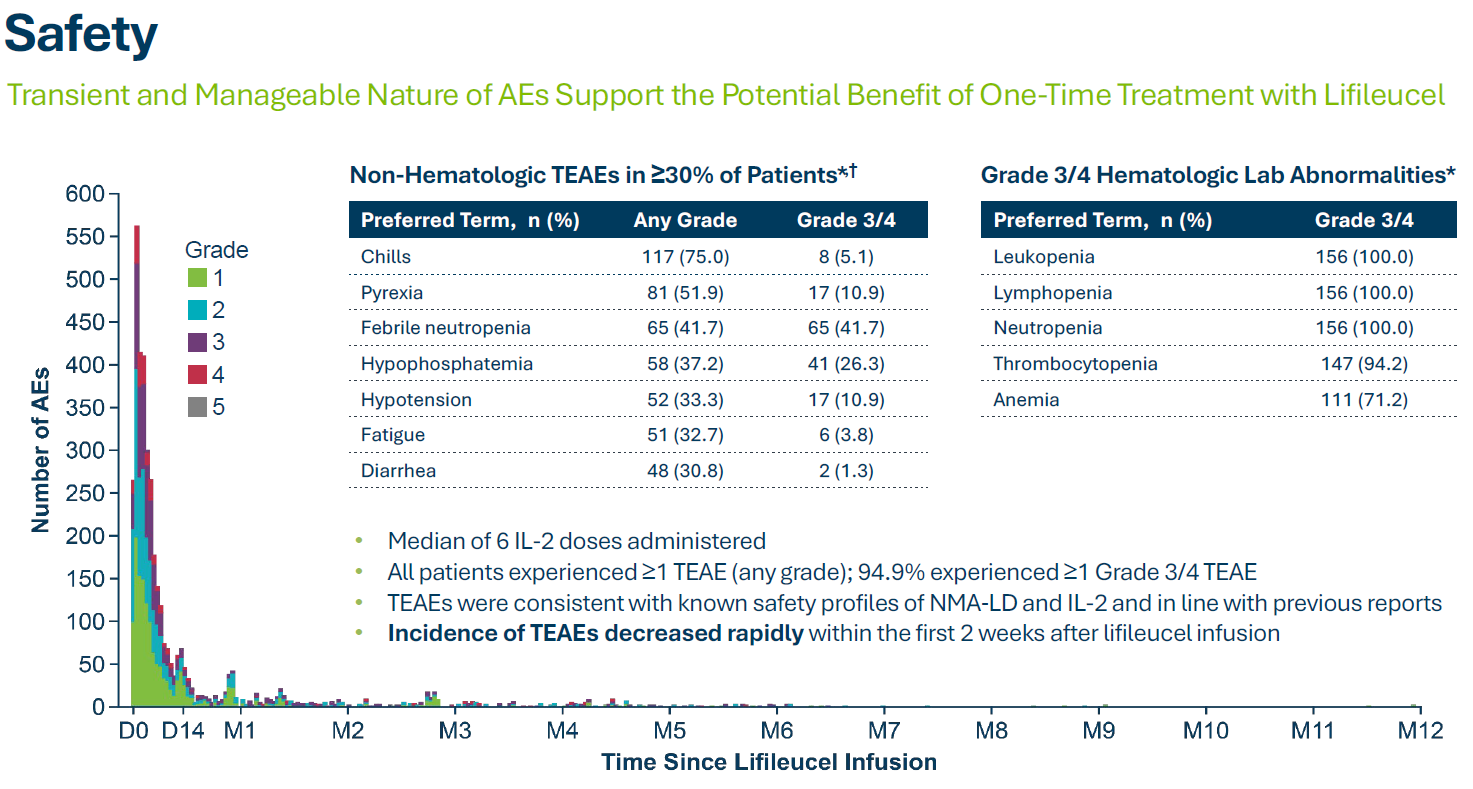
在美國,每年約有 8,000 人死于黑色素瘤。到目前為止,對于晚期黑色素瘤,尚無 FDA 批準的治療方案,這些患者只能接受免疫檢查點抑制劑治療和適當的靶向治療。由此可見,晚期黑色素瘤存在巨大的未滿足的臨床需求,Amtagvi的加速批準為這類患者帶來突破療法,同時引領下一代細胞療法。放眼國內,砂礫生物、循生生物、君賽生物、藍馬醫療、智瓴生物等多家公司布局TIL 療法,其中砂礫生物進展最快。
關于Iovance BiotherapeuticsIovance Biotherapeutics于2007年9月17日在內華達州成立,是一家新興的生物技術公司,專注于培養細胞,使用自體腫瘤浸潤淋巴細胞(TIL)治療轉移性黑色素瘤等實體瘤的細胞治療方法的發展和商業化。
研發管線
參考資料:
https://www.iovance.com/clinical-pipeline/





