抗體偶聯藥物已然成為除了免疫檢查點抑制劑以外,另一備受關注的領域。眾所周知,抗體偶聯藥物主要由三部分組成,分別為靶向特異性抗原的抗體、有效載荷和連接子[1]。其中,有效載荷以小分子細胞毒藥物為主。相較于單獨使用小分子細胞毒藥物,抗體偶聯藥物的優勢在于其通過抗體將有效載荷遞送到特定位置,進而降低對全身系統的暴露量進而提高治療獲益風險比,但同時抗體的引入也是一把雙刃劍,比如增加免疫原性風險等。此外,由于ADC復雜的組成,其藥代動力學特征與常規的小分子抗腫瘤藥物和單克隆抗體大有不同,這也為臨床研究中劑量選擇帶來一定的挑戰。下面,小編將從國內外指導原則出發,隨后以Nectin-4 ADC Enfortumab為例,帶大家了解ADC類藥物的臨床藥理特征。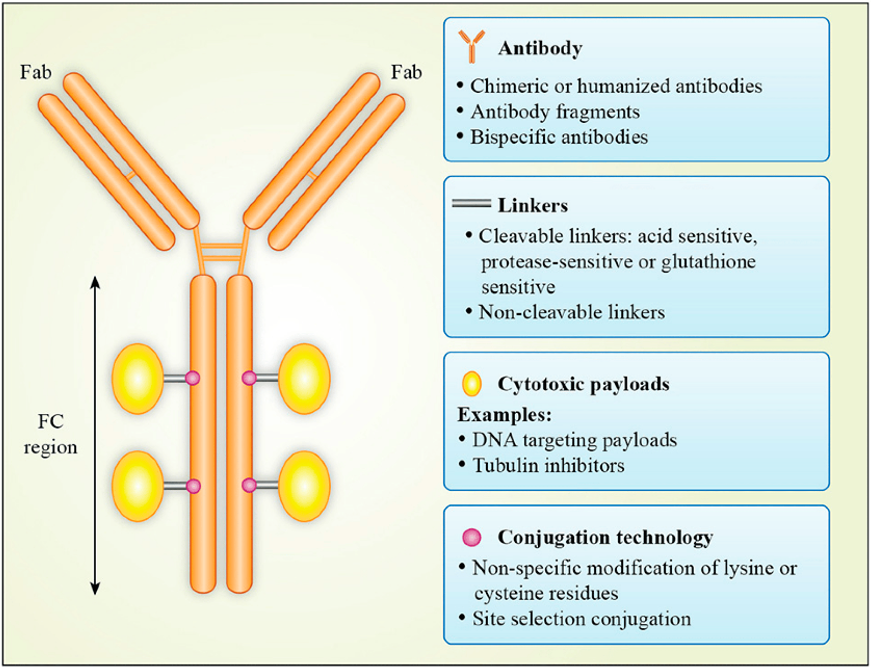
2023年4月,國家食品藥品監督管理局頒布了《抗腫瘤抗體偶聯藥物臨床研發技術指導原則》[2],并強調合理的給藥策略是影響ADC藥物獲益風險特征的關鍵因素,需綜合考慮抗體和有效載荷之間的藥代動力學和藥效動力學差異。此外,指導原則還指出ADC藥物藥代動力學研究,至少包括偶聯抗體、總抗體、非偶聯的小分子化合物和活性代謝產物。
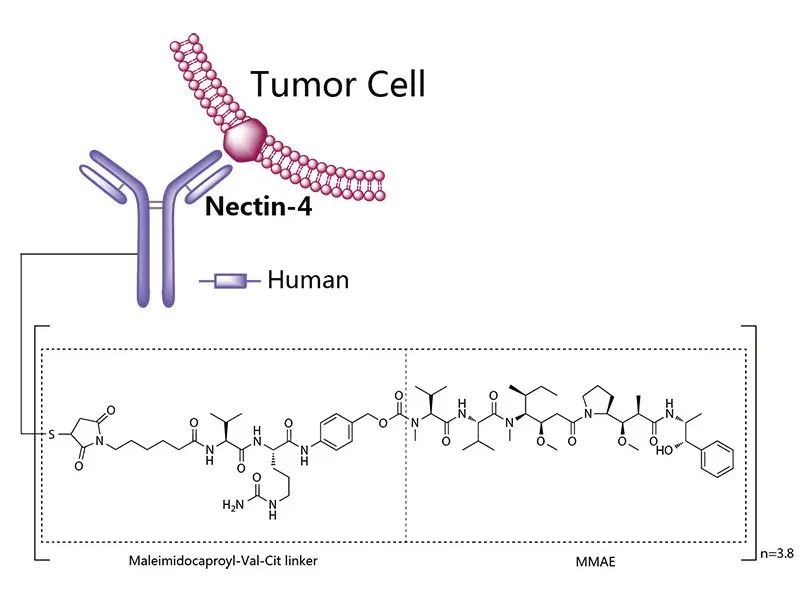
2022年2月,FDA發布了《抗體偶聯藥物臨床藥理考量指導原則》草案,其主要規定了ADC藥物在臨床藥理方面的相關內容[3],涉及生物分析方法、劑量/暴露量-效應關系、內在因素(肝腎功能損傷、體重、年齡等)、QTc評估、免疫原性和藥物相互作用。另外,該草案中還闡述了在哪些情況下建議或不建議進行檢測的分析物,如非偶聯的小分子化合物在充分靈敏方法下未檢出,FDA可能不建議檢測該部分;在QTc評估時,檢測非偶聯小分子化合物和活性代謝產物就足夠了。圖2. Enfortumab結構,來源:藥渡數據
基于EV-101研究劑量爬坡階段藥代動力學(PK)分析結果顯示,Enfortumab在0.5-1.25 mg/kg劑量范圍內,呈線性劑量比例性藥代動力學特征,無明顯蓄積[5]。Enfortumab和MMAE經一個周期給藥后達到穩態,最大血藥濃度(Cmax)分別為27.7 μg/mL和4.79 ng/mL,0至28天曲線下面積(AUC0-28d)分別為111 day*μg/mL和68.6 day*ng/mL,谷濃度為0.267 μg/mL和0.566 ng/mL。截至2019年1月,共收集了4個臨床研究中369名受試者的血樣,進行Enfortumab和非偶聯MMAE群體PK建模[5]。其中,Enfortumab通過一級消除三房室模型描述其PK特征,而一級消除二房室模型以及從Enfortumab到MMAE呈指數下降轉換率描述非偶聯MMAE PK特征,清除率(CL)分別為0.104 L/h和2.72 L/h,消除半衰期約為3.35天(80.5 h)和2.44天(58.5 h),如圖3所示。
此外,Enfortumab群體PK模型將體重、性別、血紅蛋白、基線腫瘤直徑總和以及腫瘤類型納入協變量分析,而MMAE模型則將白蛋白、ECOG評分、血紅蛋白、膽紅素、種族、體重和性別納入協變量分析。結果顯示,這些協變量影響無臨床意義。
在暴露量效應關系(ER)分析方面,數據來源于在第一周期D1、D8和D15接受1.25 mg/kg Enfortumab的尿路上皮癌患者,隨后以最佳總體療效(BOR)、持續應答時間(DOR)、無進展生存期(PFS)和總生存期(OS)作為療效指標,進行暴露量與療效關系分析。
其中,采用一元Logistic回歸模型評價BOR與Enfortumab和游離MMAE暴露量的關系。從圖4可以看出,Q2-Q4暴露量所預測的應答率可達50%左右且趨近平穩,表明超過1.25 mg/kg劑量可能并不能進一步帶來療效獲益。此外,申辦方還使用一元Cox比例風險模型評價DOR、PFS和OS與暴露量的關系,但具體結果未在審評報告中披露。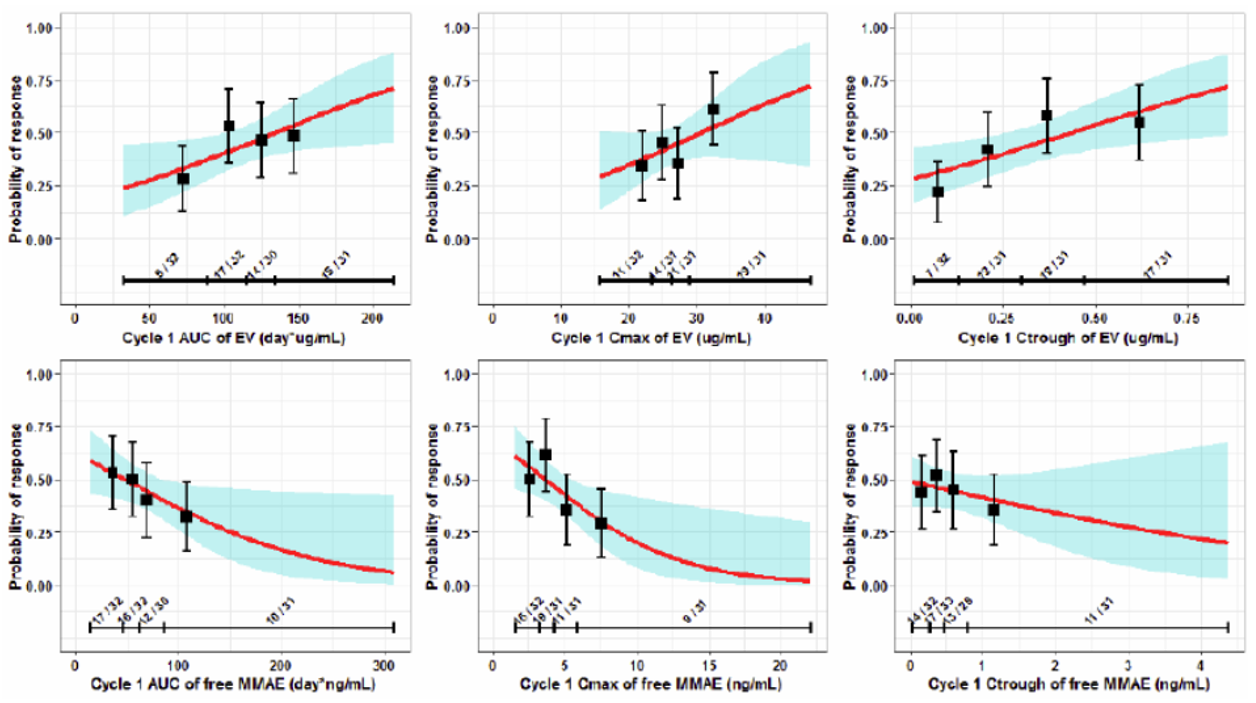
還通過一元Logistic回歸模型,評估3級以上TRAE發生率與暴露量的關系。據圖5所示,暴露量與不良事件呈正相關,但優勢比相對較小,僅1.006,而在游離MMAE模型中,優勢比也僅0.895,均無臨床意義。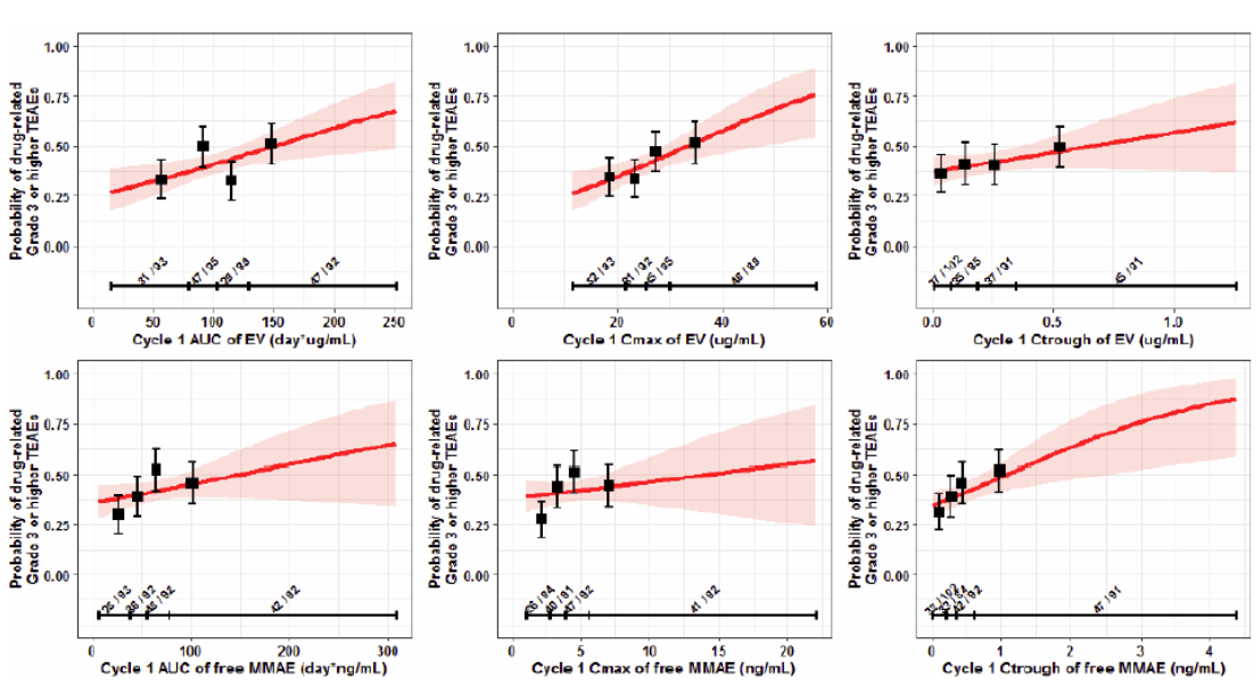
值得注意的是,披露的ER分析中僅納入1.25 mg/kg劑量數據,但未納入劑量0.5、0.75 mg/kg和1.0 mg/kg劑量組數據,因為較寬劑量范圍更有利于趨勢判斷,對劑量選擇上會更加清晰。有可能是因為其他劑量組納入的瘤種較為雜亂,會影響對尿路上皮癌ER分析的結果和判斷,也有可能申辦方做了這類分析,但并未公開其結果。具體原因尚未可知。
以基線估計的肌酐清除率用于評估腎功能損傷程度,并通過群體PK分析腎功能對Enfortumab和游離MMAE暴露量的影響。結果顯示,輕度(60<CrCl<90 mL/min, n=150)、中度(30<CrCl<60 mL/min, n=132)和重度腎損傷(CrCl<30 mL/min, n=9)人群,不論是AUC還是Cmax與正常腎功能人群相比均無顯著差異,而終末期腎病因人數較少無法得到結論(圖6)[5]。綜上,輕度、中度和重度腎損傷人群無需進行劑量調整。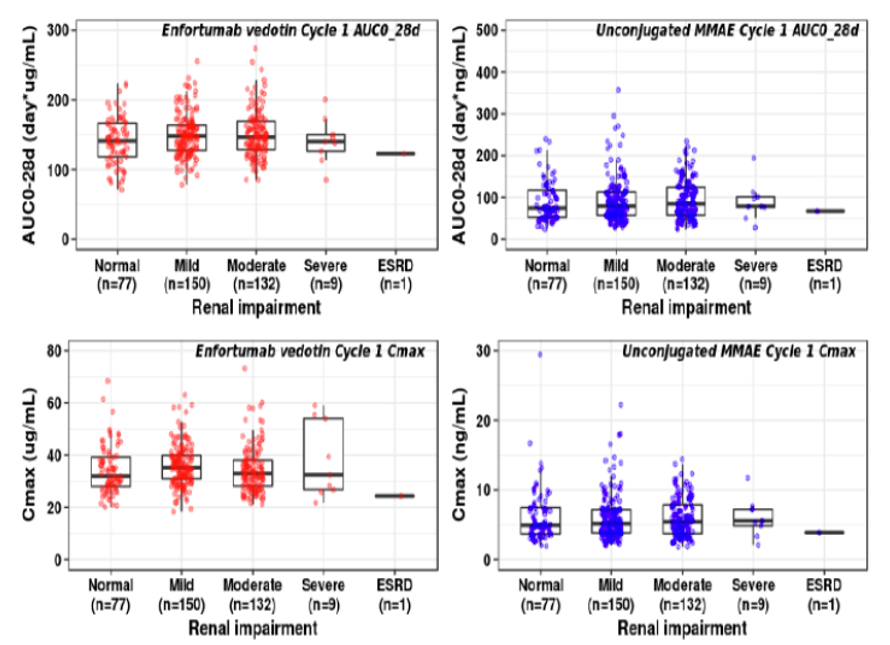
圖6. 腎損傷對Enfortumab和非偶聯MMAE第一周期暴露量的影響[5]群體PK建模和模擬結果顯示,與正常肝功能人群相比,輕度肝損傷人群對Enfortumab和游離MMAE暴露量無明顯差異[5],但未評估中度或重度肝損傷人群。FDA認為其他含有MMAE的ADC藥物,在肝損傷研究中中度或重度肝損傷人群相較于正常肝功能人群,更易發生3級以上不良反應和死亡事件[5]。因此,監管機構建議禁止在中重度肝損人群中使用Enfortumab,并在說明書中加以規定。綜上可見,Enfortumab除了檢測ADC以外,還對有效載荷EMMA濃度進行檢測,并均建立了群體PK模型和ER分析,其復雜程度高于常規的小分子藥物,在臨床藥理方面的考量存在差異,在最佳劑量的選擇上需更加謹慎。聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容