粒度和粒度分布是原輔料以及藥物顆粒的關鍵質量屬性,對藥物制劑的生產可行性和產品性能有著重要的影響。本文旨在通過對口服固體制劑粒度和粒度分布與生產可行性、產品性能之間的相關性進行剖析,提出粒度和粒度分布分析方法開發和驗證過程的關鍵考慮因素,并探討如何建立合理的粒度分布控制標準,為藥物研發和生產階段進行粒度和粒度分布研究提供參考。
在口服固體制劑的制備過程中,藥物粉體的粒度分布(particle size distribution,PSD)是產品開發和質量控制的關鍵參數之一,幾乎影響整個生產過程。粉體的粒度對于產品的溶出度、生物利用度以及穩定性等性能具有顯著影響。例如,減小難溶性藥物顆粒粒度時,比表面積增加,使得溶劑更易包圍顆粒,顯著提高溶出速率[1]。此外,原輔料的粒度及粒度分布對于物料的流動性、可壓性、混合均勻性、劑量單位均勻性等特性也會造成影響。例如,微粉化后的原料藥顆粒之間靜電作用較強,流動性較差,可能出現顆粒結團現象,造成原輔料混合不均勻[2]。藥物粉體的粒度分布對于產品的質量和有效性均有深遠的影響,應在藥物研發及生產過程的整個生命周期中予以關注,并建立有效的控制措施。目前,藥品質量管理的理念已經從“藥品質量是通過檢驗來控制”到“藥品質量是通過生產過程控制來實現”,進入到“藥品質量是通過良好的設計而生產出來”[即“質量源于設計”(quality by design,QbD)]的階段[3]。這也就意味著藥品從研發開始就要考慮不同因素對最終產品質量的影響。QbD理念的引入提示藥品生產企業應該基于藥物的處方和生產工藝,評估原料藥、輔料以及藥物粉體的粒度分布對產品關鍵質量屬性(critical quality attribute,CQA)的影響。如果在藥物生產的不同工序階段(例如,過篩、混合、制粒、壓片、包衣等工序),某些原料藥或藥物粉體被認為是對CQA有影響的關鍵物料屬性(critical material attribute,CMA),則有必要對這些物料的粒度分布進行研究,并根據風險評估結果建立必要的控制措施。此外,開發合理的粒度分布分析方法是進行粒度分布研究的基礎。QbD的策略不僅可以應用于藥品生產全過程,也可拓展到分析方法的開發和驗證過程中進行應用[4]。粒度分布研究方法不同于有關物質檢測等方法,其方法重現性受取樣、分散介質等多種因素的影響。基于QbD理念進行粒度分布分析方法的設計和確認,可保證分析方法的科學性、準確性和可行性,通過分析方法的持續確證,始終如一提供準確的分析數據,有效控制藥品質量。本文旨在探討口服固體制劑藥物粉末的粒度分布與生產可行性、產品性能之間的相關性,重點關注開發粒度分布分析方法和驗證過程的關鍵考慮因素,以及如何建立合理的粒度分布控制標準的實踐應用。粒度分布是制備過程中非常重要的質量指標,對于藥物制劑的生產可行性和產品性能有著顯著的影響。首先,粒度分布的合理控制可以提高藥品的生產可行性。在制藥過程中,顆粒大小不同會影響材料的流動性、混合均勻度以及成型壓力等質量指標或生產參數,從而進一步影響產品的生產可行性。其次,粒度分布與產品性能密切相關。顆粒較小會導致表面積增大,從而使得藥品溶解度更高,吸收更快且更徹底,但同時也可能引發顆粒聚集、崩解不良等問題;顆粒較大則有助于減少顆粒聚集、保持穩定性,但可能導致疏松性差、難以混合等問題。因此,只有在對粒度分布進行全面有效地控制后,才能生產出合格的高質量藥品。應該根據所生產的藥品類型和特點,結合現有的制造工藝和設備,合理分析粒度分布與生產可行性、產品性能的相關性,以此幫助評估何時需要對粒度分布進行研究,并采取措施確保工藝穩定和產品質量可控。
原料藥的粒度是制劑開發中的關鍵物料屬性,對藥物的粉體學特性、制劑的均勻性、原料藥和制劑的化學穩定性以及制劑的溶出性能產生影響,進而影響制劑在人體內的釋放和吸收,最終影響制劑的生物利用度和藥物療效。藥物溶出的規律通常可通過Noeys-Whitney方程式來描述。影響溶出速率的主要因素包括顆粒的表面積、藥物的溶解度和溶出速率常數,其中溶出速率常數與擴散系數、介質體積和擴散層厚度相關。對于屬于生物藥劑學分類系統(biopharmaceutical classification system,BCS)2/4的低溶解性藥物,常常采用微粉化工藝對原料藥進行預處理,以減小顆粒大小,增大表面積S,從而提高藥物的溶解速率,最終提高制劑的溶出速率和生物利用度。
K:溶出速度常數;D:藥物擴散系數;h:擴散邊界厚度;V:溶出介質的量;S:溶質的表面積;Cs:藥物的溶解度;C:溶液主體中藥物濃度,若滿足漏槽條件,則 C=0。隨著藥物顆粒尺寸的減小,相應地會引發粉體學相關問題。顆粒尺寸的減小會增加粉體之間的分子引力和靜電作用力,使得顆粒更容易聚集成團,增加黏結性,同時休止角也增大,從而導致粉體的流動性下降。原料藥的粒度和粒度分布也會影響制劑的含量均勻性。特別是對于小規格制劑而言,其粉體混合不均勻的風險更高。已有研究證明[5],原料藥的粒度是對生產工藝穩定性影響最大的關鍵質量屬性。Rochers等[6]建立了預測模型,用于預估滿足USP<905>含量均勻度要求時,顆粒粒度及粒度分布應達到的控制范圍,證明了原料藥的粒度和粒度分布與制劑的含量均勻性之間存在函數關系。輔料作為制劑的重要組成部分,也從諸多方面影響著產品質量。尤其對于緩控釋制劑中的關鍵輔料,其粒度、微觀形態等可能影響粉體的流動性、可壓性,甚至影響緩釋制劑的釋放行為。羥丙甲纖維素(hypromellose,HPMC)常作為緩控釋制劑的功能性輔料。有研究表明[7],HPMC顆粒大小的調整可能存在“閾值效應”,對某些制劑而言,當HPMC顆粒大小超過關鍵閾值時,其影響表現為更快的體外藥物釋放速度和明顯變化的藥物釋放機制。口服固體制劑常用的生產工藝有粉末直壓、干法制粒和濕法制粒。藥品生產企業應基于原料藥和輔料的性質進行風險評估,選擇合適的生產工藝。
粉末直壓工藝只涉及物料混合和直接壓片兩個步驟,生產過程簡單、節能省時,同時降低工藝條件對產品質量的風險,但對原料藥和輔料的相關性質要求更高。這些性質不僅僅要滿足工藝的生產需求,還需要在生產過程中保持一致。為確保粉體具有適當的粒度分布、密度、流動性以及可壓性,粒度、粒度分布等控制顯得更加重要。例如,在混合不同組分時,如果顆粒的大小差異顯著,可能導致混合物料分層現象。即使最終混合物的均勻度符合標準,但在后續的轉運、儲存或壓片過程中,仍可能發生物料分層或結團現象。為保證生產過程中物料狀態的一致性,有必要對關鍵物料制定粒度控制標準。制粒工藝本質上是將分散的粒子制備成更大顆粒的過程,原料藥與輔料的粒子在一定程度上可以經過“改造”,相較于粉末直壓工藝,制粒工藝對原輔料的性質更具有包容性。然而,與此同時也增加了工藝條件對產品質量帶來的相關風險。后續的壓片過程直接受制粒顆粒的影響,包括顆粒的流動性、可壓性,以及與產品性能相關的藥物溶出度和生物利用度等,均與顆粒粒度分布、孔隙率等性質相關。美國食品藥品監督管理局(FDA)頒布的《Guide to Inspection of Oral Solid Dosage forms: Pre/Post Approval Issues for Development and Validation》[8]中曾指出,顆粒的粒度分布是判斷制粒工藝批間一致性的重要物理參數,尤其對于臨床批次和商業生產批次的對比,或是生產工藝變更前后樣品的對比,粒度分布數據是證明工藝的穩健性和產品質量可比性的重要依據。《美國藥典》(USP)43<711>中規定[9],當藥物的顆粒大小分布較為均勻時,可以通過粒度分布來代替溶出度的測定,間接證明了顆粒的粒度分布對產品質量和有效性的影響。綜上,需綜合考慮原料藥特性、生產工藝與粒度分布的相關性,結合QbD理念進行合理的工藝設計和工藝控制,通過優化處方和生產工藝來改善藥物顆粒的粒度分布,提高藥品的質量和穩定性。《化學藥物制劑基本研究技術指導原則》[10]中對原料藥、輔料和藥物顆粒的粒度均進行了要求,強調了粒度可能對藥物溶解性能、制劑的含量均勻度,或生物利用度及臨床療效產生影響。ICH從QbD角度,在ICH Q6A指南(決策樹#3)中提出了何時需對原料藥制定粒度標準的建議[11],對于影響溶解度、溶出度、生物利用度、制劑工藝、制劑穩定性、含量、制劑外觀等的原料藥,應通過適當方法測定粒度及粒度分布,并建立合理的控制限度。在ICH Q8(R2)[3]指南中提出在藥品開發的過程中需要檢查原料藥的粒度等理化及生物學特性,綜合考慮這些特性間的關聯性。上述指導原則或指南提出了需對粒度進行控制的要求,但未對粒度分析方法及方法學驗證的相關內容進行規定。
各國藥典、ISO13320等文件提供了粒度分析方法及驗證要求的相關內容(見表1)。USP43<786>和<429>章節[9]、《歐洲藥典》(EP)11.0 2.9.31章節[12]明確了粒度分布測定分析方法開發和驗證等相關內容。其中,USP43<429>和EP 11.0 2.9.31基于ISO13320(1999)和ISO9276-1(1998)開發,國內推出了相應的GB/T 19077粒度分析-激光衍射法。目前,ISO13320已更新至2020年版[13]并引入了QbD理念進行分析方法的開發和驗證。《中國藥典》2020年版(四部)通則<0982>[14]對粒度分布測定儀器的一般要求和分析方法進行了簡單介紹,但未明確分析方法驗證等內容。當前國內缺乏粒度分析方法開發和驗證的相關指導原則,然而由于粒度分布是藥物的關鍵質量屬性之一,藥品生產企業應參照國際規定,進行粒度分布研究并提供必要的分析方法學驗證資料,以確保粒度分布測定結果的可靠性。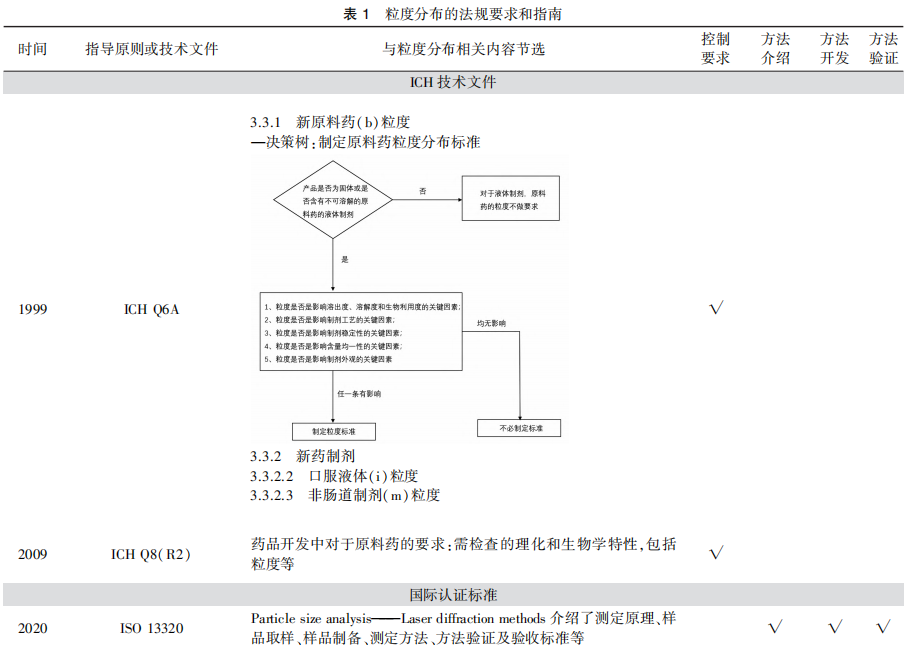

粒度分布的測定方法有篩分法、顯微鏡法、光散射法等,每種方法都有其各自的優缺點,并且適用于不同類型的粒子或顆粒物質。其中,篩分法原理簡單、操作方便,常用于測量較大顆粒的粒度分布。然而,由于篩分法的粒度分布劃分受限于篩網數目的設置,在一定程度上影響了測量結果的準確度,尤其對于難溶性藥物或經評估對產品質量有較大影響的藥物顆粒,即使微小的粒度和粒度分布變化也可能對產品質量產生重大影響,需采用更高準確度的方法來測量粒度和粒度分布。
光散射法中的激光衍射法具備測定范圍廣(0.1~3 000 μm)、快速、自動化等許多優點,特別是在測定極細微顆粒的性能方面表現突出,已經成為目前主流的粒度分布測定方法之一。以下將以激光衍射法為代表,對粒度分布測定方法的開發和驗證進行探討。激光衍射法的工作原理是單色光束照射到顆粒后發生衍射現象,由于衍射光的能量分布與顆粒的大小有關,通過測定衍射光的能量分布,根據米氏散射理論和弗朗霍夫近似理論,可計算出顆粒的粒度分布。根據分散介質的不同,激光衍射法可分為濕法測定(分散介質為液體)和干法測定(分散介質為氣體)。濕法測定用于測定混懸供試品或不溶于分散介質的供試品,干法測定用于測定水溶性或無合適分散介質的固態供試品[14]。濕法測定的粒度范圍寬、測試結果穩定,是更常用的測定方法。但對于容易溶解于分散劑中的顆粒來說,干法通常為唯一選擇,且干法測定速度更快。濕法和干法測定的優勢對比情況詳見表2。
對于任何一種顆粒表征技術來說,從較大的樣品量中選取具有代表性的樣品都是一個挑戰。進行激光衍射法檢測時,采樣問題可能會引起檢測結果的較大偏差,特別是在測定大顆粒樣品或接近粒度分布邊界參數(如D95)時更為明顯。這是因為激光衍射法作為一種基于樣品體積的測量技術,對所選取樣品中粗顆粒數量的微小變化非常敏感。隨著顆粒大小和分布寬度的增加,采樣對重現性的影響也會增加。因此,為了確保可重現的結果,需要保證足夠量的取樣量(通常大于1~2 g)[15]。隨著顆粒尺寸的增加,達到可重現結果所需的最小樣品量也需隨之增加。此外,不同的取樣方法對檢測結果的影響有很大差異,選擇合適的取樣設備將大大提高粒度測定的重現性[16]。USP43<429>和ISO13320建議采用例如旋轉縮分器或錐形四分法等樣品分離技術進行代表性樣品制備。ISO 14488[17]提供了Spinning Riffler、Static Riffle Divider、Coning and Quartering、Increment Division Method等多種樣品分離技術的適用范圍、使用建議等詳細信息,可供參考研究。建立合適的分散體系對于樣品的檢測也是至關重要的。樣品分散的目的是盡可能地削弱顆粒之間的聚集,尤其對于粒度小或是黏度大等易發生聚集的顆粒,應采用合適的分散介質和分散條件使顆粒能均勻分散,同時也應避免過度使用分散能量造成顆粒的損耗,導致檢測結果的偏差。關于氣體中的分散,應使用適當的干式分散器。對于顆粒較大、流動性較好的顆粒,通常通過重力自由下落足夠實現分散。對于聚集的顆粒,通常需要利用壓縮氣體或真空條件,在顆粒之間或顆粒與器壁之間發生碰撞的剪切應力作用下進行分散。關于液體中的分散,可參考ISO 14887[18]進行液體分散介質的選擇。通常可以使用攪拌或超聲來促進顆粒在液體中適當分散,可以借助顯微鏡對分散體系的質量進行初步判定。此外,需關注分散介質體積等因素對測量結果的影響。液體分散介質的體積隨著待測顆粒粒度分布的寬度增大而增加[19]。例如,要使D90的精密度RSD達到3%以內,對于0.3 mL體積、粒度范圍為2~200 μm范圍的待測顆粒,至少需要500 mL懸浮液才能達到目標精密度[13]。粒度分布研究可根據目標精密度來確定適當分散條件,以保證測定結果的重現性。為了獲得可重復的粒度測量結果,需要確保樣品處于穩定的分散狀態。對于濕法分散,能量來源于分散池中的攪拌器、泵和超聲波。通過調整攪拌速度、泵速和超聲強度等參數,可以有效地實現顆粒的均勻分散,并避免顆粒破碎。此外,還需要根據顆粒的大小和性質確定遮光度范圍。濕法測量和干法測量所需要的供試品量通常應分別達到檢測器遮光度范圍的8%~20%和0.5%~5%[14]。干法分散的能量主要來源為壓縮空氣流。ISO 13320指出,理想的分散壓力可使粒度在一定范圍內保持不變,表明顆粒已均勻分散且未被破壞。但是,理想狀態較難實現。因此,可將干法分散的結果與充分分散的濕法測量結果進行比較,當兩種方法結果接近一致時,說明選取的分散壓力滿足測定要求。此外,進樣速度、測量時間、文丘里管能量等因素也會導致結果的變異。綜上所述,任何顆粒表征系統要獲得可重復的結果,需綜合考慮取樣的代表性、穩定的分散狀態以及適當的測量條件。在分析方法開發過程中,應根據QbD理念確定檢測目的,結合樣品性質對影響因素進行風險評估,并確定關鍵測量參數。此外,還需要關注分析儀器類型和光學模型等方面的信息。選擇不合適的光學模型或折射率值可能會導致粒度分布結果的顯著偏差[4]。為了獲得更好的重現性,有必要明確光學模型和光學參數等信息。同時,建議將粒度分布分析方法開發過程的研究數據納入申報材料,并在質量標準的粒度分布項中提供詳細的取樣、樣品分散和測量條件方面的具體操作描述。由于粒度分析方法的獨特性,其方法驗證內容與ICH Q2A、ICH Q2B和USP43通則<1225>中描述的典型的驗證內容有所不同。ICH定義的驗證參數如專屬性、定量限、檢出限、線性、范圍等,在粒度分析方法的驗證中通常不適用。粒度分析方法的驗證通常需要對精密度(重復性、中間精密度)和方法耐用性進行驗證。USP43<429>、EP11.0 2.9.13、《中國藥典》2020年版<0982>第三法(光散射法)以及ISO133320對分析方法驗證內容的具體要求可參見表3。從表中可以看出,USP和EP關于粒度分布方法學驗證部分的要求基本相同,明確了精密度中重復性的驗證要求,尚未對中間精密度和耐用性的驗證要求進行規定。精密度中的重復性是指實驗室內同一操作人員在短時間內使用相同儀器進行驗證的過程,中間精密度則是指在同一實驗室,由不同實驗人員在不同時間使用不同儀器進行測定的過程,進行中間精密度考察時,可考慮參考重復性的驗證要求。對于分析方法準確性的評估,可考慮通過測定標準粒子進行儀器校正來證明。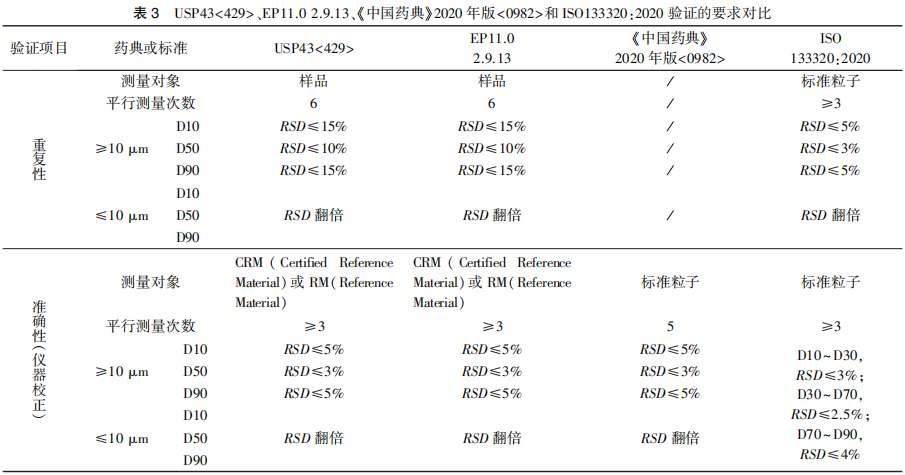
方法的耐用性是指在有意對測試條件進行微小變化后,方法仍能保持不受影響的能力,為日常測試提供正常使用范圍的可靠性指標。由于激光衍射法的干法測量和濕法測量的測試參數有所不同,兩種方法的耐用性驗證內容也有所區別。建議在粒度分析方法開發階段,對可能影響方法檢測的參數進行評估,確定最優參數,并通過調整這些參數的變化來評價方法的耐用性。推薦對表4中列舉的參數進行耐用性驗證。
目前,《中國藥典》2020年版<0982>第三法(光散射法)在測試的相關內容上相對來說比較簡單,僅針對干、濕法不同的檢測提出了一些建議,由于技術的更新換代,部分內容尚有更新空間。建議參考USP43<429>和EP11.0 2.9.31的要求進行方法驗證。藥典中的方法驗證的接受限度相對較寬,可以根據實際樣品調整方法重復性、耐用性要求。應評估粒子或藥物顆粒對產品質量的影響,對于被判定為關鍵質量屬性的顆粒,則有必要考慮建立粒度及粒度分布的控制措施,以保證產品質量的穩定性和生產可行性。企業在制定粒度分布控制標準時,通常僅對D50或D90進行控制。單獨控制中值粒度或邊界粒度不能完整體現顆粒的粒度分布情況,尤其對于粒度分布寬的顆粒而言,應考慮對整體的粒度分布進行控制,即進行D10、D50和D90的控制。此外,企業通常僅設置D50或D90的上限限度,在沒有提供充分科學依據的情況下,上限限度可能不能對粒度分布進行有效控制。例如,原料藥微粉化技術可顯著提高硝苯地平緩釋片的體外溶出度,但當D90小于3.471 μm時,制劑出現了突釋現象,影響了硝苯地平緩釋片的緩釋效果[19]。根據粒度分布與生產可行性、產品性能相關性的研究結果,考慮制定D10、D50和D90合理的上限和下限控制限度,有利于為質量控制提供可靠的保障。
藥物粉體的粒度和粒度分布是影響整個藥物制造過程的基礎,粒度的特性決定了成品的多種性質。藥物粉體的粒度分布可以極大的影響藥物的生產可行性(如流動性、壓縮性、均勻性、穩定性等)和產品性能(如溶解度、生物利用度等),因此,粒度分布被認為是實現藥品目標質量指標(QTPP)的關鍵物質屬性。粒度分布的測量是一個復雜的過程,涉及采樣的代表性、分散體系的穩定性、測量參數的合理性等方面。粒度分析方法開發和驗證,應基于代表性的樣品進行,通過分析顆粒的性質,建立適宜的分散體系并設置合理的測量條件。將QbD方法運用到粒度分布分析方法開發和驗證,有助于減少方法的變異性,獲得可重復性的測量結果。可考慮對D10、D50和D90分別設置上限和下限來控制粒度分布,更有利于充分監測整體粒度分布的情況,有效保障產品質量。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容






