根據(jù)全球臨床試驗收錄網(wǎng)站clinicaltrials和中國臨床試驗登記平臺chinadrugtrials,11月共18款創(chuàng)新藥進入III期階段,其中8款來自中國藥企。這些在研藥物針對的疾病領(lǐng)域主要是腫瘤,覆蓋靶點不乏JAK1、CLDN18.2、KRAS G12C等熱門靶點,也包括CD40L和CYP11A1這類新興靶點。本文篩選其中7款重點產(chǎn)品加以介紹。2023年11月進入III期階段的創(chuàng)新藥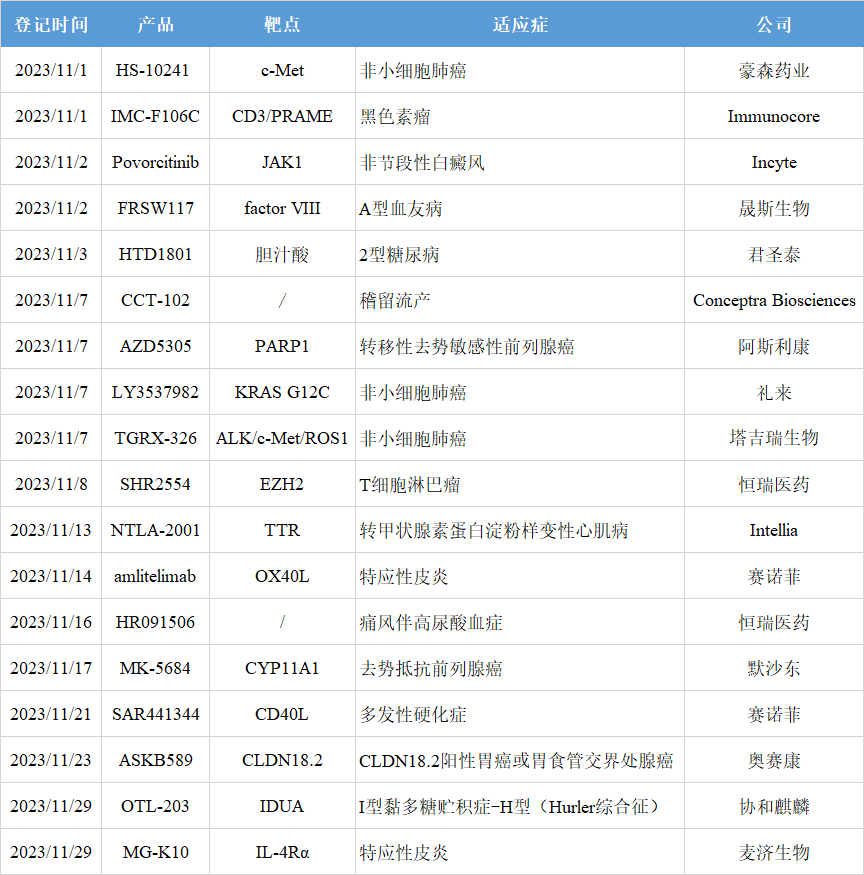
注:1.信息來源于clinicaltrials和chinadrugtrials。2.僅登記創(chuàng)新藥,微創(chuàng)新和生物類似藥不包括在內(nèi)。3.同一款藥物在同一天啟動多項III期臨床,適應(yīng)癥合并記錄;同一款藥物在一個月內(nèi)啟動多項III期臨床,以最早登記者準。4.PRAME:黑色素瘤中優(yōu)先表達抗原;EZH2:調(diào)味增強子同源物2;TTR:轉(zhuǎn)甲狀腺素蛋白;OX40L:也稱為CD252,是OX40的配體;CYP11A1:細胞色素P450家族11亞家族A成員1;CD40L:也稱為CD154,是CD40的配體;IDUA:艾杜糖苷酶。JAK1/2抑制劑蘆可替尼乳膏在白癜風適應(yīng)癥上的成功為JAK抑制劑賽道的激烈競爭找到了另一條出路,此后便有多款高選擇性JAK抑制劑加入攻克白癜風的隊伍,包括JAK3抑制劑利特昔替尼、JAK1抑制劑Povorcitinib和JAK1抑制劑烏帕替尼。開展白癜風III期研究的JAK抑制劑
Povorcitinib是第一款啟動白癜風III期臨床的JAK1抑制劑。今年10月,Incyte在歐洲皮膚病和性病學(xué)會(EADV)大會上公布了Povorcitinib治療廣泛性非節(jié)段性白癜風的IIb期研究的52周數(shù)據(jù)。結(jié)果顯示,45mg組和75mg組患者的T-VASI分別改善了42.7%和41.3%,F(xiàn)-VASI分別改善了63.8%和64.4%。在關(guān)鍵次要終點上,45mg組和75mg組分別有37.0%和37.9%的患者達到T-VASI 50。安全性方面,最常見的治療期間不良事件(TEAE)是COVID-19(36.1%)、血肌酸磷酸激酶升高(13.3%)、痤瘡(12.0%)、疲勞(10.8%)和頭痛(9.6%)。適應(yīng)癥:轉(zhuǎn)移性去勢敏感性前列腺癌目前,全球已有7款非選擇性PARP抑制劑(包括1款復(fù)方)獲批上市,還有一款已提交上市申請,市場競爭非常激烈。
非選擇性PARP抑制劑幾乎都會對PARP2產(chǎn)生抑制效果,但有研究表明,PARP2對腫瘤抑制的影響微乎其微,反而可能導(dǎo)致血液毒性。因而,提高對PARP1的選擇性成為了PARP抑制劑賽道的突圍選擇。AZD5305(saruparib)是目前開發(fā)進度最快的一款PARP1抑制劑,正在開展聯(lián)合醫(yī)生選擇(醋酸阿比特龍/達羅他胺/恩扎盧胺)對比安慰劑聯(lián)合醫(yī)生選擇治療轉(zhuǎn)移性去勢敏感性前列腺癌(mCSPC)患者的III期EvoPAR-Prostate01研究(n=1800)。研究的主要終點為放射學(xué)無進展生存期(rPFS)。
LY3537982是禮來差異化開發(fā)的新一代KRAS G12C抑制劑,對KRAS G12C突變H358肺癌細胞的抑制活性遠超已上市產(chǎn)品sotorasib和adagrasib。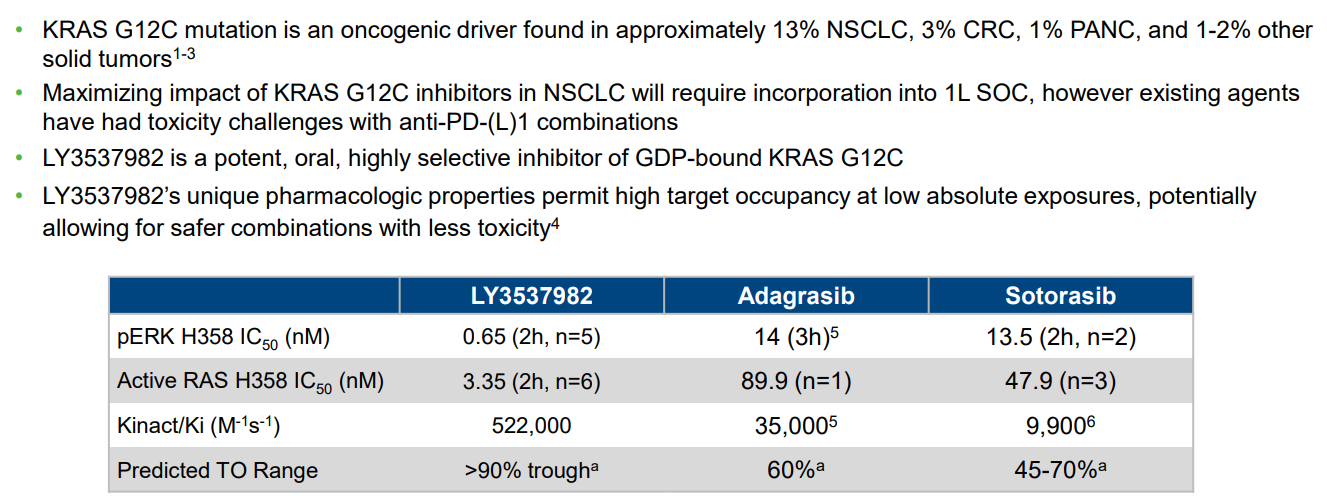
今年4月,禮來在AACR大會上公布了LY3537982的I期研究結(jié)果。截至2023年1月3日,該研究的劑量遞增部分共納入了84例接受過中位3線(0-9)系統(tǒng)治療的患者,其中包括26例NSCLC,23例結(jié)直腸癌(CRC),14例胰腺癌(PANC)以及21例其它癌種。該部分患者接受單藥LY3537982治療。總體來看,LY3537982的安全性良好,沒有觀察到劑量限制性毒性(DLT),最大耐受性劑量(MTD)也未達到。最常見的(發(fā)生率≥10%)TEAE是腹瀉(36%)、乏力(17%)、便秘(16%)、惡心(16%)和轉(zhuǎn)氨酶升高(12%),且大多數(shù)為1級。4例(4.8%)患者出現(xiàn)3級以上治療相關(guān)不良事件(TRAE),1例患者因TRAE降低治療劑量或停藥。7例患者此前曾因毒性而停用其它KRAS G12C抑制劑,但在該研究中只出現(xiàn)了2級以下TRAE,且目前仍在接受LY3537982治療。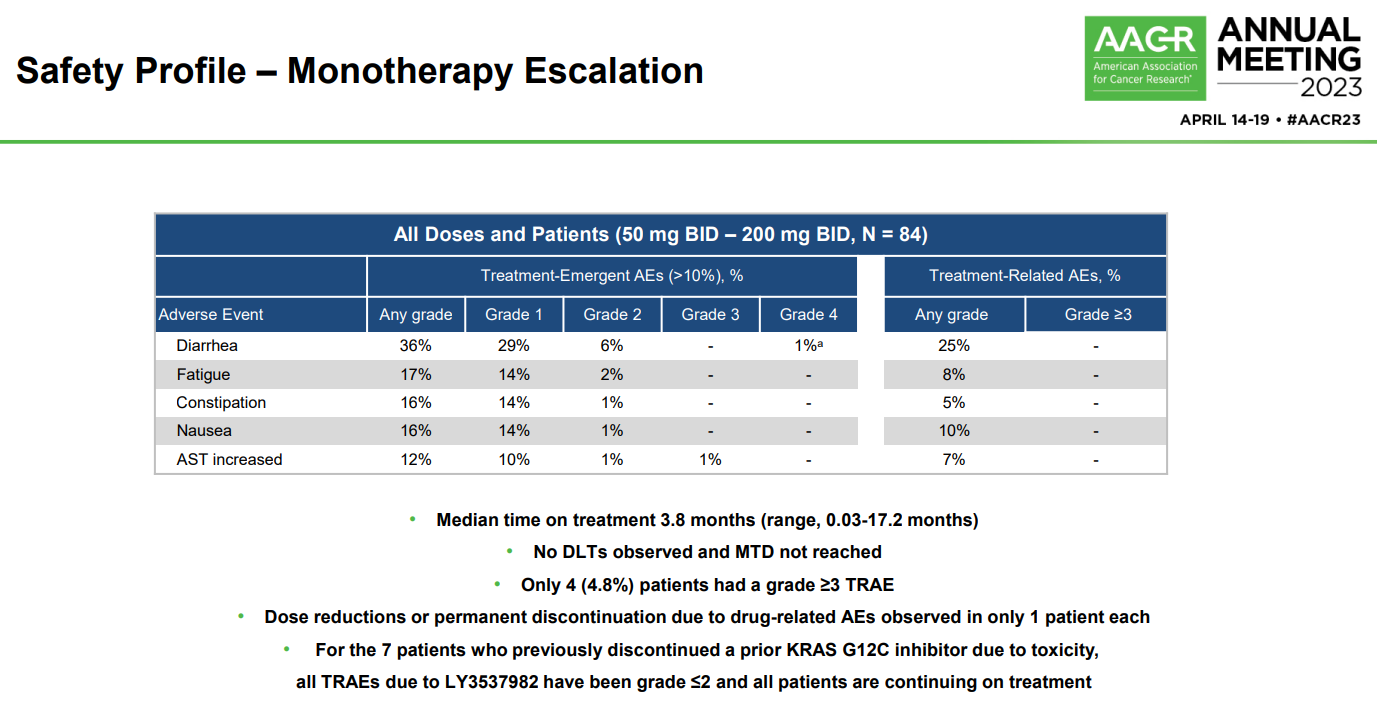
在NSCLC隊列,8例初治患者的客觀緩解率(ORR)為38%(3/8),疾病控制率(DCR)為88%(7/8)。14例經(jīng)治患者的ORR為7%,DCR為64%(9/14)。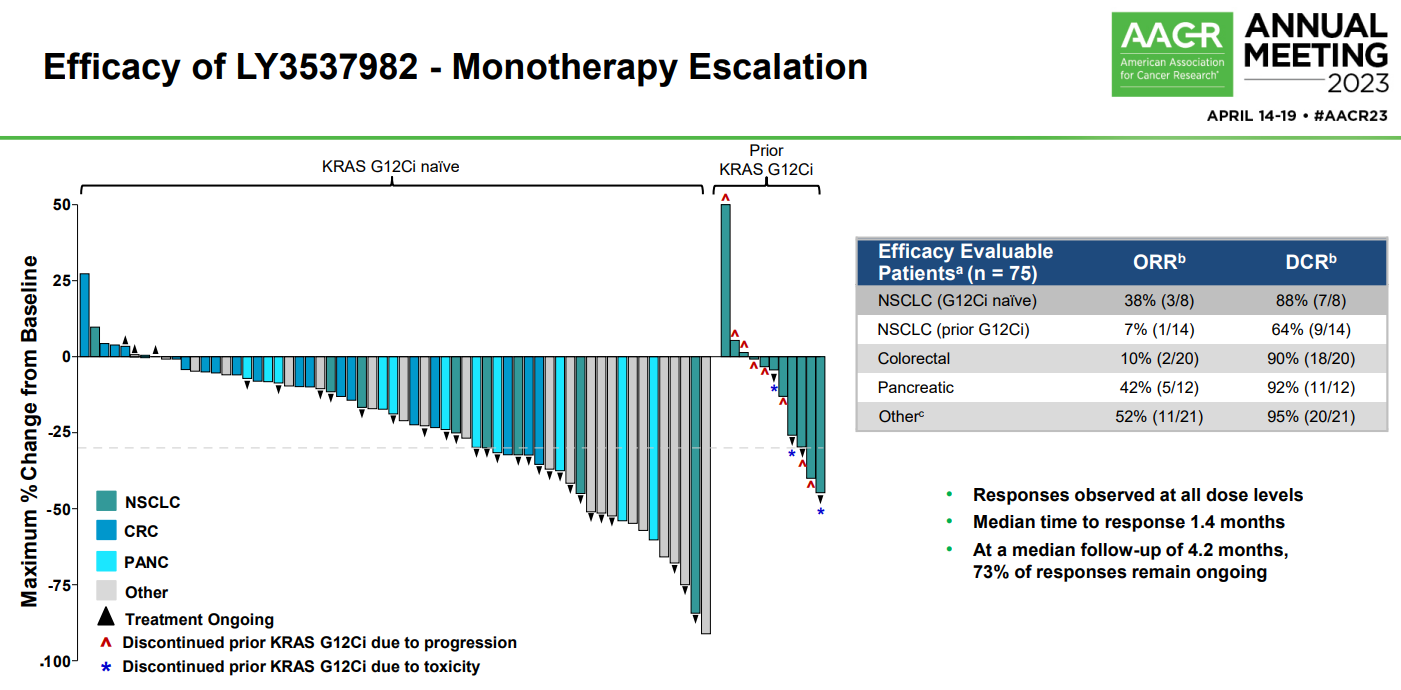 來源:2023 AACR大會
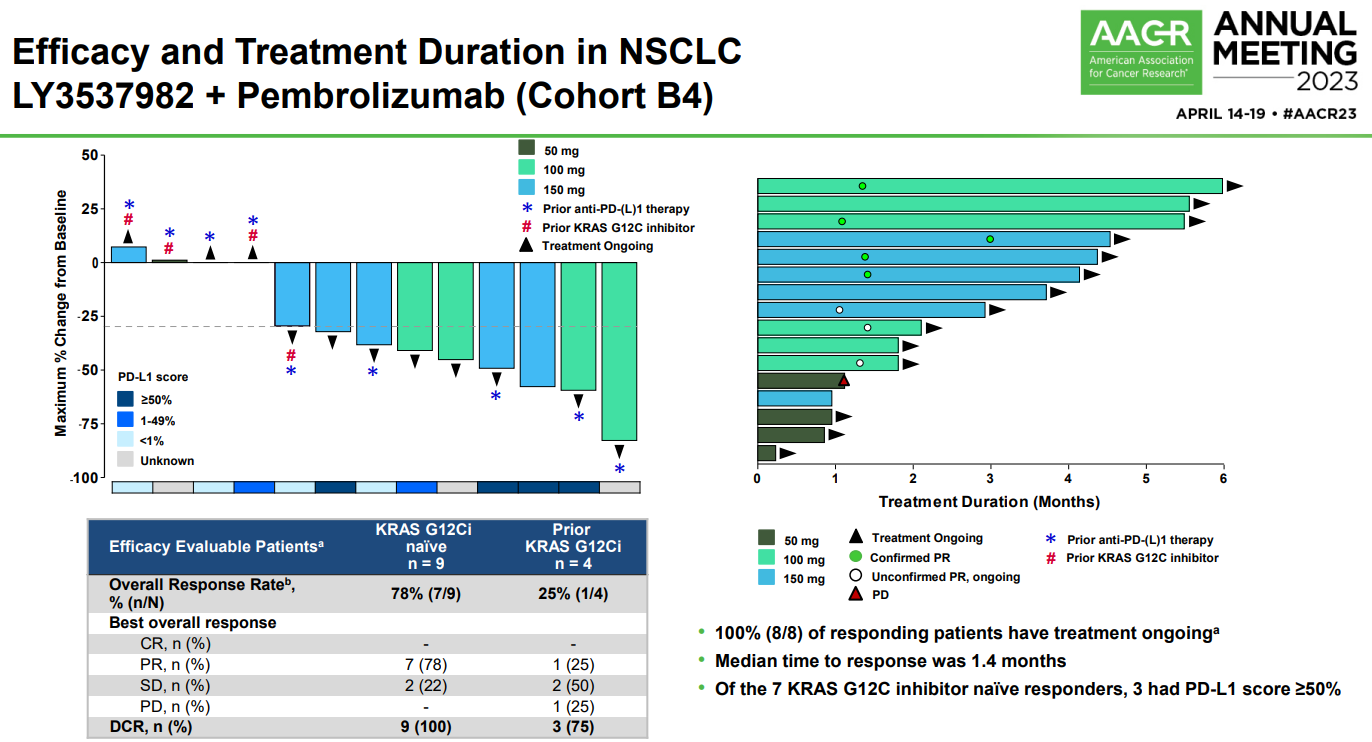
來源:2023 AACR大會在劑量擴展部分,16例NSCLC患者接受LY3537982+帕博利珠單抗治療,其中初治患者的ORR為78%(7/9),DCR為100%,經(jīng)治患者的ORR為25%(1/4),DCR為75%(3/4)。
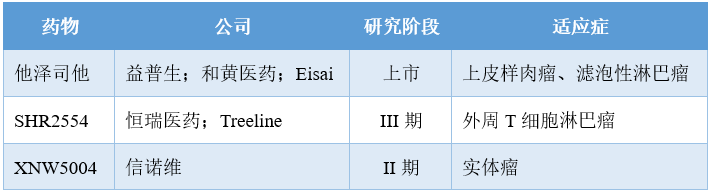
SHR2554是恒瑞醫(yī)藥自主研發(fā)的新型、高效、選擇性口服EZH2抑制劑,可以選擇性強效抑制野生型和突變型EZH2酶活性。全球共7款臨床在研選擇性EZH2抑制劑,而SHR2554是首個進入III期階段的國產(chǎn)EZH2抑制劑。中后期在研選擇性EZH2抑制劑
I期研究(n=113)結(jié)果顯示,67%的400mg劑量組患者和17%的350mg劑量組患者出現(xiàn)DLT。最常見的3級或4級TRAE是血小板計數(shù)減少(18%)、中性粒細胞計數(shù)減少(9%)、白細胞計數(shù)減少(8%)和貧血(6%)。18例患者發(fā)生嚴重TRAE,2例患者因TRAE死亡。療效方面,43%(46/107)的患者實現(xiàn)總體緩解。此外,在22例可評估療效的外周T細胞淋巴瘤(PTCL)患者中,14例(64%)達到總體緩解,估計的PFS為8.5個月;57%(4/7)的PTCL非特指型患者達到總體緩解,估計的DOR為3.3個月,PFS為5.5個月;67%(10/15)的血管免疫母細胞性T細胞淋巴瘤 (AITL) 患者達到總體緩解,未達到DOR,未達到PFS。今年1月,SHR2554被NMPA納入突破性療法,用于治療難治性PTCL。一個月后,恒瑞將SHR2554在除大中華區(qū)以外的開發(fā)、生產(chǎn)和商業(yè)化獨占權(quán)利有償許可給Treeline公司,總交易額為6.95億美元。
前列腺癌是全球第四大常見癌癥,也是男性第二大常見癌癥。前列腺癌在擴散到前列腺以外時即轉(zhuǎn)移性去勢抵抗前列腺癌(mCRPC),這類患者對雄激素受體(AR)抑制劑沒有反應(yīng)。在臨床試驗中,mCRPC患者的總生存期約為3年,而在生活中甚至更短。
研究表明,類固醇激素以及其它可以激活A(yù)R信號通路的前體與前列腺癌的發(fā)展和激素耐藥相關(guān)。這也是mCRPC患者需要激素療法和AR抑制劑以外的治療選擇的原因。
CYP11A1是一個非常小眾的靶點,其作用在于可以抑制類固醇的生物合成過程。全球僅兩款在研藥物,MK-5684便是其中一款。
II期研究結(jié)果顯示,45例mCRPC患者接受MK-5684+醋酸氟氫可的松+地塞米松治療后,超過50%患者的PSA(前列腺特異性抗原)降低了50%以上。在17例可評估療效的患者中,至少有4例實現(xiàn)了部分緩解(PR)。
基于上述積極結(jié)果,默沙東啟動了兩項III期臨床試驗,分別探索MK-5684作為mCRPC患者的二線治療和三線治療的潛力。
SAR441344(frexalimab)可阻斷適應(yīng)性免疫細胞(T/B細胞)和先天性免疫細胞(巨噬細胞和樹突狀細胞)激活并發(fā)揮功能必需的CD40/CD40L共刺激通路,同時不會耗竭淋巴細胞,以此達到治療多發(fā)性硬化癥的急性和慢性神經(jīng)炎癥目的。該產(chǎn)品的開發(fā)進度在CD40L賽道處于第一梯隊,有望成為該疾病領(lǐng)域首款CD40L靶向藥物。后期在研CD40L靶向藥物
在II期研究中,frexalimab可將MS患者的新釓增強T1大腦病灶面積減少89%。若III期研究順利完成,賽諾菲計劃在2025年提交frexalimab用于治療多發(fā)性硬化癥的上市申請。除此之外,賽諾菲也另辟蹊徑探索該藥物在保護1型糖尿病患者的胰島β細胞功能上的潛力,似有將其與用于延緩1型糖尿病進展的teplizumab(商品名:Tzield)打組合拳之意。適應(yīng)癥:CLDN18.2陽性胃癌或胃食管交界處腺癌ASKB589注射液是AskGene Pharma自主研發(fā)的、擁有國際自主知識產(chǎn)權(quán)的ADCC增強型第二代抗CLDN18.2人源化單抗,研發(fā)進度與安斯泰來zolbetuximab和創(chuàng)勝集團osemitamab同處于全球前三家。一項I/II期研究的劑量擴展部分結(jié)果顯示,有可測量病灶且至少有過一次治療后腫瘤評估的CLDN18.2中高表達患者接受6mg/kg和10mg/kg的ASKB589聯(lián)合CAPOX(奧沙利鉑+卡培他濱)治療后,經(jīng)研究者確認的客觀緩解率(cORR)為79.2%, 疾病控制率(DCR)達95.8%。CLDN18.2賽道的競爭已進入白熱化階段,多達68款靶向藥物處于臨床階段,其中多數(shù)為抗體藥物和ADC藥物。先驅(qū)者zolbetuximab已率先沖刺終點,追隨者能爭取多少市場份額,值得期待一下。聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容





 來源:2023 AACR大會
來源:2023 AACR大會