剛,NMPA發(fā)布2023年11月13日藥品批準(zhǔn)證明文件送達(dá)信息,本批次共有118個受理號獲批,其中7個為一致性評價受理號,過評品種為:海南海靈化學(xué)制藥有限公司,注射用頭孢哌酮鈉舒巴坦鈉北京市永康藥業(yè)有限公司,重酒石酸間羥胺注射液浙江遠(yuǎn)力健藥業(yè)有限責(zé)任公司,瑞巴派特片本次另有15個上市申請受理號獲批,涉及9個品種,如:江蘇康緣藥業(yè)的吡侖帕奈片;成都錦華藥業(yè)的他達(dá)拉非片;阿斯利康藥業(yè)(中國)的達(dá)格列凈片以及此前NMPA公告的合源生物的納基奧侖賽注射液(用于治療成人復(fù)發(fā)或難治性B細(xì)胞急性淋巴細(xì)胞白血病)、羅氏(中國)的格菲妥單抗注射液(用于治療既往接受過至少兩線系統(tǒng)性治療的復(fù)發(fā)或難治性彌漫大B細(xì)胞淋巴瘤成人患者)等。此外,阿斯利康投資(中國)的度伐利尤單抗注射液新適應(yīng)癥獲批,推測此適應(yīng)癥為聯(lián)合化療一線治療局部晚期或轉(zhuǎn)移性膽道癌(BTC)。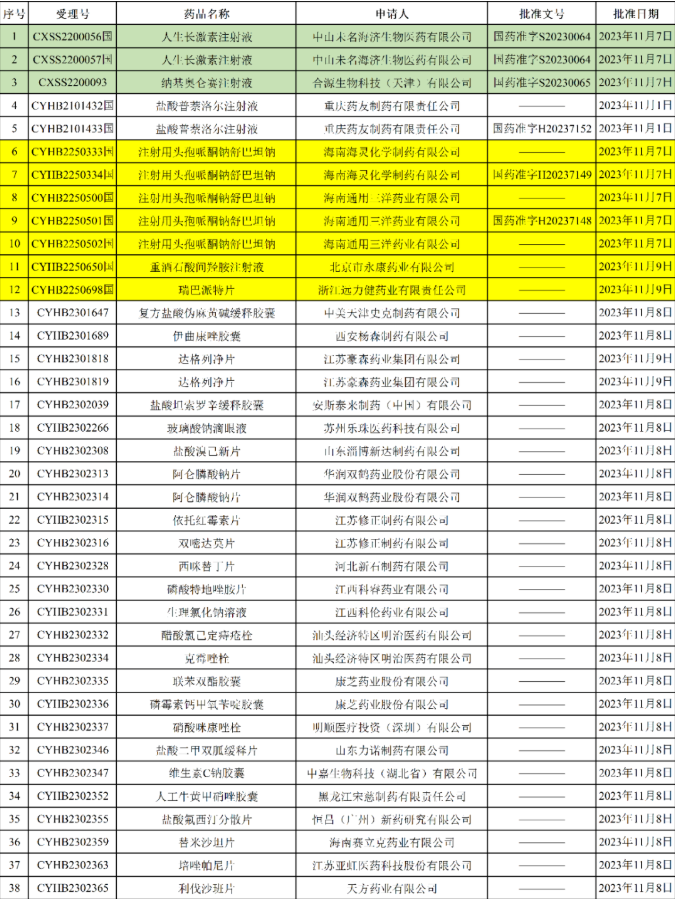


聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容





