
2023-11-02 09:54:25來源:霍德生物瀏覽量:1041
監(jiān)管趨勢
01 CDE發(fā)布《人源干細胞產品非臨床研究技術指導原則(征求意見稿)》

為規(guī)范和指導人源干細胞產品的非臨床研究,國家藥品監(jiān)督管理局藥品審評中心在前期調研的基礎上,結合國內外相關法規(guī)和技術要求,以及對該類產品當前技術發(fā)展和科學的認知,撰寫形成了《人源干細胞產品非臨床研究技術指導原則(征求意見稿)》,2023年10月7日公開征求意見和建議。征求意見時限為自發(fā)布之日起1個月。
信息來源于CDE
02 國家藥監(jiān)局:已批準100余個細胞和基因治療產品開展臨床試驗
2023年10月7日,國家藥監(jiān)局網站發(fā)布《關于政協(xié)第十四屆全國委員會第一次會議第02469號(醫(yī)療衛(wèi)生類215號)提案答復的函》(以下簡稱《答復》)。《答復》指出,為規(guī)范和推動我國細胞和基因治療等精準醫(yī)學產品的研發(fā)和注冊申報,自2019年開始,國家藥監(jiān)局持續(xù)開展包括腫瘤主動免疫治療產品在內的生物醫(yī)藥新技術產品的監(jiān)管科學和評價體系研究。經過廣泛調研和專家研討,發(fā)布了免疫細胞治療產品、溶瘤病毒、基因治療等產品研發(fā)相關的藥學、非臨床和臨床試驗技術指南,并于2023年4月發(fā)布《腫瘤主動免疫治療產品臨床試驗技術指導原則》。截至目前,國家藥監(jiān)局已批準100余個細胞和基因治療產品開展臨床試驗,其中包括多種技術路線的個體化腫瘤主動免疫治療產品。
信息來源于國家藥監(jiān)局
03 Cell Prolif | 《人神經干細胞》團體標準發(fā)表

2023年10月18日,國際期刊Cell Proliferation發(fā)表了《人神經干細胞》團體標準,其是由中國干細胞研究學會專家共同起草并達成共識的第一個中國標準。該標準規(guī)定了人神經干細胞(hNSCs)的技術要求、測試方法、測試規(guī)定、使用說明、標簽要求、包裝要求、貯存要求、運輸要求和廢棄物處理要求,適用于hNSCs的質量控制。該標準最初由中國細胞生物學學會于2022年8月30日發(fā)布。希望該標準的出版能促進機構的建立、接受和執(zhí)行適當的協(xié)議,并加速國際標準化的hNSCs的臨床開發(fā)和治療應用。
信息來源于Cell Proliferation期刊
04 Cell Stem Cell | 彭耀進/高建超解析中國司法對干細胞干預監(jiān)管屬性的認知

2023年10月5日,中國科學院動物研究所、北京干細胞與再生醫(yī)學研究院彭耀進研究團隊與國家藥品監(jiān)督管理局藥品評價中心高建超團隊合作,在Cell Stem Cell期刊發(fā)表了題為《The Variability of Judicial Decisions in the Stem Cell Industry in China》的政策論文。該研究首次通過分析案例,探索中國司法對干細胞監(jiān)管屬性的理解和態(tài)度,分析判決的潛在邏輯規(guī)律和成因,并評估其對產業(yè)、學術界和公眾的影響,提出了一系列針對性和可行的建議,以促進干細胞相關司法實踐與領域健康發(fā)展之間的良性互動與平衡。這項研究為探索其他前沿生物醫(yī)藥領域的法律問題提供了有益的參考路徑,希望推動解決干細胞轉化監(jiān)管的現實難題,推動高質量、可持續(xù)發(fā)展的干細胞研究和轉化。
信息來源于Cell Stem Cell期刊
05 科技部發(fā)布《科技倫理審查辦法(試行)》

2023年10月8日,由科技部、教育部、工業(yè)和信息化部等十部門聯(lián)合印發(fā)的《科技倫理審查辦法(試行)》正式公布,意在規(guī)范科學研究、技術開發(fā)等科技活動的科技倫理審查工作,強化科技倫理風險防控,促進負責任創(chuàng)新。
信息來源于科技部
06 CDE發(fā)布關于《藥物臨床試驗樣本量估計指導原則(征求意見稿)》公開征求意見的通知
樣本量估計是藥物臨床試驗設計的重要組成部分,也是確保研究具有合理性、準確性、可靠性和完整性的重要手段。通常,臨床試驗的樣本量必須足夠大,以可靠地回答研究假設所針對的臨床問題。鑒于臨床試驗樣本量估計的復雜性和重要性,藥品審評中心組織起草了《藥物臨床試驗樣本量估計指導原則(征求意見稿)》,2023年10月30日公開征求意見。征求意見時限為自發(fā)布之日起1個月。
信息來源于CDE
07 國家藥監(jiān)局 國家衛(wèi)生健康委關于發(fā)布實施《中華人民共和國藥典》(2020年版)第一增補本的公告(2023年第126號)
《中華人民共和國藥典》(2020年版)第一增補本已編制完成,2023年10月12日發(fā)布,自2024年3月12日起施行。
相關增補內容包括:修訂生物制品通則《生物制品生產用原材料及輔料質量控制》、《生物制品生產檢定用菌毒種管理及質量控制》;新增通則3309《體外熱原檢查法(報告基因法)》、9404《基于基因修飾細胞系的生物檢定法指導原則》、9406《細胞類制品微生物檢查指導原則》;修改通則和技術指導原則3601《生物制品生產及檢定用實驗動物質量控制》等。
信息來源于國家藥監(jiān)局
08 CDE關于發(fā)布《藥物臨床試驗方案提交與審評工作規(guī)范》的通告

為提高藥品注冊申請人撰寫臨床試驗方案的質量,規(guī)范臨床試驗方案有關溝通交流和各類注冊申請,提高臨床試驗方案的審評質量,藥審中心組織制定了《藥物臨床試驗方案提交與審評工作規(guī)范》,2023年10月12日發(fā)布,自發(fā)布之日起施行。
本工作規(guī)范適用于臨床試驗申請、補充申請、溝通交流申請和臨床試驗方案登記等涉及臨床試驗方案的資料提交與審評,尤其是針對確證性臨床試驗(或關鍵性臨床試驗)方案。
信息來源于CDE
09 FDA發(fā)布《再生醫(yī)學療法自愿共識標準認可計劃》

2023年10月19日,美國食品藥品監(jiān)督管理局(FDA)發(fā)布了《再生醫(yī)學療法自愿共識標準認可計劃》指南。自愿性共識標準是為醫(yī)療產品各個方面的開發(fā)提供“共識方法”的一種手段,例如評估安全性和有效性,測試方法,驗收標準,并允許這些標準國際統(tǒng)一,使符合監(jiān)管標準的過程更有效和更具規(guī)范性。因此,通過自愿性共識標準,FDA可以簡化其審查過程。
信息來源于FDA
行業(yè)動向
01 mRNA疫苗開發(fā)者斬獲諾貝爾生理學或醫(yī)學獎

2023年10月2日下午,諾貝爾委員會宣布授予Katalin Kariko博士和Drew Weissman博士2023年諾貝爾生理學或醫(yī)學獎,以表彰他們在mRNA疫苗領域的突破性貢獻。在全球爆發(fā)的新冠疫情中,基于mRNA技術的新冠疫苗以前所未有的速度問世,為無數人提供了保護,也改變了全球抗疫的格局。將這一榮譽頒發(fā)給Kariko博士和Weissman博士無疑是眾望所歸,以表彰他們在該領域的卓越成就和重大影響。
信息來源于網絡
02 拜耳斥資2.5億美元新建細胞療法生產工廠

拜耳宣布投資2.5億美元在美國加州伯克利建立一家細胞療法生產工廠,以支持后期臨床試驗和新產品的推出。該工廠將首先生產BlueRock Therapeutics治療帕金森病的實驗性細胞療法bemdaneprocel所需的材料。拜耳計劃在2024年上半年開始進行二期試驗,并表示這個新設施將確保細胞療法的投資成為全球患者的現實。
BlueRock Therapeutics總裁兼首席執(zhí)行官Seth Ettenberg表示,能夠使用這個新的細胞療法生產設施對于向有需要的患者提供有影響力的細胞療法非常重要,他們希望擴大該療法的生產。這個新工廠是拜耳為加強蛋白質治療、細胞和基因治療的生物制劑管線而進行的一系列投資之一,利用Biotech@Bayer的專業(yè)知識為細胞培養(yǎng)、病毒轉導和細胞療法提供靈活的模塊化空間。除了伯克利的工廠,拜耳在德國和瑞士還設有生物技術團隊和實驗室。
信息來源于網絡
03 全球首款體內CRISPR基因編輯療法獲FDA批準Ⅲ期臨床試驗
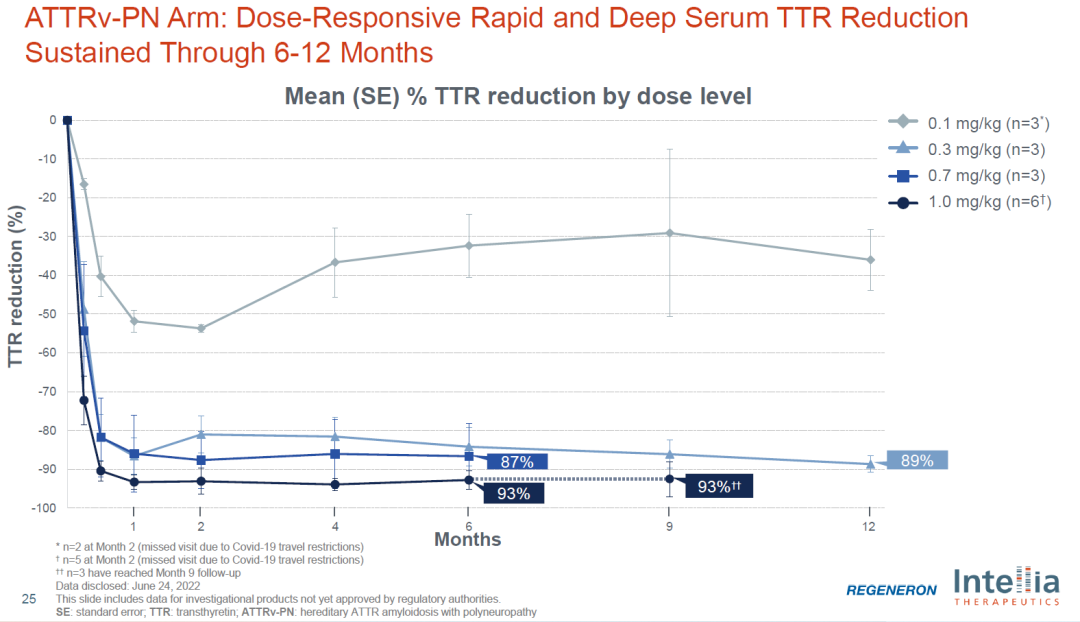
Intellia Therapeutics在2023年10月18日宣布,美國食品藥品監(jiān)督管理局(FDA)已批準其基于CRISPR的轉甲狀腺素蛋白(ATTR)淀粉樣變性心肌病療法NTLA-2001開展Ⅲ期臨床試驗。NTLA-2001是Intellia Therapeutics(CRISPR基因編輯技術的奠基人、諾貝爾獎得主詹妮弗·杜德娜(Jennifer Doudna)創(chuàng)立的)與再生元公司合作開發(fā)的首個產品,也是全球首款體內CRISPR基因編輯療法。該療法利用脂質納米顆粒(LNP)載體將攜帶靶向致病基因TTR的sgRNA和優(yōu)化的spCas9蛋白的mRNA序列傳遞到肝臟,用于治療轉甲狀腺素蛋白淀粉樣變性心肌病。
早期臨床數據顯示,在6名接受治療的患者中,經過28天的治療,兩種不同劑量組的患者血清中TTR蛋白水平平均下降分別為52%和87%,且未觀察到嚴重不良反應。這次FDA批準NTLA-2001進入III期臨床試驗被認為是基因編輯領域的重大里程碑,因為全球范圍內,FDA一直對于直接編輯患者體內DNA的療法持謹慎態(tài)度,其監(jiān)管要求甚至比其他地區(qū)的監(jiān)管機構更為嚴格。
信息來源于網絡
04 瑞吉康針對漸凍癥AAV基因治療藥物獲FDA孤兒藥資格認定

10月16日,上海瑞吉康生物醫(yī)藥有限公司(瑞吉康)宣布,其AAV基因治療藥物RJK002,用于治療肌萎縮側索硬化(ALS),已獲得美國食品藥品監(jiān)督管理局(FDA)的孤兒藥資格認定。這是中國首個獲得FDA孤兒藥資格認定的漸凍癥AAV基因治療藥物。獲得孤兒藥資格認定將加速RJK002的臨床試驗和上市注冊進程,并享受政策支持,包括稅收抵免、免除新藥申請費以及7年的市場獨占權。瑞吉康的RJK系列多肽藥物有望解決漸凍癥領域治療的瓶頸,通過“溶解”異常聚集的蛋白質,恢復其生理功能,從而治療退行性疾病。RJK002已在中國的IIT研究中實現首例患者給藥,并計劃于2023年12月正式提交中國和美國的IND臨床試驗申請。
信息來源于網絡
05 CRISPR基因編輯技術平臺性專利在我國被宣告部分無效

10月20日,株式會社圖爾金向中國國家知識產權局提出了布羅德研究所的專利CN201380070567.X的無效宣告請求。該專利是美國核心專利US8697359B1在中國的對應專利,其中包括保護CRISPR-Cas復合物的組合物和CRISPR-Cas的載體系統(tǒng)。值得注意的是,本次無效認定為部分無效,CRISPR基因編輯的核心技術仍受到原專利的保護。申請人株式會社圖爾金和專利持有方布羅德研究所都有可能對這一決定提起上訴。此外,株式會社圖爾金是一家韓國上市公司,專注于基因編輯專利的授權和合作業(yè)務。
CRISPR-Cas9作為第三代基因編輯技術,具有低成本、高效率和易操作等優(yōu)點,已成為主流編輯工具,引起科技競爭的關注。關于該技術的發(fā)明歸屬一直存在爭議。2020年諾貝爾化學獎得主詹妮弗·杜德納(Jennifer Doudna)和埃瑪紐埃爾·卡彭蒂耶(Emmanuelle Charpentier)的CVC團隊持有中國基因修飾方法CRISPR-Cas9的基礎專利ZL201380038920.6,該專利也曾在中國面臨無效宣告請求。中國專利局審查員對該專利進行了全面審查,并對其中的權利要求進行了詳細審查。此次無效宣告請求則是針對專利的權利要求1-57進行的。
信息來源于網絡
06 扎克伯格進軍細胞行業(yè),計劃投資2.5億美元

近期,馬克·扎克伯格和普莉希拉·陳宣布將在未來十年內投資2.5億美元在紐約市建立一個名為"細胞生物中心"的項目。這個中心旨在開發(fā)一種新型細胞機器,用于監(jiān)測人體并消滅疾病。他們的愿景是通過精確解碼免疫細胞的工作方式,解決癌癥和阿爾茨海默氏癥等疾病。該中心由耶魯大學、哥倫比亞大學和洛克菲勒大學的研究人員組成,致力于設計能夠檢測和治療免疫系統(tǒng)無法解決的細胞問題的機器。盡管這一愿景超出了目前細胞醫(yī)學的水平,但隨著免疫學和細胞工程的進展,這一項目有望成為現實,為人類提供更先進的疾病治療方法。
信息來源于網絡
07 Aspen Neuroscience帕金森病細胞療法獲FDA快速通道資格認定
近日,Aspen Neuroscience宣布其專注于開發(fā)自體細胞療法的核心管線ANPD001已獲得美國FDA的快速通道指定,用于治療帕金森病(PD)。ANPD001是一種個性化的自體細胞療法,通過替換丟失的多巴胺神經元來治療帕金森病。此前,FDA已正式批準ANPD001進入1/2a期臨床試驗,Aspen計劃啟動面向中重度PD患者的首個1/2a期臨床試驗。該公司已于2022年進行了試驗準備篩選隊列研究,以篩選和招募潛在候選患者,并開始制造細胞。這項研究將是美國首個多中心的自體iPSC衍生療法1/2a期臨床試驗。Aspen利用自體方法,利用患者的皮膚細胞開發(fā)誘導型多能干細胞(iPSCs),生產多巴胺神經元前體細胞(DANPCs)。在種植之前,這些細胞將通過Aspen的專有人工智能基因組測試等嚴格質量控制檢測進行評估。除了ANPD001外,Aspen還開發(fā)了第二個產品ANPD002,結合了基因校正和自體神經元療法,用于治療帕金森氏病的遺傳形式。
信息來源于網絡
08 NKGen Biotech治療阿爾茨海默的NK療法獲批IND
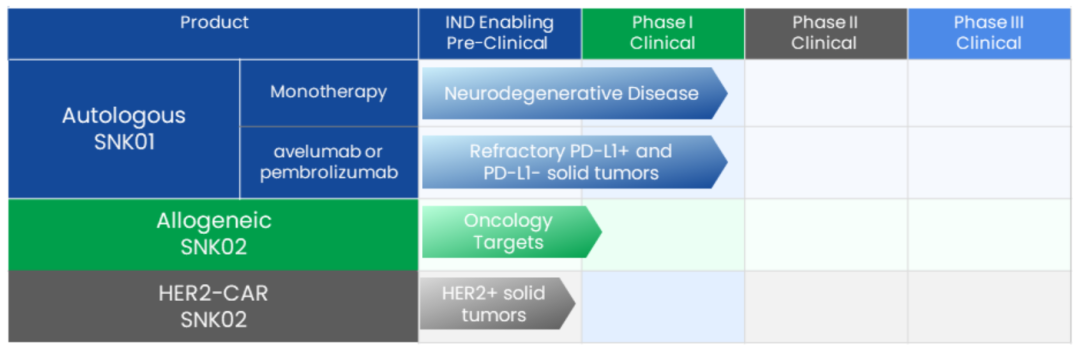
NKGen Biotech近日宣布,美國FDA已批準其NK細胞療法SNK01用于治療中度阿爾茨海默病(AD)的IND申請。預計該療法將于今年年底開始對30名參與1/2a期臨床試驗的患者進行給藥,并計劃于2024年第三季度發(fā)布數據。SNK01是一種非基因修飾的自體NK細胞療法,通過從患者的血液中分離和篩選目標NK細胞,然后激活和擴增這些細胞。SNK01具有增強的細胞毒性和激活受體表達,并且通過NKGen的冷凍保存工藝保持活性和細胞毒性。此前在世界神經病學大會上展示的中期數據顯示,SNK01對AD患者具有良好的耐受性,可以穿透血腦屏障,并顯示出有效減少神經炎癥的跡象,這對于治療阿爾茨海默病至關重要。NKGen的首席執(zhí)行官表示,這次批準是該公司神經退行性疾病項目的重要里程碑,使他們能夠針對更嚴重的患者群體進行治療。
信息來源于網絡
09 Vertex公布其細胞療法VX-880的長期積極結果

10月初,Vertex Pharmaceuticals,總部位于馬薩諸塞州波士頓的生物制藥公司,公布了其干細胞衍生療法VX-880的I/II期臨床試驗A階段和B階段的長期結果。這些結果顯示,所有接受VX-880治療的患者在超過90天的隨訪中都實現了胰島細胞植入和葡萄糖響應性胰島素產生。患者的血糖控制指標均有改善,包括HbA1c下降、血糖范圍內的上升以及胰島素使用的減少或消除。兩名至少隨訪1年的患者達到了主要終點標準,即消除嚴重低血糖事件和糖化血紅蛋白水平低于7.0%。VX-880通常具有良好的耐受性。此外,早期數據顯示,三分之一的患者在接受VX-880治療后實現了胰島素獨立。這些結果表明VX-880具有潛力改善糖尿病患者的胰島素產生和血糖控制。Vertex還在進行其他糖尿病治療候選藥物的研究,包括VX-264,該療法無需免疫抑制治療。
信息來源于網絡
10 綠葉制藥阿爾茨海默病療法在中國獲批

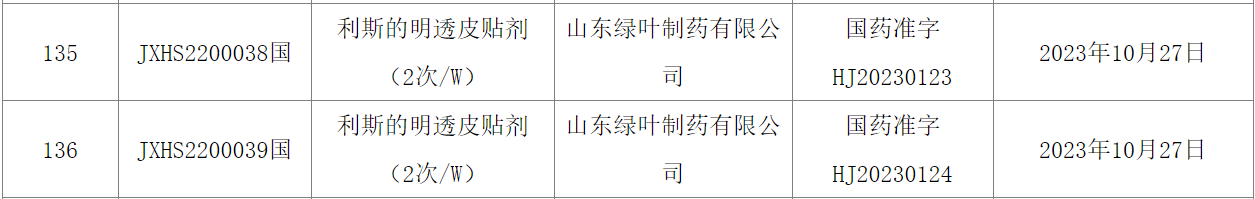
10月31日,中國國家藥監(jiān)局(NMPA)官網顯示,綠葉制藥以注冊分類5.1類申報的利斯的明透皮貼劑(一周兩次)的上市申請已獲得批準。根據綠葉制藥早先新聞稿,這是一款一周兩次、經皮膚給藥的利斯的明改良貼劑(研發(fā)代號LY03013),本次獲批用于治療輕、中度阿爾茨海默病的癥狀。LY03013由綠葉制藥在德國的子公司Luye Pharma公司通過透皮釋藥技術平臺自主研發(fā),為利斯的明創(chuàng)新貼劑劑型。據綠葉制藥早先新聞稿介紹,與利斯的明透皮貼劑(單日貼)相比,LY03013具有更低的使用頻率,可改善患者的用藥依從性;與口服制劑相比,該藥物通過穿透皮膚被人體吸收,亦為存在吞咽困難的病患提供了良好的用藥便捷性,并有望降低惡心、嘔吐等腸胃不良反應的發(fā)生率。
信息來源于網絡
研究進展
01 Cell I Cas9會導致染色體丟失,諾獎團隊開發(fā)改進方案,提高基因編輯的臨床安全性
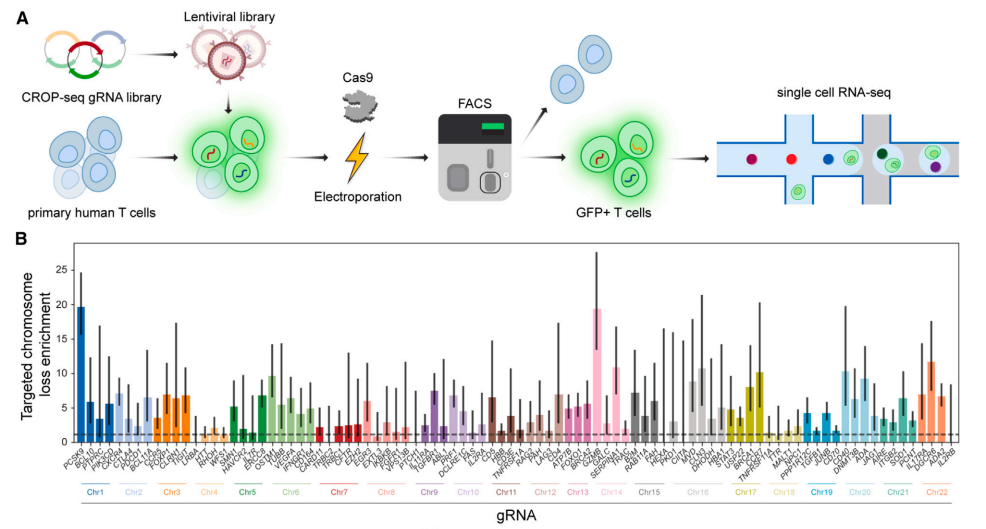
2023年10月3日,諾貝爾化學獎得主、加州大學伯克利分校的 Jennifer Doudna 教授團隊在 Cell 期刊發(fā)表了題為《Mitigation of chromosome loss in clinical CRISPR-Cas9-engineered T cells》 的研究論文。研究團隊在人體臨床試驗(NCT03399448)中首次采用了一種新的T細胞基因編輯方案,不僅減少了染色體缺失,同時還在很大程度上保留了基因組編輯的效果。改進的方案提高了p53的水平,以保護染色體并避免其缺失。這表明Cas9誘導的染色體缺失很可能是通過產生DNA雙鏈斷裂(DSB)進而誘導同源定向修復(HDR)所致。因此,不產生DNA雙鏈斷裂(DSB)的基因編輯技術,例如堿基編輯或表觀基因編輯,可能會避免染色體缺失。
原文鏈接:https://www.cell.com/cell/fulltext/S0092-8674(23)00975-3
02 Molecular Therapy I 漸凍癥AAV基因治療新方法

近日,上海科技大學生命科學與技術學院羅振革團隊在 Molecular Therapy 期刊發(fā)表了題為《Intrathecal delivery of AAV-NDNF ameliorates disease progression of ALS mice》的研究論文。研究團隊開展了一項關于肌萎縮側索硬化癥(ALS)的基因治療研究。他們通過脊髓鞘內注射的方式將基因載體AAV-NDNF輸送給ALS小鼠模型,結果顯示該治療策略可以顯著改善小鼠的運動行為并減緩體重下降,同時也延長了小鼠的生存時間。研究團隊還發(fā)現該治療方式可以促進脊髓運動神經元的存活,減少異常蛋白的聚集,保護神經肌肉接頭,并減緩肌肉的萎縮。這項研究為ALS的基因治療提供了新的潛力,但仍需要進一步驗證和研究。
原文鏈接:https://doi.org/10.1016/j.ymthe.2023.09.018
03 Cell Stem Cell I 全球進展最快的癲癇iPSC干細胞療法,將發(fā)作頻率減少95%
Neurona Therapeutics于2023年10月5日在Cell Stem Cell雜志上發(fā)表了題為《Human pallial MGE-type GABAergic interneuron cell therapy for chronic focal epilepsy》的論文,介紹了一種新型的再生細胞治療策略,用于治療耐藥性局灶性癲癇。經研究證明,這種名為NRTX-1001的細胞具有穩(wěn)健性和可重復性,是一種高度純化的大腦皮層MGE型(內側神經節(jié)隆起)GABA能抑制性中間神經元細胞治療候選物,源自人類干細胞系。臨床前數據表明,在慢性內側顳葉癲癇動物模型中,將NRTX-1001細胞移植可顯著抑制動物的局灶性癲癇發(fā)作,減輕神經病理學表型并提高動物生存率。這些臨床前研究結果為正在進行的開放標簽首次人體I/II期試驗(NCT05135091)提供了支持,該試驗用于治療患有耐藥性MTLE的成人患者,并已經顯示出積極的早期臨床數據。兩名患者在接受NRTX-1001治療一年后仍報告總癲癇發(fā)作次數減少>95%。
原文鏈接:https://www.science.org/doi/10.1126/science.adi6412
04 Nature I iPSC類器官組裝體攜手CRISPR篩選,揭示影響神經發(fā)育疾病致病基因
近日,來自斯坦福大學的科研團隊在Nature期刊上發(fā)表了題為《Assembloid CRISPR screens reveal impact of disease genes in human neurodevelopment》的論文,他們利用升級的大腦類器官組裝體模型和CRISPR基因篩選技術,通過對神經發(fā)育障礙相關基因的功能分類,揭示了這些基因在抑制性神經元發(fā)育中的作用,加快了致病基因的研究進程,為神經發(fā)育障礙的藥物研發(fā)提供了新思路和可能性。同時,這項研究還為自閉癥等神經發(fā)育性疾病的治療和預防提供了理論基礎,有望帶來更好的診斷和治療方向。
原文鏈接:https://doi.org/10.1038/s41586-023-06564-w
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯(lián)系,我們將在第一時間刪除內容


微信公眾號

藥方舟手機版

