2023-10-25 09:53:55來源:CDE瀏覽量:376

為豐富完善中醫藥理論、人用經驗和臨床試驗相結合的中藥注冊審評證據體系,指導申請人在“三結合”中藥審評證據體系下研發用于小兒便秘的中藥新藥,藥審中心起草了《小兒便秘中藥新藥臨床研發技術指導原則(征求意見稿)》,經中心內部討論并組織專家研討,已形成征求意見稿。現在中心網站予以公示,以廣泛聽取各界意見和建議。
我們誠摯地歡迎社會各界對征求意見稿提出寶貴意見和建議,并及時反饋給我們,以便后續完善。征求意見時限為自發布之日起1個月。
您的反饋意見請發到以下聯系人的郵箱:
聯系人:楊娜,yangn@cde.org.cn
褚新穎,chuxy@cde.org.cn
王熙熙,wangxx@cde.org.cn
感謝您的參與和大力支持!
藥品審評中心
2023年10月24日
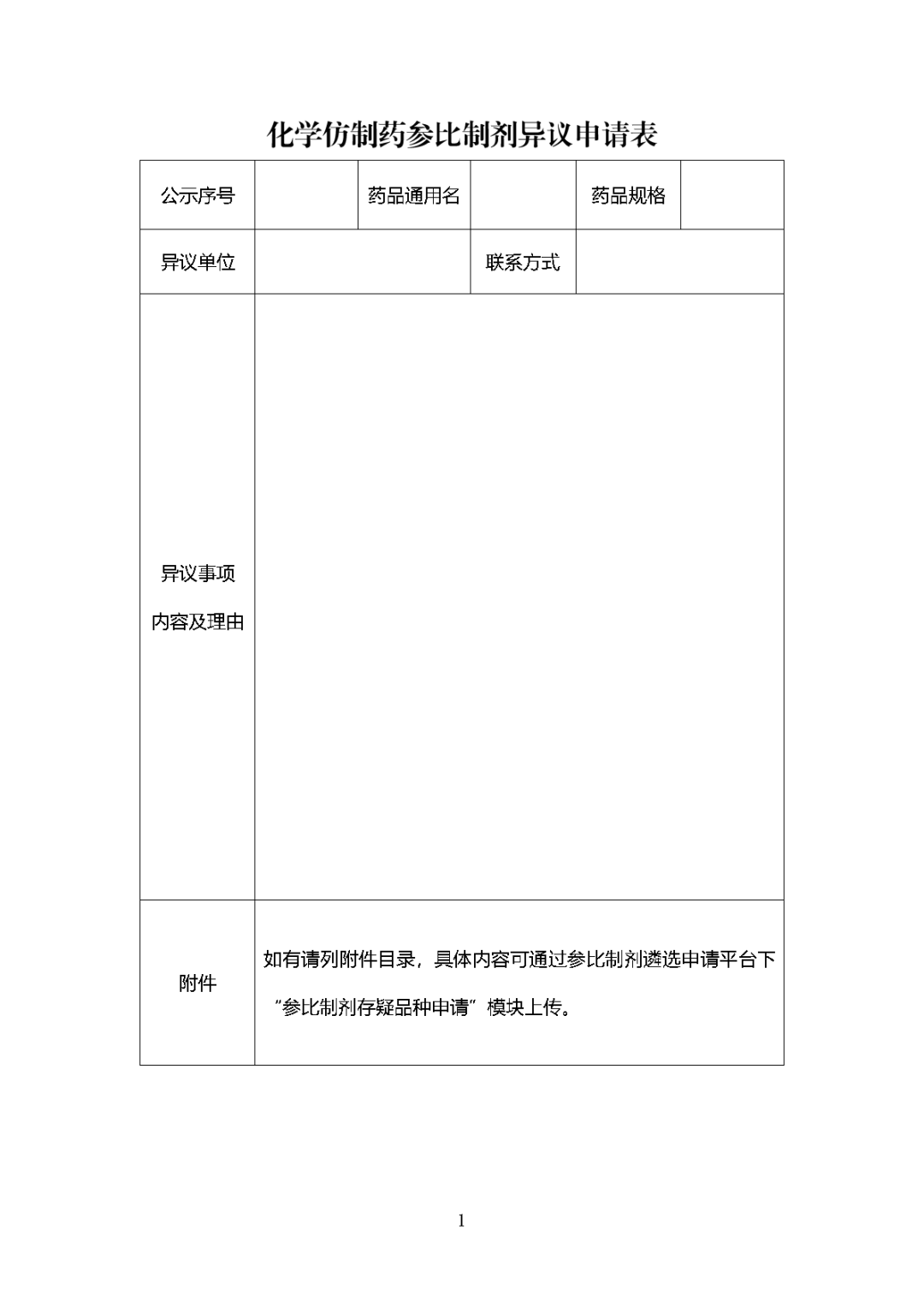
附件1















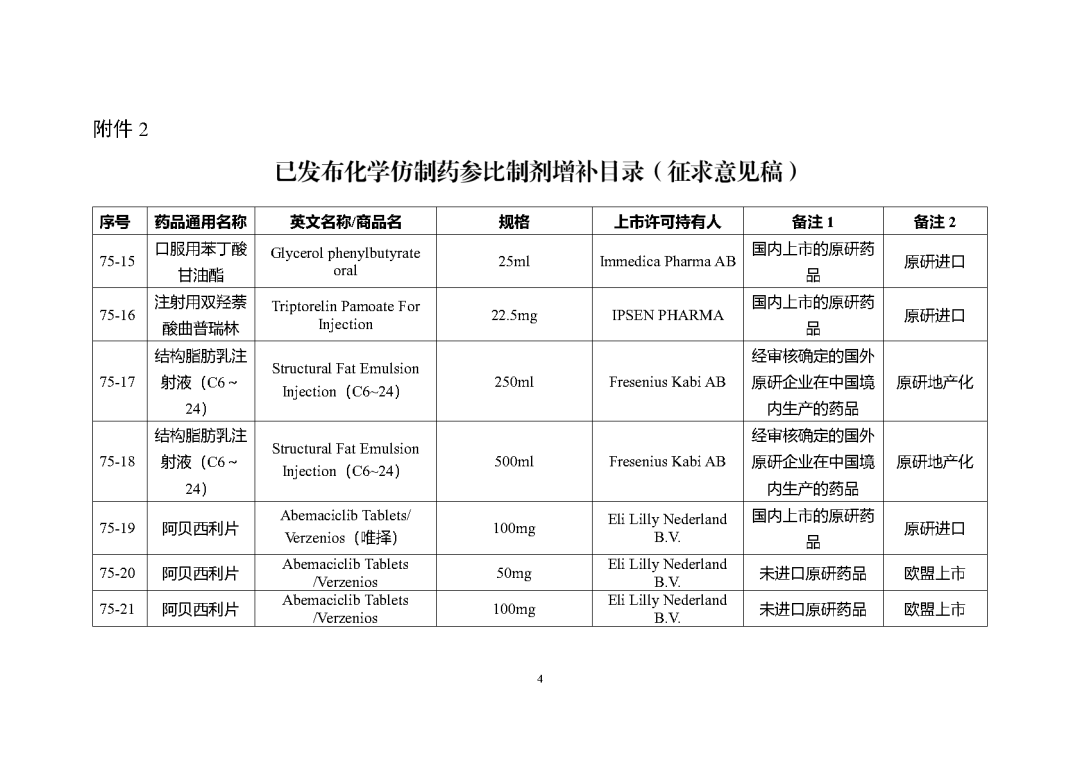
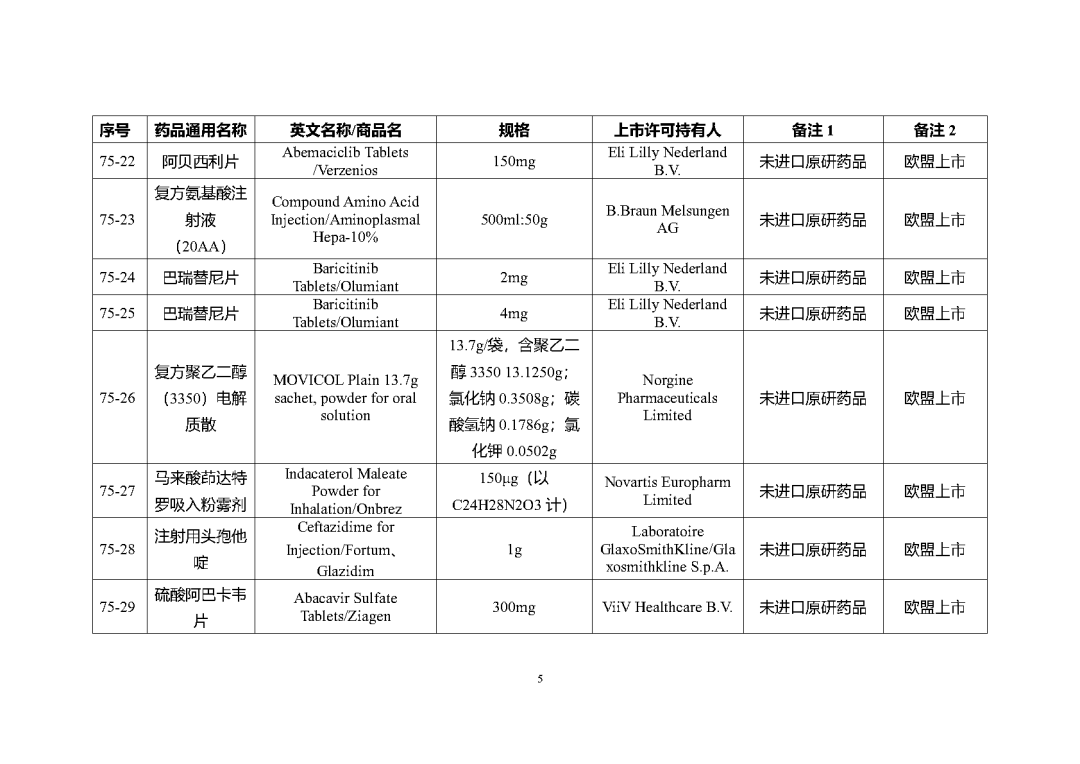
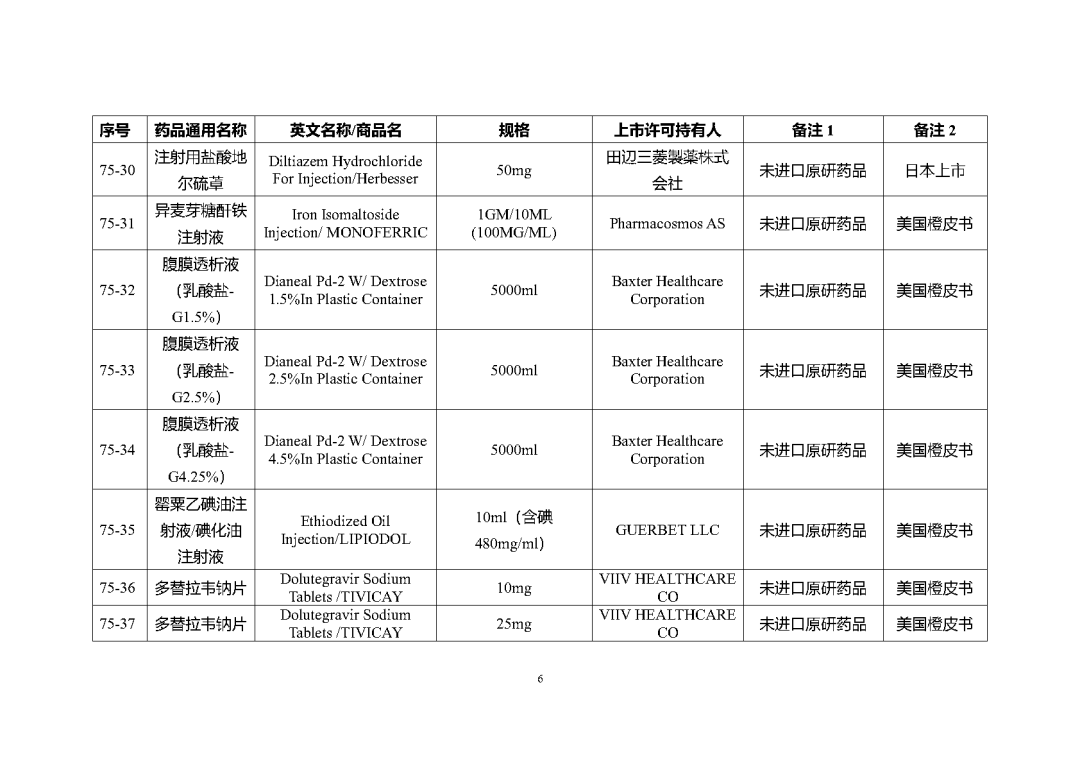
附件2






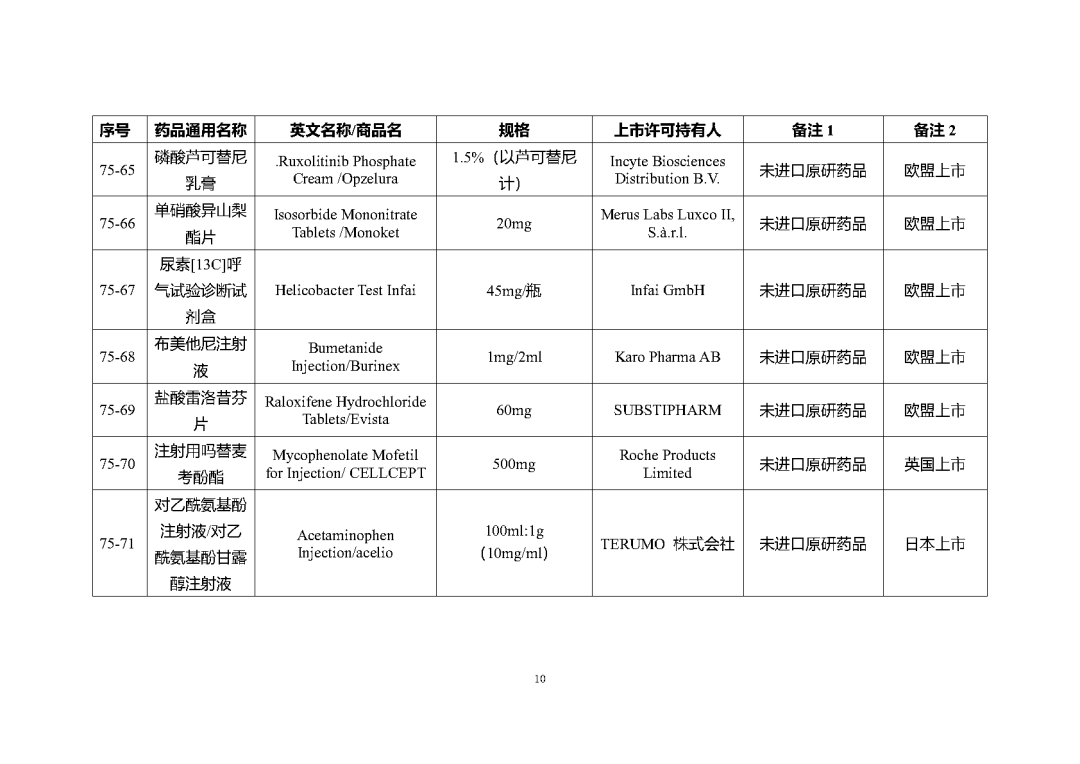
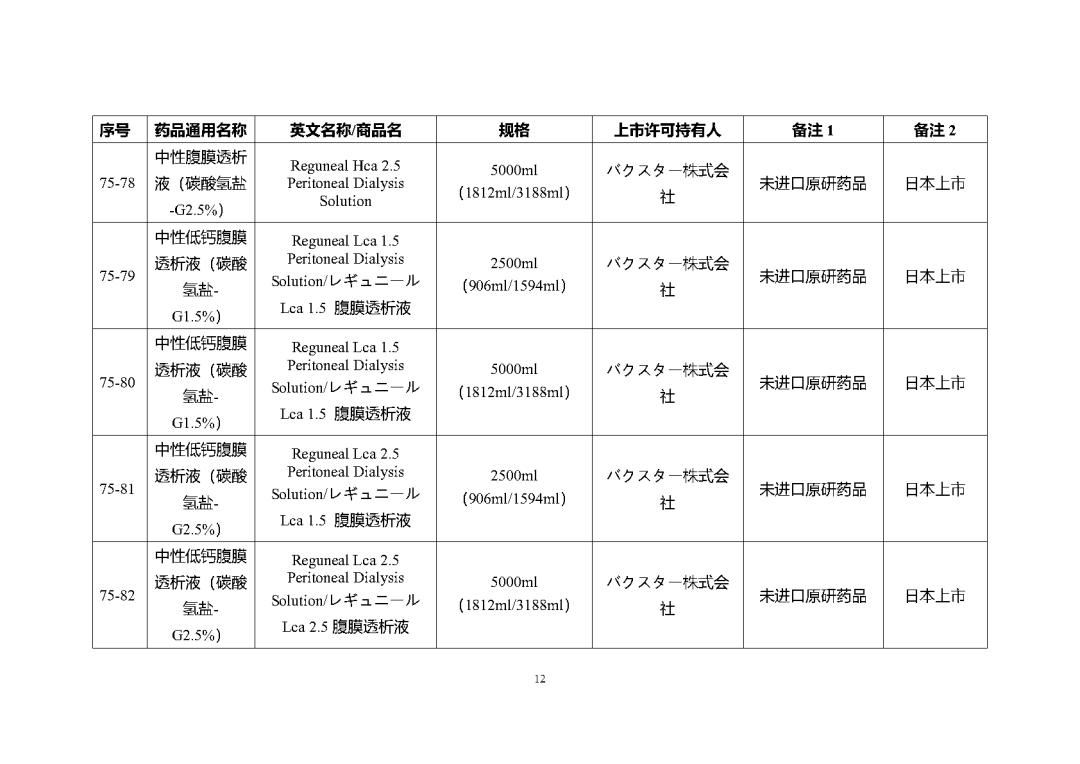
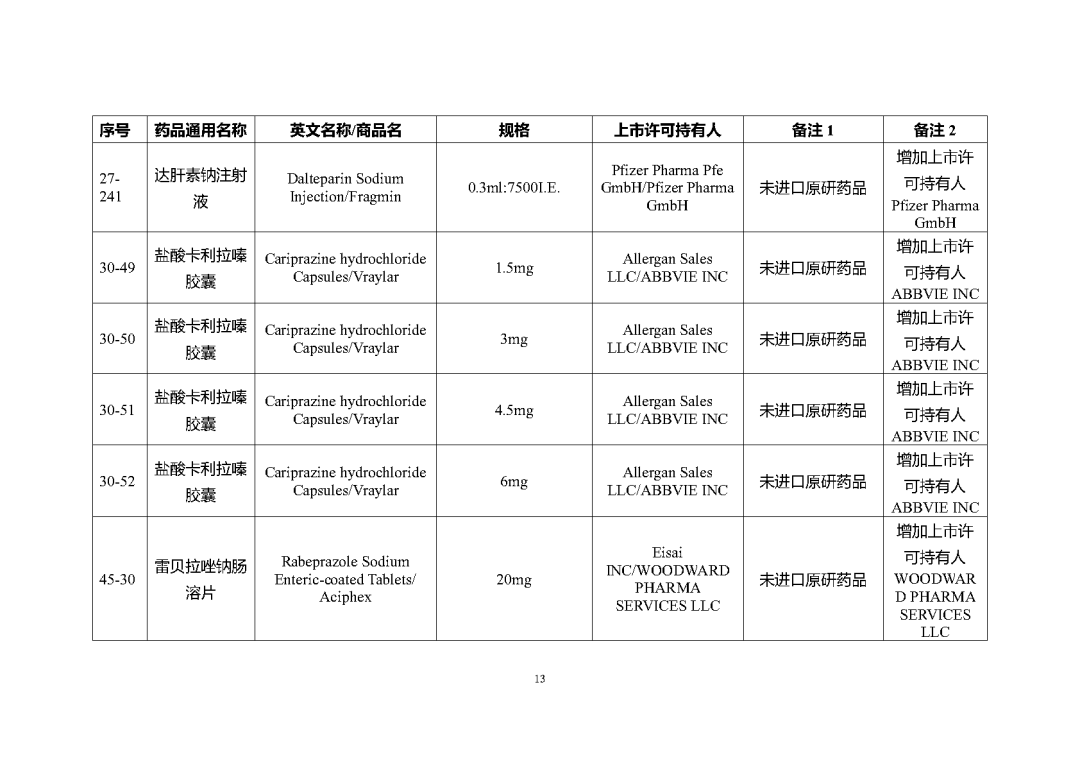
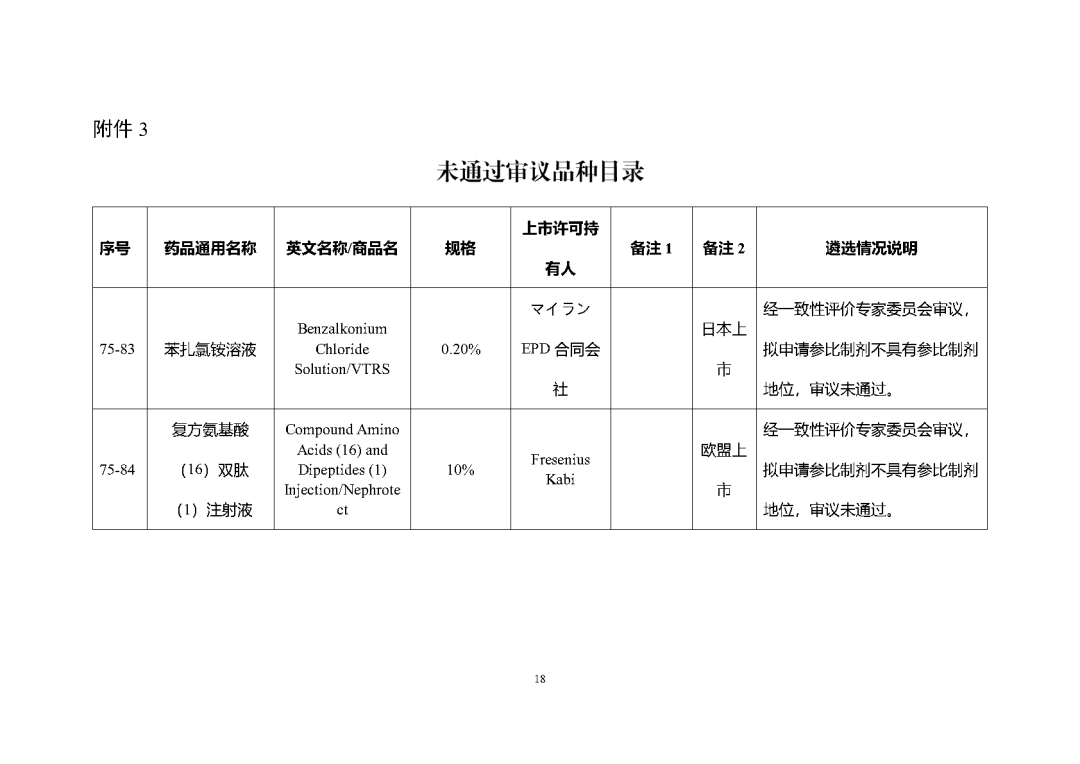
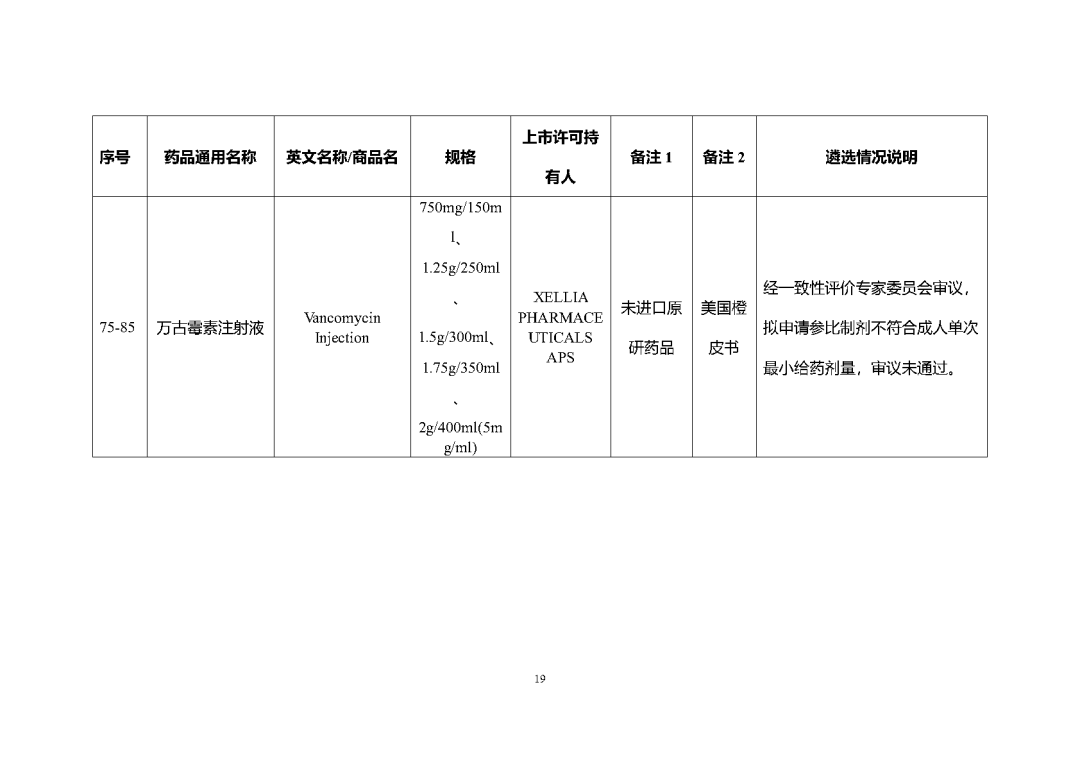
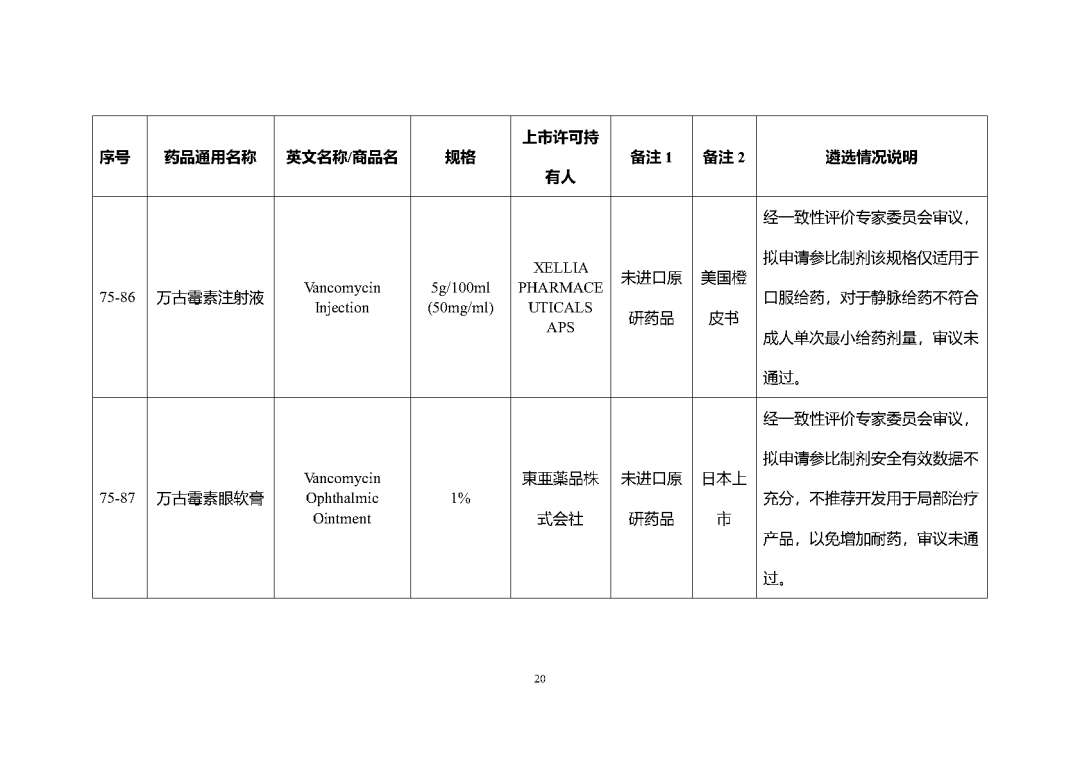
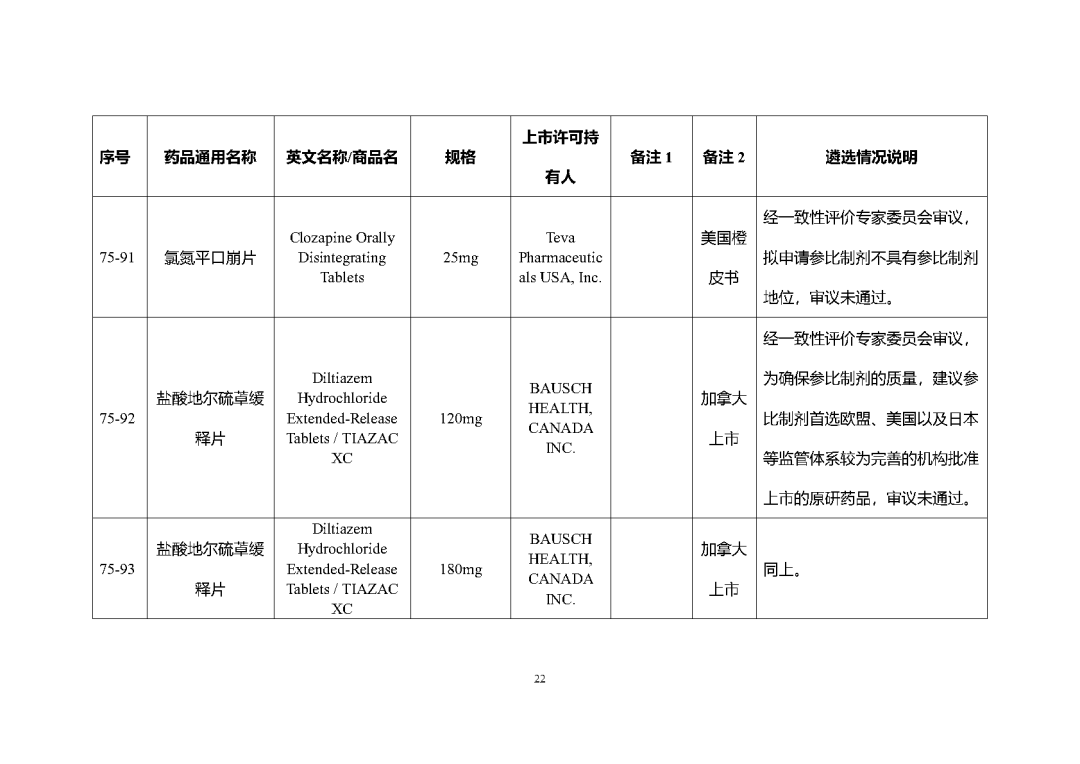
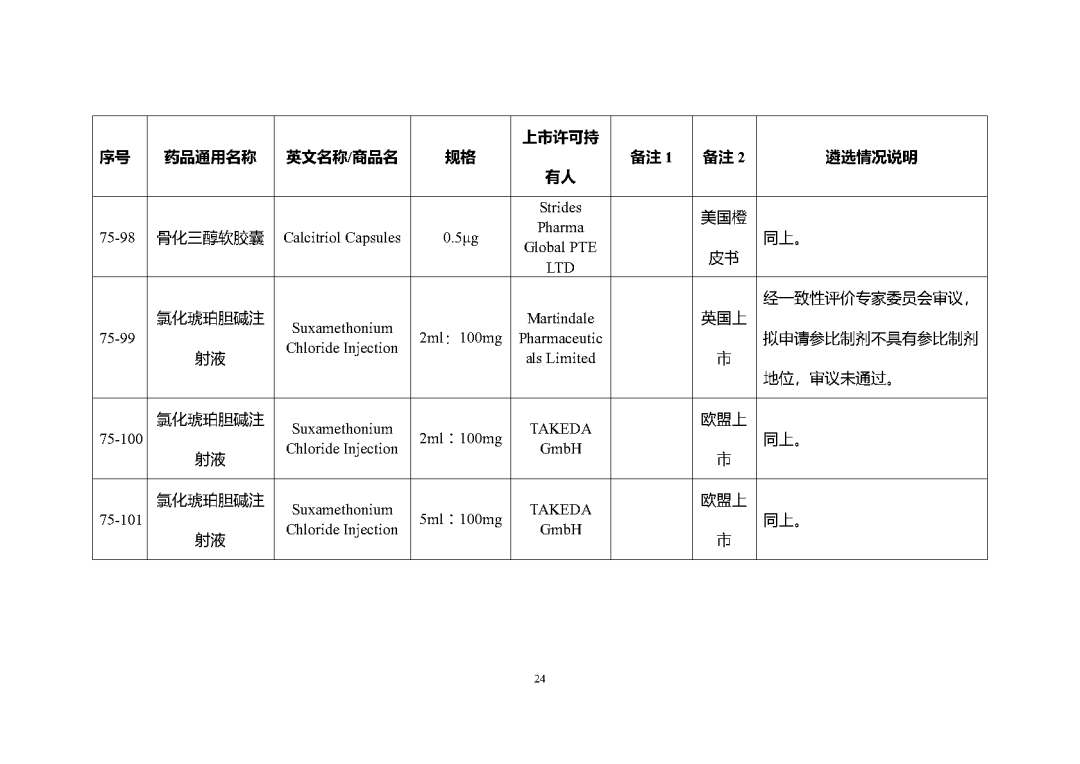
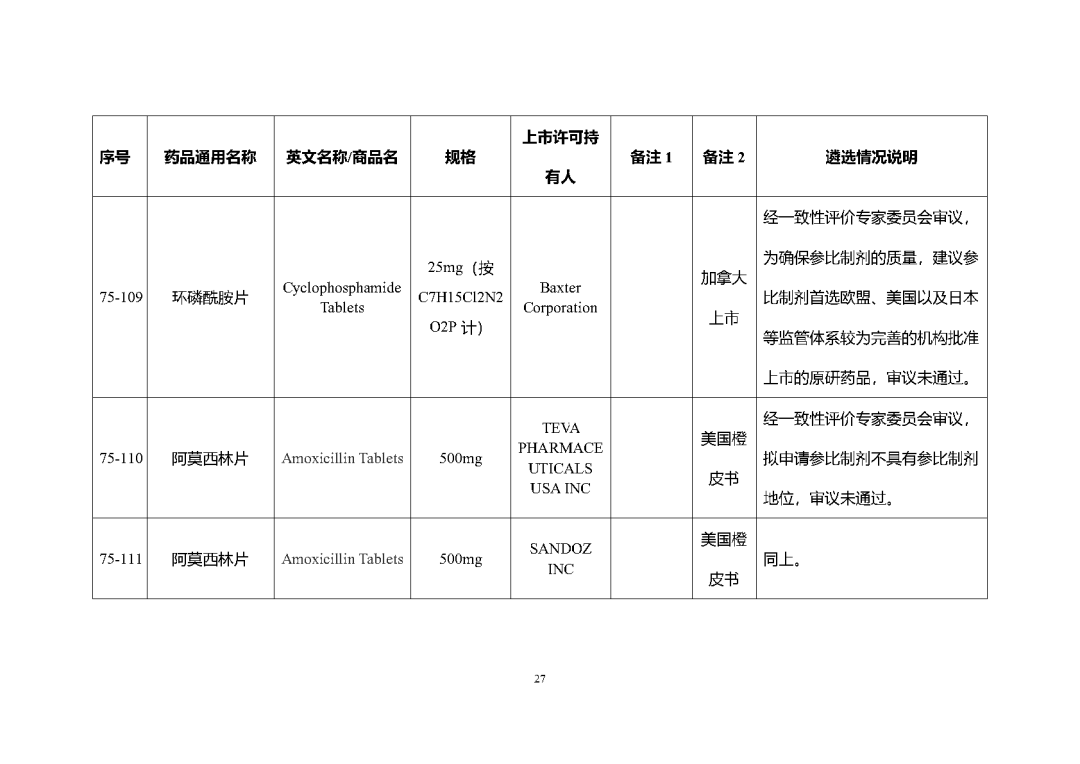
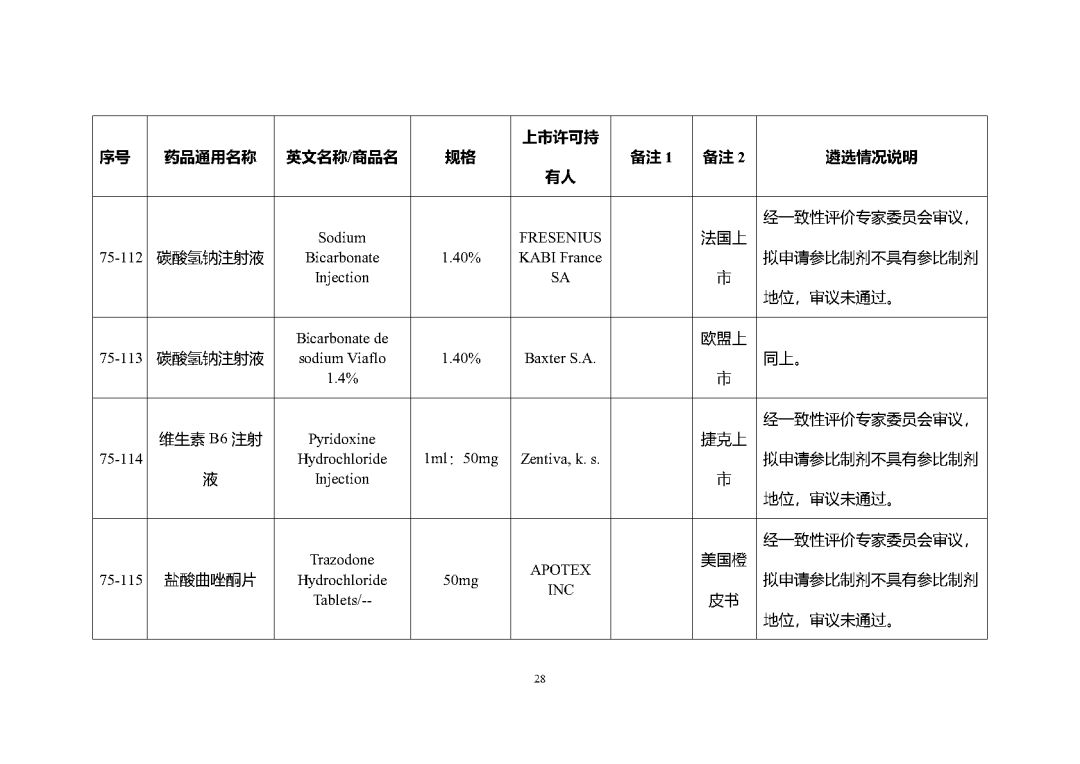
根據國家局2019年3月28日發布的《關于發布化學仿制藥參比制劑遴選與確定程序的公告》(2019年第25號),我中心組織遴選了第七十五批參比制劑(見附件),現予以公示征求意見。
公示期間,請通過參比制劑遴選申請平臺下“參比制劑存疑品種申請”模塊向藥審中心進行反饋,為更好服務申請人,反饋意見請提供充分依據和論證材料,反饋材料應加蓋單位公章,并提供真實姓名和聯系方式。
公示期限:2023年10月24日~2023年11月6日(10個工作日)。
國家藥品監督管理局藥品審評中心
2023年10月24日
附件1

















附件2