
2023-09-27 00:00:00來源:普利制藥瀏覽量:186
多重因素共同推動藥品出海加速
藥品揚帆出海已成為趨勢:中國醫(yī)藥管理協(xié)會數(shù)據(jù)顯示,2021年國內(nèi)企業(yè)向美國FDA申報新藥IND近百個,中外同步申報的新藥增多;28家國內(nèi)企業(yè)的65個仿制藥品種獲美國FDA的ANDA,其中近一半為注射劑,其均顯示我國的新藥和仿制藥國際化之路邁出實質(zhì)步伐。
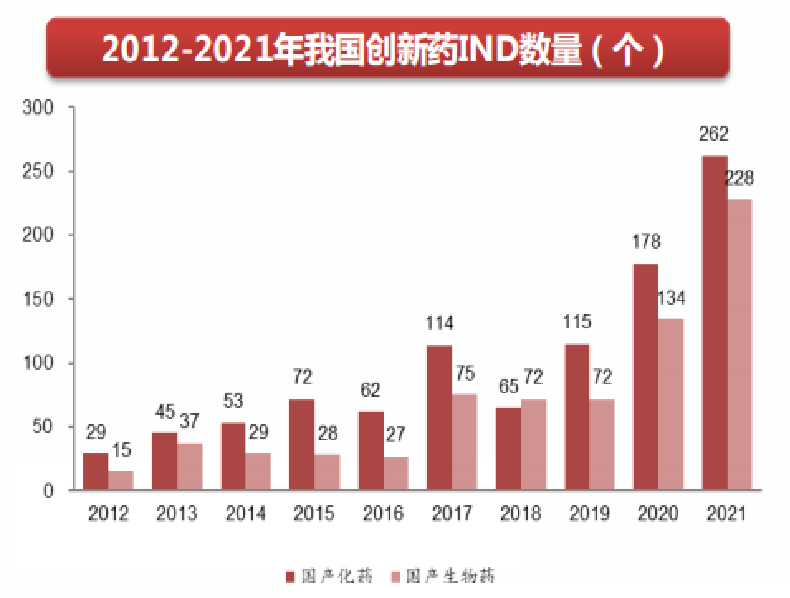 ?
?
藥品揚帆出海加速原因,主要包括以下幾個方面:(1)集采政策影響:集采帶來的銷量增長并不能抵消價格下降帶來的收入降低,“價跌量平”、甚至“量價雙殺”,企業(yè)可能轉(zhuǎn)而尋求出海;(2)醫(yī)保談判影響:納入醫(yī)保藥品價格大幅下降,同時醫(yī)保目錄談判新藥的覆蓋比重逐漸加大,迫于價格與產(chǎn)品的“雙內(nèi)卷”,或因生存倒推,本土創(chuàng)新藥企“出海”速度加快;(3)國內(nèi)產(chǎn)能過剩:我國仿制藥產(chǎn)能已經(jīng)明顯過剩,加上集采等因素影響,很多產(chǎn)品的利潤被腰斬,倒逼企業(yè)選擇出口;(4)一帶一路政策推進(jìn):新興市場國家具有廣大的醫(yī)藥市場潛力和未滿足的臨床需求,加速推動我國醫(yī)藥創(chuàng)新產(chǎn)品“走出去”。
?
美國是全球最大藥品市場,中美雙報是出海重要策略
根據(jù)EFPIA相關(guān)數(shù)據(jù),從全球市場份額角度來看,北美市場占據(jù)全球藥品市場40%左右,歐洲市場占約22%,中國作為新興醫(yī)藥市場的領(lǐng)頭羊,占全球藥品市場規(guī)模比重約20%,日本占約8%,其他國家市場約占全球藥品市場的10%。
?
隨著中國加入ICH并成為ICH管理委員會成員,中國制藥正加速與國際接軌。在中美開放臨床數(shù)據(jù)互認(rèn)的前提下,對大多數(shù)中國藥企而言,越早進(jìn)行“中美雙報”或多國多地注冊,越有利于提升藥品上市速度,盡早獲取中美或多國多地的市場,也有利于研發(fā)效率的提升。美國作為支付能力最強(qiáng)、新藥監(jiān)管水平最高的國家之一,進(jìn)入美國市場也就意味著打開了國際化的大門。目前,按照 FDA 的標(biāo)準(zhǔn)研發(fā)和申報新藥已經(jīng)成為中國新藥開發(fā)的新趨勢。
?
中美雙報的主要挑戰(zhàn)
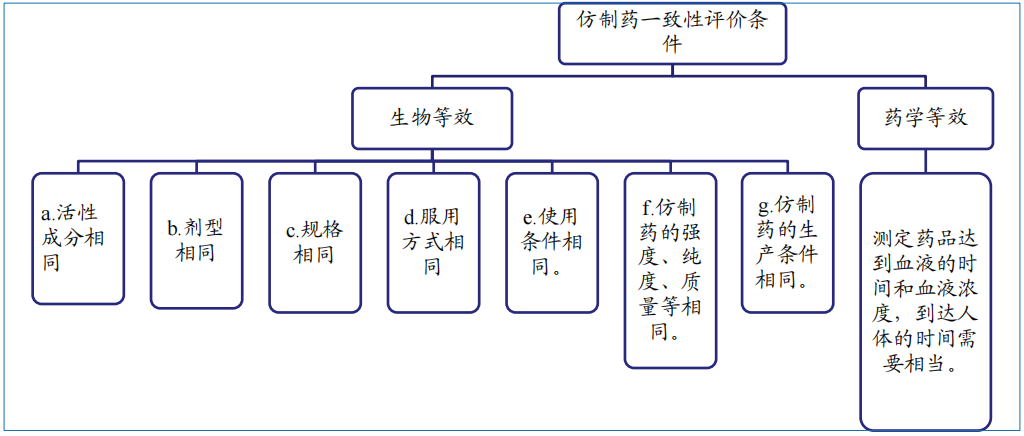
(1)對FDA藥品申報法規(guī)理解不足:中美藥品申報相關(guān)法規(guī)存在差異,深入理解相應(yīng)法規(guī)是藥品申報的重要基礎(chǔ)。
 ?
?
美國FDA新藥申請
?
?
美國FDA仿制藥申請
(2)生產(chǎn)線及質(zhì)量體系不符合FDA要求:歐美標(biāo)準(zhǔn)體系與國內(nèi)不同,生產(chǎn)線維護(hù)成本高,而國內(nèi)多數(shù)廠家生產(chǎn)線并未通過FDA認(rèn)證,生產(chǎn)車間和質(zhì)量體系較難符合FDA要求。
?
合作研發(fā)、申報、生產(chǎn),藥品出海快人一步
目前藥品出海趨勢已經(jīng)形成,面對自身對FDA申報法規(guī)理解不透徹、沒有滿足FDA需求的生產(chǎn)場地,或許將藥品研發(fā)、申報、生產(chǎn)工作委托給目前具有相關(guān)實力的企業(yè)來做,是一種捷徑。
國內(nèi)已有較多企業(yè)有成功申報FDA并上市銷售的企業(yè)案例,例如普利制藥,目前已有多個劑型通過FDA認(rèn)證,包括凍干、水針、片劑、膠囊、干混懸劑,另外滴眼劑、預(yù)充針、口服液等生產(chǎn)線也將通過FDA認(rèn)證,美國獲批并商業(yè)化產(chǎn)品超過20個。
