2023-09-25 17:49:24來源:CDE瀏覽量:4369
關于公開征求《仿制藥質(zhì)量和療效一致性評價受理審查指南(征求意見稿)》意見的通知
發(fā)布日期:20230925
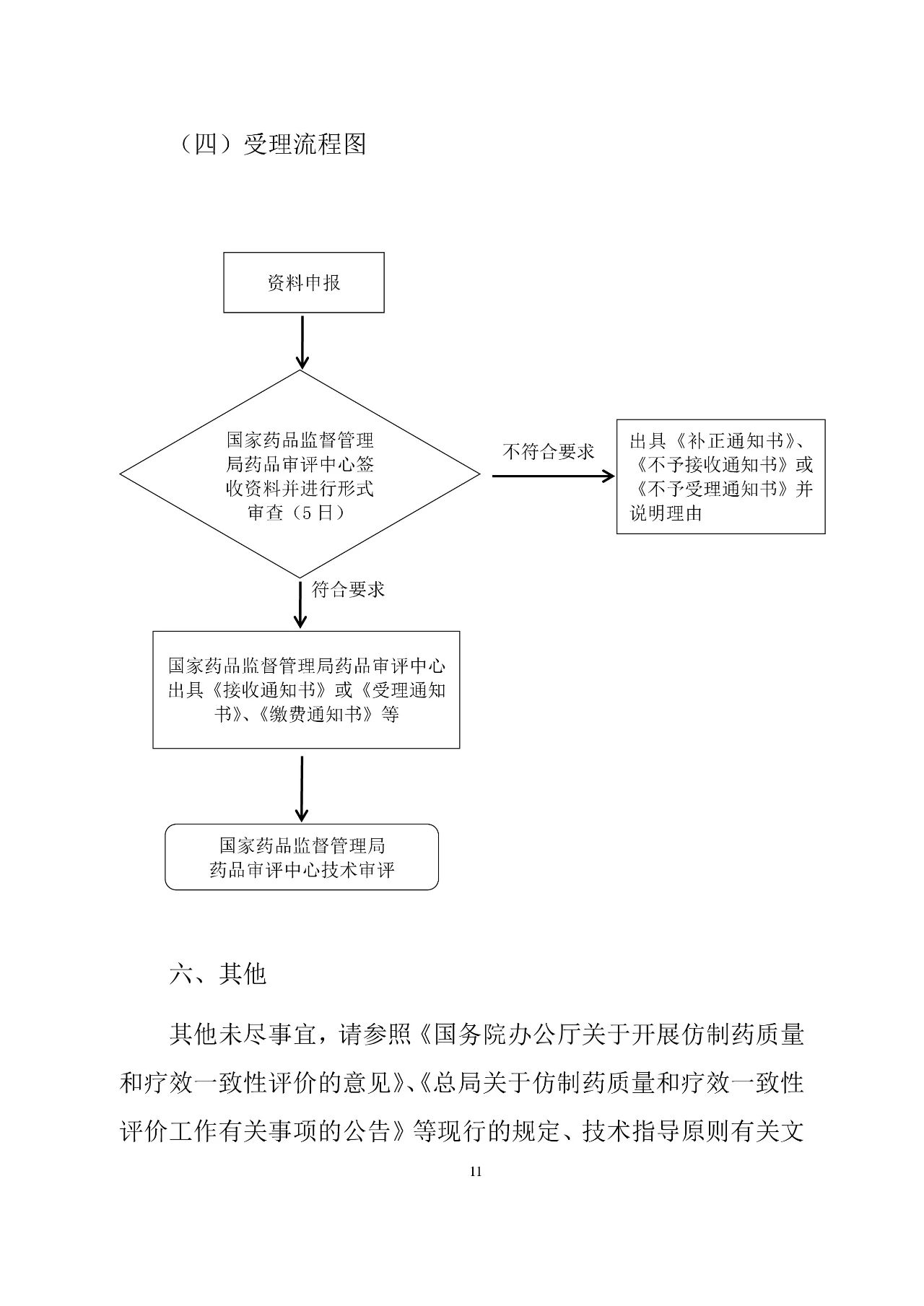
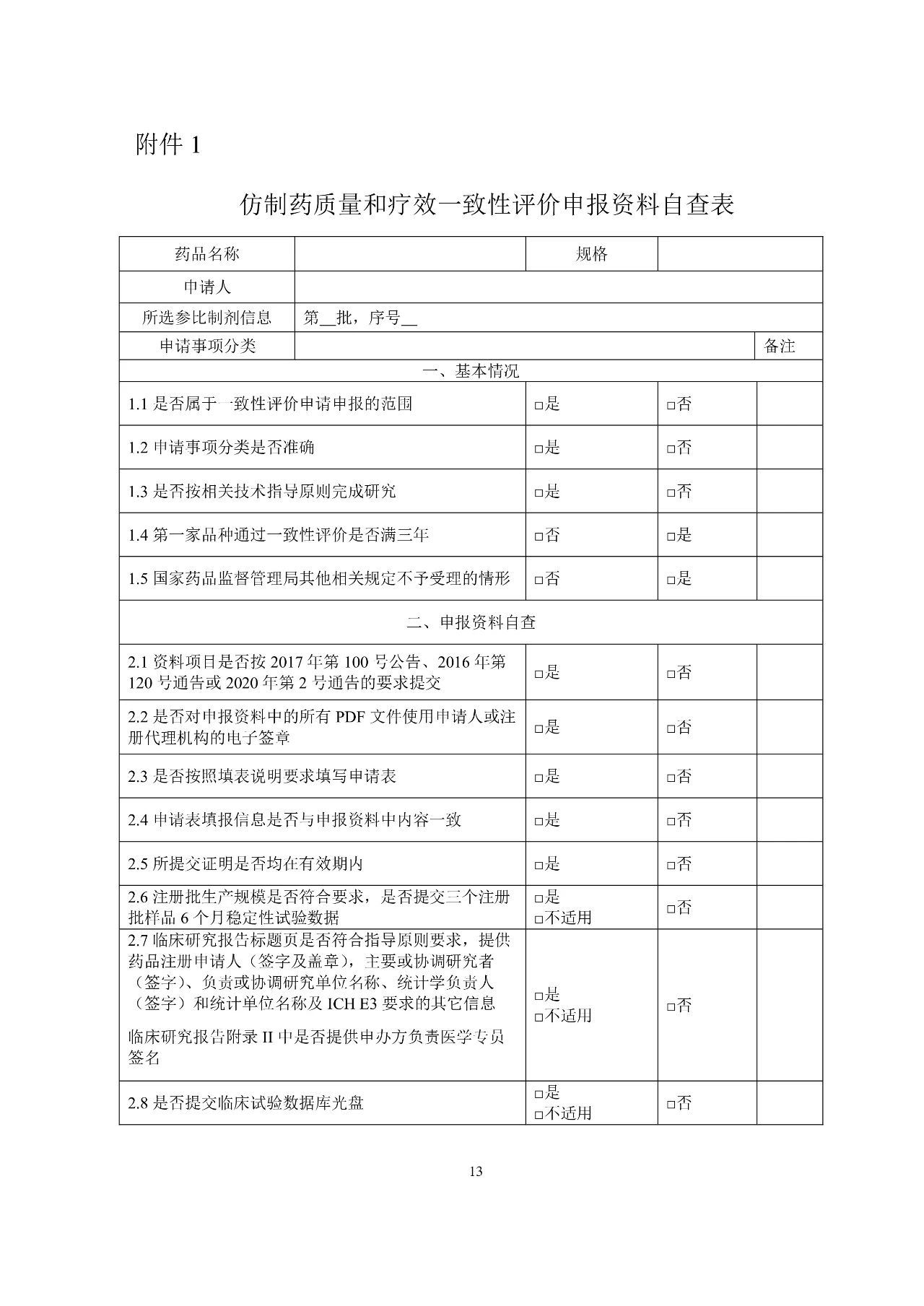
為落實藥品審評審批制度改革要求,貫徹實施《藥品管理法》、《藥品注冊管理辦法》、《藥品上市后變更管理辦法(試行)》的相關規(guī)定,藥審中心在《總局關于發(fā)布〈仿制藥質(zhì)量和療效一致性評價受理審查指南(需一致性評價品種)〉和〈仿制藥質(zhì)量和療效一致性評價受理審查指南(境內(nèi)共線生產(chǎn)并在歐美日上市品種)〉的通告》(2017年第148號)的基礎上,結合藥品注冊電子申報及注射劑一致性評價的相關要求,修訂形成《仿制藥質(zhì)量和療效一致性評價受理審查指南(征求意見稿)》。現(xiàn)在中心網(wǎng)站予以公示,以廣泛聽取各界意見和建議。
我們誠摯地歡迎社會各界對征求意見稿提出寶貴意見和建議,并請及時反饋給我們,以便后續(xù)完善。感謝您的參與和大力支持!
公示期限:自公示之日起一個月
反饋意見郵件:yshchzhn@cde.org.cn
國家藥品監(jiān)督管理局藥品審評中心
2023年9月25日