
2023-09-19 09:23:57來源:醫藥觀瀾瀏覽量:253
▎藥明康德內容團隊報道
中國國家藥監局藥品審評中心(CDE)官網最新公示,默沙東1類新藥注射用sotatercept獲得臨床試驗默示許可,擬開發治療肺動脈高壓。公開資料顯示,該藥是一款新型激活素信號抑制劑類生物制劑,是默沙東通過115億美元收購Acceleron Pharma公司所得。默沙東已向美國FDA遞交了該藥的生物制品許可申請(BLA),用于治療成人肺動脈高壓。此前,該藥還被行業媒體Evaluate列為2023年有望獲批的十大潛在重磅療法之一。
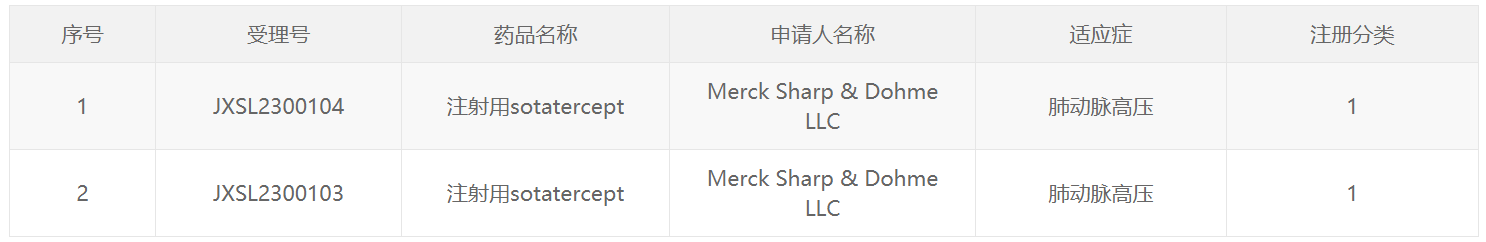 截圖來源:CDE官網
截圖來源:CDE官網
肺動脈高壓(PAH)是一種罕見、進行性、危及生命的血管疾病,其特征為肺小動脈收縮和肺循環中血壓升高。PAH可引起心臟負荷明顯增加,導致體力活動受限、心力衰竭和預期壽命縮短。
Sotatercept是Acceleron Pharma開發的一款潛在“first-in-class”IIA型激活素受體(ActRIIA)融合蛋白。公開資料顯示,該產品通過將ActRIIA經過改造的細胞外域與抗體的Fc端融合在一起,可以阻斷激活素與細胞膜上的受體結合,從而降低激活素介導的信號傳導。在臨床前研究中,它可以逆轉肺動脈壁和右心室的重塑。
2021年9月,默沙東完成了對Acceleron公司的收購,從而獲得了這款創新療法。Sotatercept此前已經獲得FDA授予的突破性療法認定。默沙東在2023年第二季度財報中曾表示,其已經向FDA遞交sotatercept的生物制品許可申請。

Sotatercept此前已經在關鍵3期STELLAR臨床研究中達到主要終點。該研究評估了sotatercept聯合穩定背景治療用于治療肺動脈高壓成人患者(WHO組1)的有效性和安全性。該研究數據在第72屆美國心臟病學會(ACC)年會暨世界心臟病學大會(WCC)上正式發布,并在《新英格蘭醫學雜志》同步發表。
2023年3月,默沙東公布了STELLAR研究的完整結果。研究數據顯示,在PAH患者中,sotatercept在治療24周后將患者的6分鐘行走距離(6MWD)與基線相比提高40.8米,達到試驗主要終點。此外,sotatercept還對9項次要終點中的8項提供統計顯著和具有臨床意義的改善。與安慰劑相比,在中位隨訪時間為32.7周時,它將患者的疾病臨床惡化或死亡風險降低84%。
默沙東此前新聞稿表示,該研究公布對醫生和患者具有重要意義,它表明sotatercept可能在改善肺動脈高壓患者運動能力和其他有意義的臨床結局指標方面發揮關鍵作用。且在穩定背景治療的基礎上,接受sotatercept治療患者的死亡或臨床惡化風險顯著降低。這些具有里程碑意義的結果彰顯了sotatercept在肺動脈高壓治療領域的潛力。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容