
2023-09-15 00:00:00來源:Signal Transduction and Targeted Therapy瀏覽量:203
?隨著尖端藥物發(fā)現(xiàn)技術(shù)的不斷進(jìn)步和應(yīng)用,學(xué)術(shù)界已經(jīng)開發(fā)出了數(shù)十種創(chuàng)新方法,可以直接或間接地靶向無法干預(yù)的蛋白質(zhì),最終將"不可成藥"變?yōu)椤翱沙伤帯被?尚未成藥"。
?
在新一期的?Signal Transduction and Targeted Therapy?雜志中,四川大學(xué)華西醫(yī)院聯(lián)合成都中醫(yī)藥大學(xué)的研究團(tuán)隊(duì)介紹了多種“不可成藥”蛋白的藥物發(fā)現(xiàn)策略,并總結(jié)了已成功開發(fā)出的多種治療方法。這項(xiàng)研究有望進(jìn)一步激發(fā)藥物設(shè)計(jì)和應(yīng)用領(lǐng)域的思考。
隨著對“不可成藥“蛋白研究的不斷深入,具有不可成藥特征的分子可分為以下幾類:
1)小GTP酶(Small GTPases)
2)磷酸酶(Phosphatases)
3)轉(zhuǎn)錄因子(Transcription factors,TFs)
4)表觀遺傳靶點(diǎn)(Epigenetic targets)
5)其他蛋白
?
根據(jù)不可成藥蛋白的各種特性,形成了一些主要的藥物設(shè)計(jì)策略,包括?共價(jià)調(diào)控、變構(gòu)抑制、PPI 抑制、靶向蛋白調(diào)控、基于核酸的方法、免疫治療等,快和小陶一起來看看吧~
?
共價(jià)抑制劑也叫做不可逆抑制劑,是一類通過溫和反應(yīng)性官能團(tuán)形成的共價(jià)鍵與靶蛋白的氨基酸殘基結(jié)合,以賦予額外親和力的抑制劑。
?
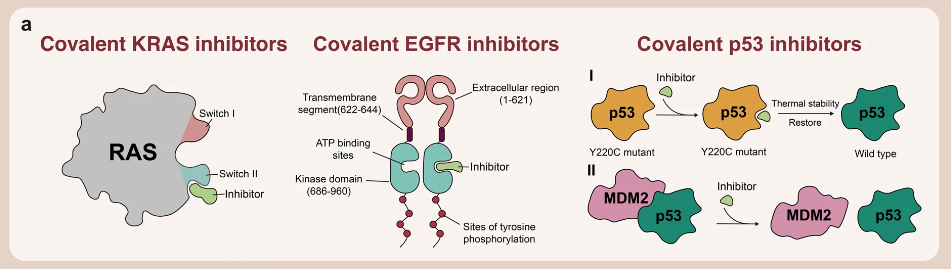
▲共價(jià)調(diào)節(jié)劑的結(jié)合模式
?
§? KRAS 共價(jià)抑制劑
KRAS 基因的全名叫 Kirsten ratsarcoma viral oncogene homolog,KARS 基因編碼的蛋白是一種小 GTP 酶(smallGTPase),它屬于 RAS 超蛋白家族。因?yàn)?KRAS 蛋白是一個(gè)沒有明顯結(jié)合位點(diǎn)的近球形結(jié)構(gòu),很難開發(fā)有效靶向和抑制其活性的化合物。然而,通過采用共價(jià)調(diào)控的方法,可以克服這一難題。
KRAS 共價(jià)抑制劑與 KRAS G12C 突變體的胱氨酸結(jié)合,可降低 GTP 和 KRAS 之間的親和力,從而將 KRAS G12C 突變體鎖定在失活狀態(tài)。
目前已上市的共價(jià) KRAS 抑制劑有?Sotorasib?和?Adagrasib。除此之外,還有 10 種 RAS 抑制劑正在臨床中(如下表),28 種正在臨床前開發(fā)中,詳情點(diǎn)擊“閱讀原文“查看哦~
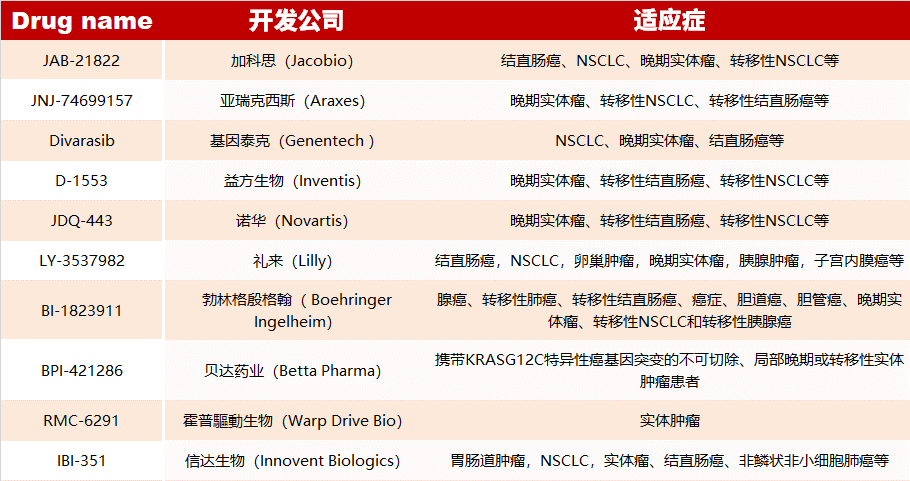
?
EGFR 共價(jià)抑制劑
表皮生長因子受體(EGFR)是一種跨膜糖蛋白,存在于人體各組織細(xì)胞膜上,是受體酪氨酸激酶中的表皮生長因子受體(HER)家族中的一員,在調(diào)節(jié)細(xì)胞增殖、存活和分化過程中起著重要作用。
EGFR 的靶向藥物是酪氨酸激酶抑制劑(TKI),其抑制細(xì)胞中的激酶,從而阻止它們激活 EGFR 信號通路。第一代 EGFR TKI,如?gefitinib?和?erlotinib,以非共價(jià)結(jié)合的方式選擇性地與 EGFR 酪氨酸激酶的 ATP 結(jié)合位點(diǎn)結(jié)合,從而抑制 EGFR 磷酸化,顯著延緩臨床 NSCLC 靶向治療的疾病進(jìn)展。但在使用第一代 EGFR TKIs 后,會出現(xiàn)耐藥性,導(dǎo)致腫瘤再次進(jìn)展。因此有了第二代、第三代 EGFR 共價(jià)抑制劑的出現(xiàn)。
目前已上市的 EGFR 共價(jià)抑制劑如下:
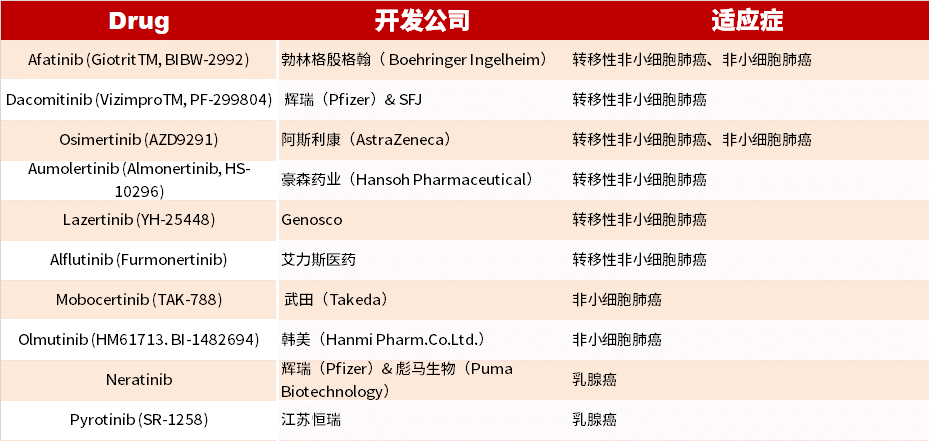
?
除此之外,還有一些 EGFR 共價(jià)抑制劑正在申請批準(zhǔn)中,例如?avitinib,?oritinib,?sunvozertinib?和?rezivertinib。一些 EGFR 共價(jià)抑制劑正在進(jìn)行臨床試驗(yàn):如Olafertinib?(CK-101/RX518) 、Nazartinib?(EGF816, NVS-816) 、Allitinib?(AST-1306)。
靶向 P53 的共價(jià)抑制劑
P53 蛋白是一種轉(zhuǎn)錄因子和腫瘤抑制蛋白,可結(jié)合 DNA 并調(diào)控多種轉(zhuǎn)錄靶標(biāo),響應(yīng)細(xì)胞應(yīng)激或 DNA 損傷,協(xié)調(diào)細(xì)胞周期阻滯、DNA 修復(fù)、代謝改變、凋亡等過程,防止腫瘤形成。大約一半的人類癌癥中都存在 P53 基因的突變。
癌癥中 TP53 突變的主要后果是腫瘤抑制功能的喪失,需要治療性地重新激活該蛋白,而大多數(shù)與癌癥有關(guān)的小分子藥物實(shí)際上是通過抑制蛋白的過度活性來發(fā)揮作用。因此,P53 長期以來一直被認(rèn)為是“不可成藥”的。
2022 年,Kevan M. Shokat 的團(tuán)隊(duì)開發(fā)了一種小分子共價(jià)抑制劑?KG13。KG13 專門設(shè)計(jì)用于與 P53-Y220C 突變體結(jié)合,可將 P53 靶基因激活,抑制腫瘤細(xì)胞生長和增加半胱天冬酶活性。除了直接靶向 P53 外,還可以通過靶向 P53 的調(diào)節(jié)因子來達(dá)到治療的效果。例如靶向 MDM2 的?NPD6878 (apomorphine)、和靶向 HDM2的?Compound 76。
當(dāng)然,除了 KRAS、EGFR、P53 外,還有靶向其它“尚未成藥“靶標(biāo)蛋白的共價(jià)抑制劑正在開發(fā)中,如靶向 Myeloid cell leukemia-1 (Mcl-1) 的共價(jià)抑制劑?MAIM1、一種基于三價(jià)砷共價(jià)誘導(dǎo)劑開發(fā)的 PKM2 抑制劑?Compound 78?等等。
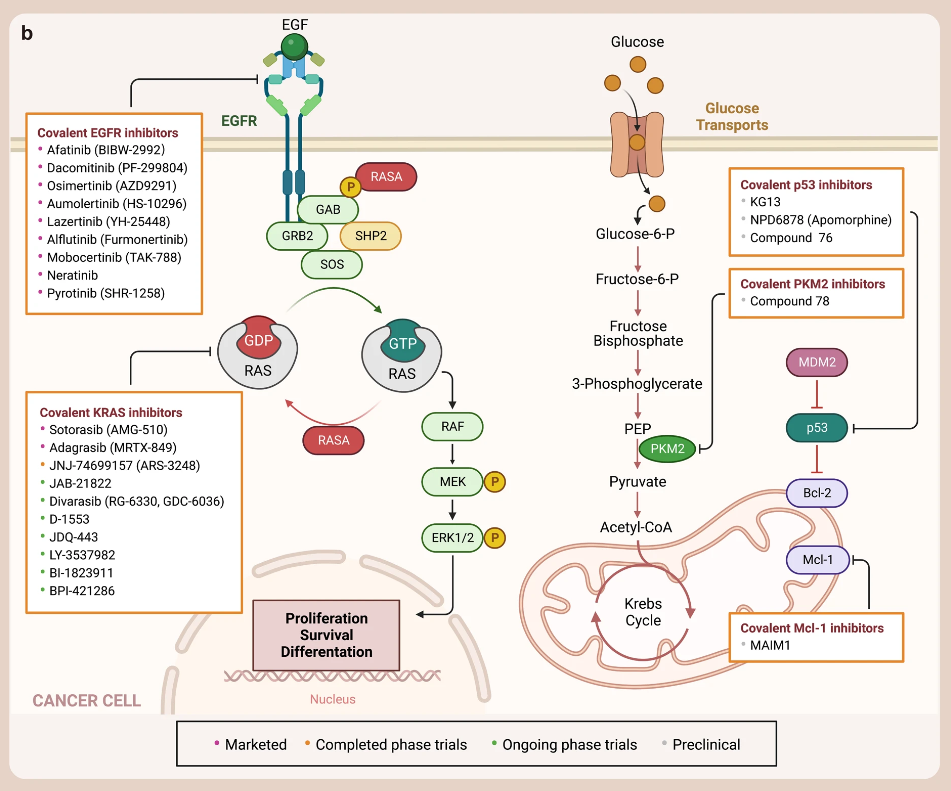
▲已上市、臨床和臨床前共價(jià)抑制劑的圖譜
變構(gòu)調(diào)節(jié)是一種直接有效的調(diào)控生物大分子功能的方法,通過變構(gòu)改變生物大分子四級結(jié)構(gòu)進(jìn)而改變其生物功能,存在于各類細(xì)胞活動中。例如信號轉(zhuǎn)導(dǎo)、酶催化、細(xì)胞代謝、基因調(diào)控等。變構(gòu)調(diào)節(jié)劑也有著使”不可成藥“靶點(diǎn)轉(zhuǎn)化為”可成藥“靶點(diǎn)的能力。
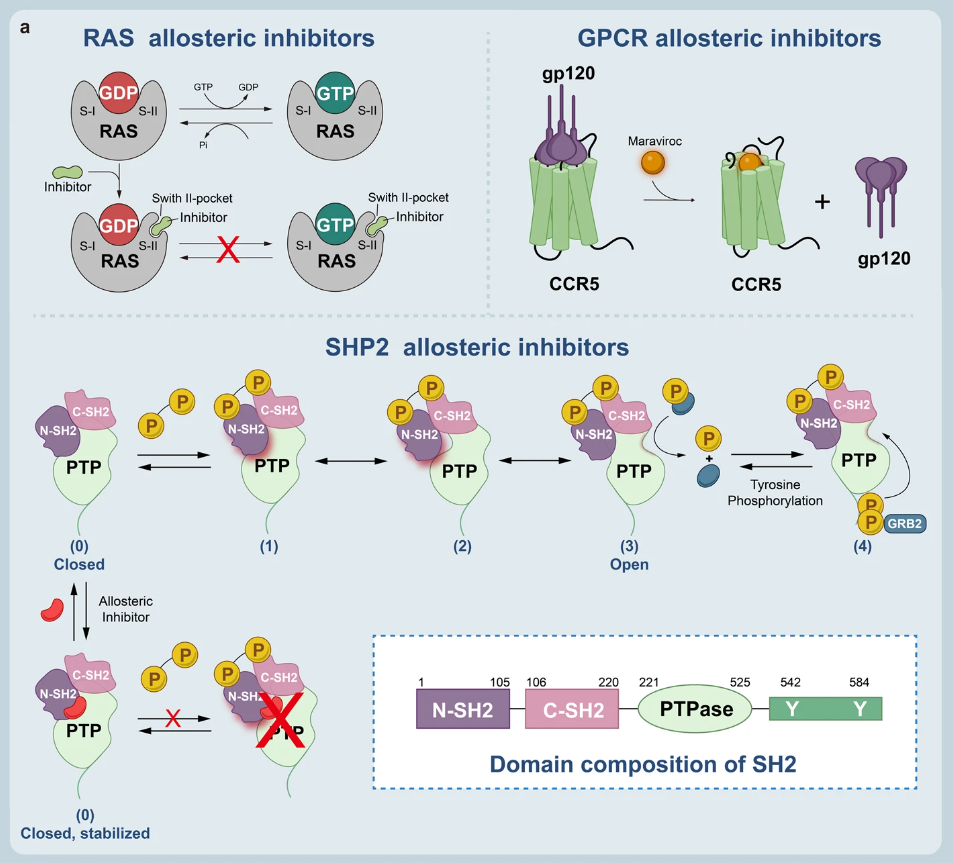
▲變構(gòu)調(diào)節(jié)劑的結(jié)合模式
?
變構(gòu)調(diào)節(jié)劑可以分為三類:
1)正變構(gòu)調(diào)節(jié)劑(PAMs):可與受體結(jié)合改變受體對刺激的反應(yīng);
2)負(fù)變構(gòu)調(diào)節(jié)劑(NAMs):通過降低配體的親和力和/或功效來減弱信號傳導(dǎo)的新型間接方法;
3)沉默變構(gòu)調(diào)節(jié)劑(SAMs):通過改變蛋白質(zhì)構(gòu)象或功能來抑制目標(biāo)蛋白質(zhì)活性的藥物或化合物。
?
通過應(yīng)用變構(gòu)調(diào)節(jié)的策略已開發(fā)了許多靶向 KRAS、SHP2 的藥物,部分如下(更多信息可查看原文):
?
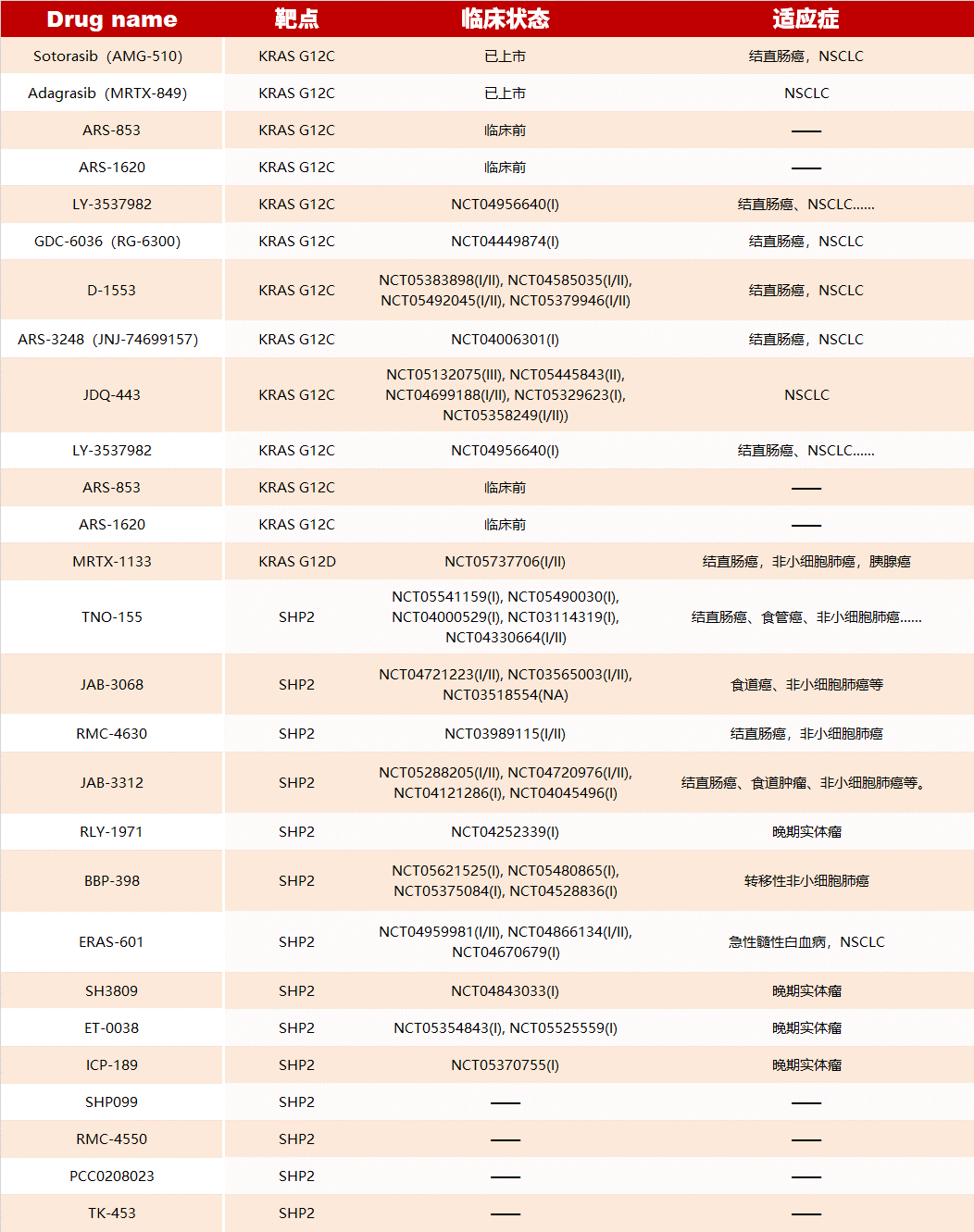
?
此外,已有一些 GPCR 變構(gòu)調(diào)節(jié)劑獲批上市,如?avacopan、cinacalcet、ticagrelor?和?maraviroc,還有數(shù)十種藥物分子正在進(jìn)行Ⅰ-Ⅲ期臨床試驗(yàn),數(shù)百種有潛力的 GPCR 變構(gòu)調(diào)節(jié)劑正在進(jìn)行臨床前研究。
?
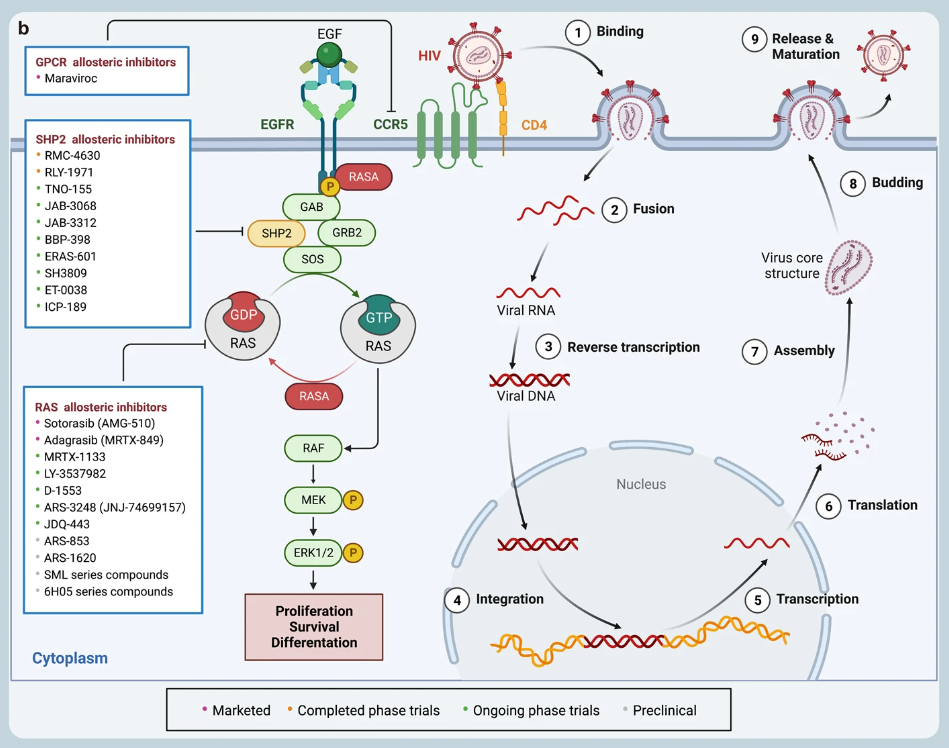
▲已上市、臨床和臨床前變構(gòu)抑制劑的圖譜
蛋白-蛋白相互作用(PPI)在眾多生物過程中扮演著至關(guān)重要的角色,包括信號傳導(dǎo)、細(xì)胞增殖、生長、分化和凋亡等。設(shè)計(jì)藥物來干預(yù) PPI 已經(jīng)被證明是一種有效的策略,可以有針對性地作用于那些“難以靶向”的蛋白質(zhì)。現(xiàn)有的PPI抑制劑可以分為小分子、抗體、肽和重組蛋白,每種類型都有其優(yōu)點(diǎn)和缺點(diǎn)。
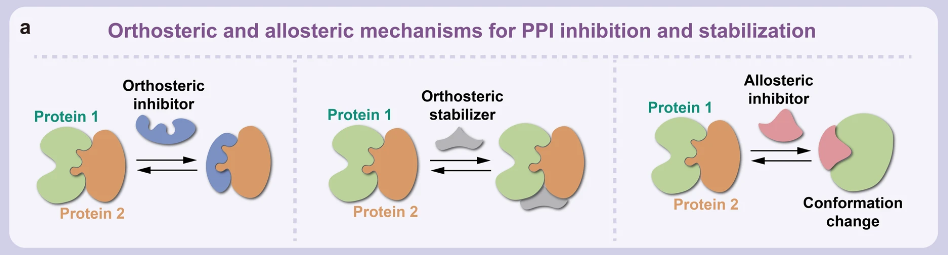
▲PPI調(diào)節(jié)劑的結(jié)合模式和機(jī)制
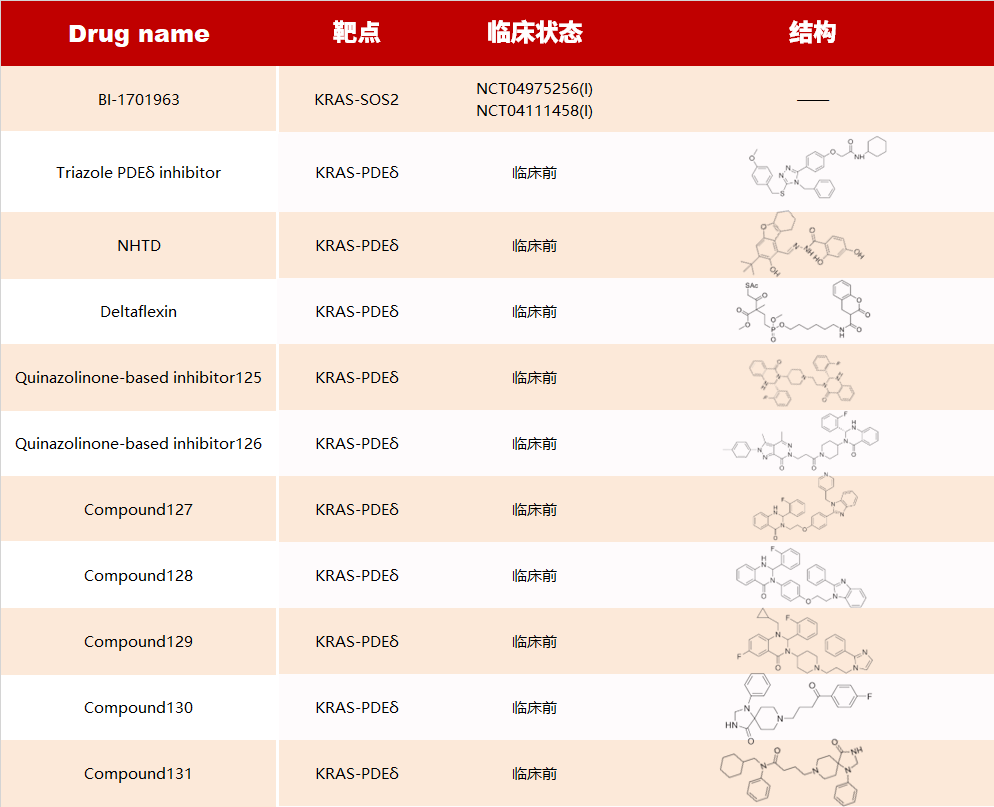
RAS PPI 抑制劑
? ? ?
? ? ?
RAS 可通過結(jié)合 GTP 或 GDP 在活動狀態(tài)和非活動狀態(tài)之間切換,傳遞細(xì)胞生長和分化的信號。活化的 RAS 蛋白可以與許多下游效應(yīng)蛋白相互作用,如 RAF 激酶、鳥苷核苷交換因子 SOS、磷脂酰肌醇 3 激酶(PI3K)和 Ral 鳥苷核苷酸解離促進(jìn)因子(RalGDS)等。
目前應(yīng)用 PPI 策略設(shè)計(jì) RAS PPI 分子或藥物有:
?
?
Bcl-2 PPI 抑制劑
? ? ?
? ? ?
Bcl-2 家族在通過調(diào)控線粒體/細(xì)胞色素 C 介導(dǎo)的內(nèi)源性凋亡信號轉(zhuǎn)導(dǎo)途徑中發(fā)揮關(guān)鍵作用,在各種血液惡性腫瘤中高度表達(dá),包括慢性淋巴細(xì)胞白血病(CLL)和濾泡中心淋巴瘤(MCL)等。Bax 和 Bad 等促凋亡蛋白對細(xì)胞凋亡過程至關(guān)重要,但當(dāng)它們與 Bcl-2 等抗凋亡蛋白結(jié)合時(shí),它們的功能會被抑制,因此,阻止凋亡和抗凋亡蛋白之間的相互作用可以防止腫瘤細(xì)胞逃脫凋亡。
目前已開發(fā)了眾多 Bcl-Bax 抑制劑,包括?ABT-199 (venetoclax),ABT-737,?ABT-263 (navitoclax)?等。
P53-MDM2 PPI 抑制劑
? ? ?
? ? ?
MDM2 是 P53 最重要的負(fù)調(diào)節(jié)因子,可結(jié)合到 P53 的 N-末端的轉(zhuǎn)錄激活結(jié)構(gòu)域,抑制 P53 的轉(zhuǎn)錄活性,抑制細(xì)胞生長,調(diào)控細(xì)胞周期并誘導(dǎo)細(xì)胞凋亡。因此,破壞 MDM2-P53 相互作用是治療癌癥的潛在途徑。
目前,一系列 MDM2-P53 抑制劑已進(jìn)入臨床試驗(yàn):
?

?
?
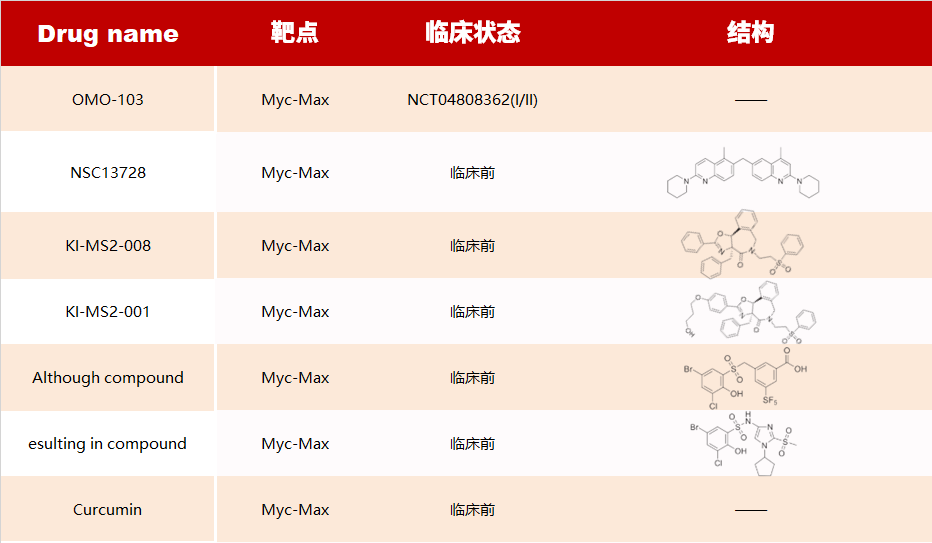
Myc PPI 抑制劑
? ? ?
? ? ?
Myc 癌基因,包括其三個(gè)亞型 C-Myc、N-Myc 和 L-Myc,被認(rèn)為是一種可以在不同類型的癌癥中觸發(fā)各種致癌轉(zhuǎn)錄程序的轉(zhuǎn)錄“放大器”。由于 Myc 缺乏結(jié)合小分子化合物的疏水口袋或凹槽,因此它也被認(rèn)為是一種難以藥物干預(yù)的靶點(diǎn)。迄今為止,尚未有獲批上市的 Myc 藥物,但有許多分子正在臨床前研究中。
?
?
當(dāng)然,以上僅是部分采用 PPI 策略針對“不可成藥“蛋白的例子,更多的還有 YAP/TAZ、β-catenin、XIAP 等,小陶在這路就不一一敘述了,大家可以點(diǎn)擊文末”閱讀原文“查看詳情~
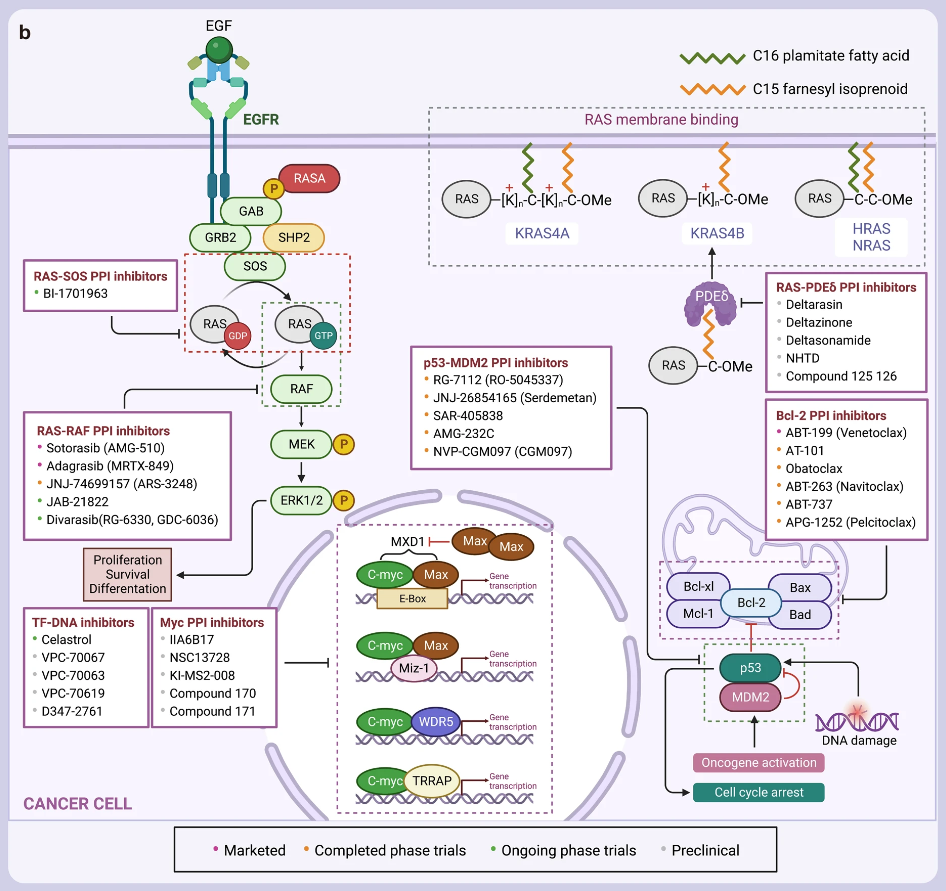
▲已上市、臨床和臨床前PPI抑制劑圖譜
鑒于那些“不可成藥”的蛋白質(zhì)大多具有相似的特點(diǎn),包括?表面平坦、缺乏活性位點(diǎn)?等問題,再加上蛋白質(zhì)與疾病之間的直接關(guān)聯(lián),因此,通過直接調(diào)節(jié)與疾病相關(guān)的蛋白質(zhì)已經(jīng)被證明是一種非常有前景的治療策略。根據(jù)疾病的機(jī)制,可以分為兩個(gè)主要類別:蛋白質(zhì)降解(TPD)和蛋白質(zhì)穩(wěn)定(TPS)。
基于蛋白酶體的靶向蛋白質(zhì)降解(TPD)
在這一領(lǐng)域表現(xiàn)較為出色的是蛋白降解靶向嵌合體(PROTAC)。PROTAC 是一種獨(dú)創(chuàng)性的蛋白質(zhì)調(diào)控方法,其核心作用機(jī)制是通過?泛素-蛋白酶體系統(tǒng) (UPS)?同時(shí)靶向感興趣的蛋白質(zhì)和 E3 泛素連接酶,形成三元復(fù)合物,在這個(gè)過程中,目標(biāo)蛋白質(zhì)被泛素標(biāo)記,促使其被蛋白酶體識別并降解。
PROTAC 技術(shù)也是靶向“不可成藥“蛋白的有前途的方法。目前已有一系列的研究正在進(jìn)行中:
?
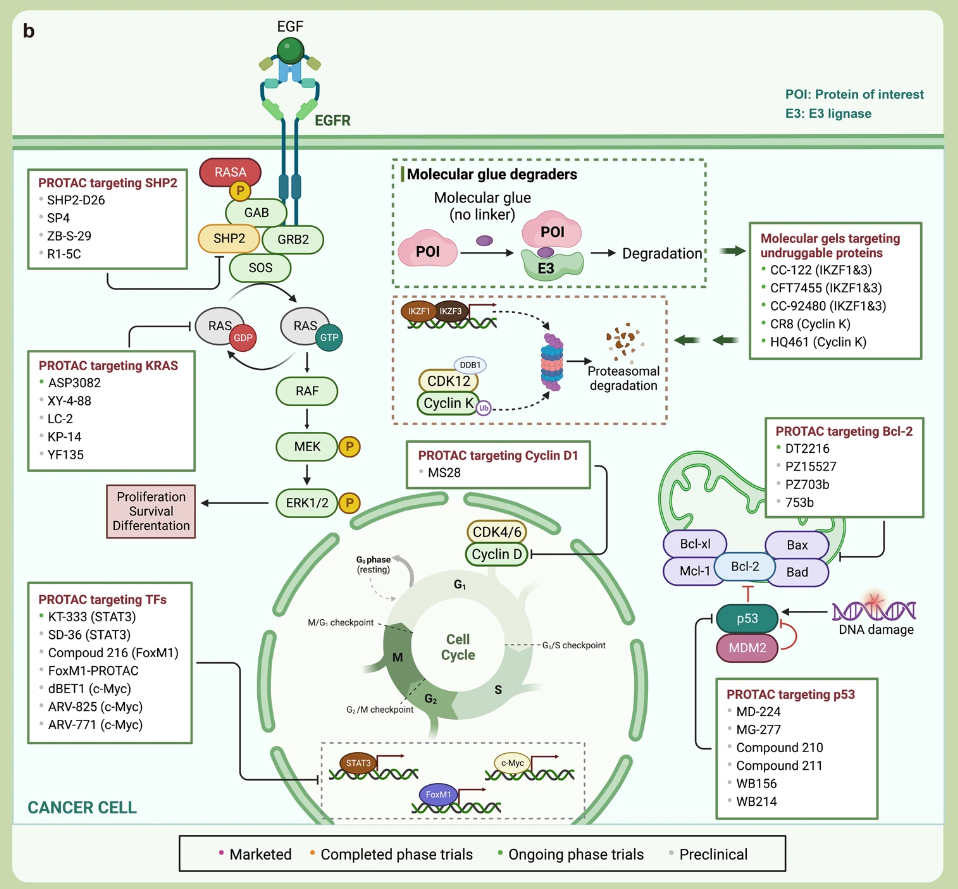
▲已上市、臨床和臨床前靶向蛋白質(zhì)調(diào)控分子的圖譜
?
除了 PROTAC 外,分子膠也是備受關(guān)注的靶向蛋白降解劑之一。在靶向蛋白降解 (TPD) 領(lǐng)域,分子膠通常是一種單價(jià)小分子 (<500Da xss=removed>(關(guān)于 PROTAC 與分子膠的區(qū)別可知乎搜索以下文章查看哦)
《什么是分子膠,和PROTAC有什么區(qū)別?靶向蛋白降解劑的原理及開發(fā)?》
目前已有多種分子膠藥物正在臨床試驗(yàn)中:
?
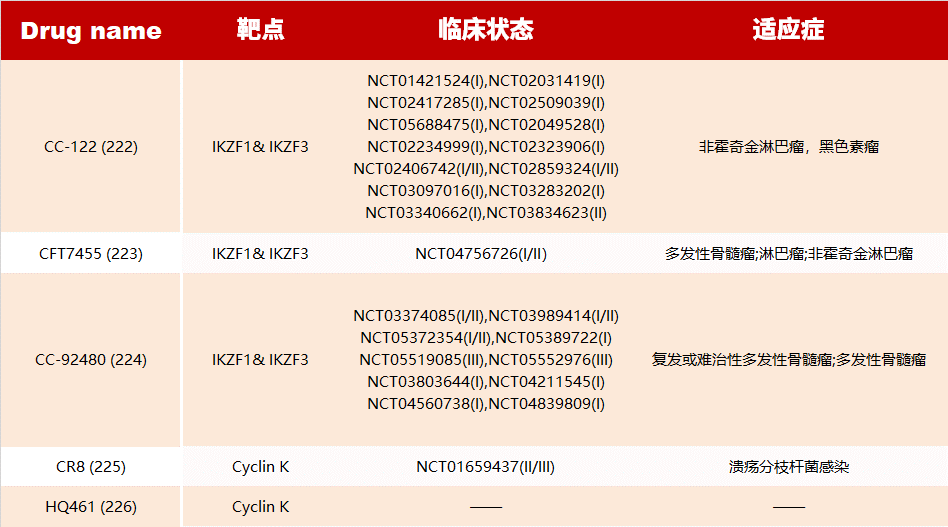
?
?
PROTAC 的潛力并不僅限于此,科研人員已開發(fā)出了可以靶向“不可成藥”蛋白的類 PROTAC 技術(shù)的變體。例如 P-PROTAC、PROTAB、CHAMP 以及基于溶酶體的 TPD 等技術(shù)。
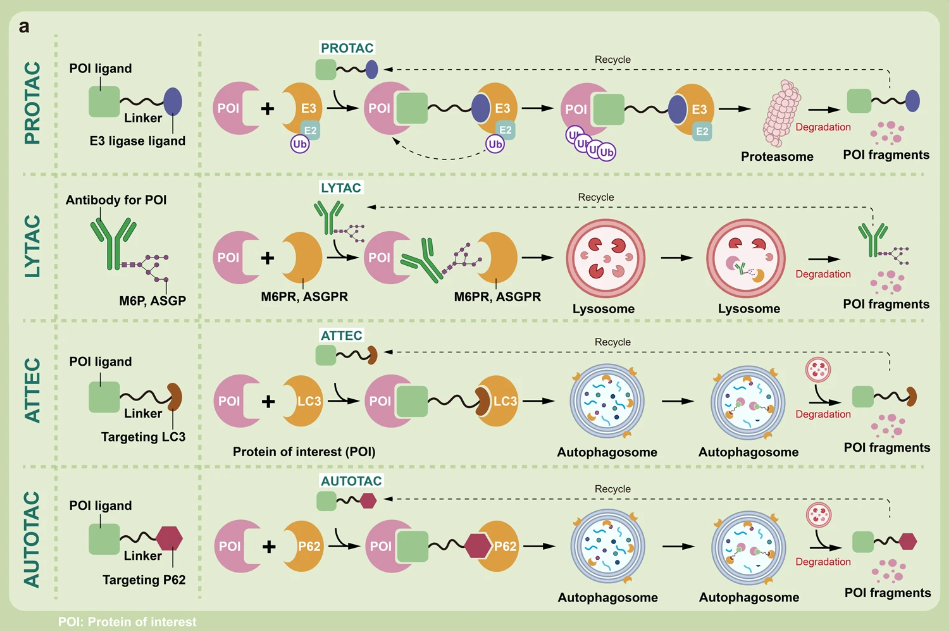
▲靶向蛋白質(zhì)調(diào)控策略
?
靶向蛋白穩(wěn)定(TPS)
盡管已經(jīng)證明在某些疾病治療中 TPD(蛋白質(zhì)降解)是有效的,但蛋白質(zhì)的過度降解可能會引發(fā)其他不良問題。因此,需要研發(fā)靶向蛋白質(zhì)穩(wěn)定的藥物,以?抵消蛋白質(zhì)的過度降解。研究人員正朝著這個(gè)方向不斷努力。
其中比較有應(yīng)用前景的是?去泛素酶靶向嵌合物(DUBTAC)。加州大學(xué)伯克利分校的 Nomura 團(tuán)隊(duì)受到 PROTAC 的啟發(fā),開發(fā)了 DUBTAC 用于靶向蛋白穩(wěn)定(TPS),并創(chuàng)造了分子?NJH-2-057,這種 DUBTAC 可有效抑制 ΔF508-CFTR 的降解,提高蛋白質(zhì)水平,并在囊性纖維化供體細(xì)胞中表現(xiàn)出很好的穩(wěn)定性。
?
在此基礎(chǔ)上,哈佛醫(yī)學(xué)院的 Wenyi Wei 團(tuán)隊(duì)又開發(fā)了一種?TF-DUBTAC?技術(shù),能夠選擇性地穩(wěn)定致癌蛋白,包括 FOXO3A、p53 和 IRF3 等,是一種很有前景的治療方法。
?
?
更多的靶向“不可成藥”蛋白的方法,如基于核酸的療法、免疫療法、針對上下游效應(yīng)物/輔因子的療法等小陶就不一一講啦,感興趣的朋友可以點(diǎn)擊“原文鏈接”查看原文哦~
總結(jié)
在藥物設(shè)計(jì)策略方面,針對那些難以成藥的蛋白質(zhì),目標(biāo)和思路都至關(guān)重要。這些蛋白質(zhì)與其他分子在生物網(wǎng)絡(luò)中存在復(fù)雜的相互關(guān)系,因此,針對多種生物過程,如?蛋白質(zhì)相互作用?和?RNA 介導(dǎo)的蛋白質(zhì)表達(dá),可能是一種有效的途徑。此外,針對難以藥物化的蛋白質(zhì)本身,有針對性的?共價(jià)抑制劑、變構(gòu)抑制劑?和?PROTAC?等新興技術(shù),可以通過控制或調(diào)節(jié)靶標(biāo)蛋白的活性,甚至直接降解這些蛋白質(zhì),從而實(shí)現(xiàn)“不可成藥”蛋白質(zhì)的藥物化。
?
陶術(shù)生物擁有 800+化合物庫,其中有一些是致力于不可成藥靶點(diǎn)的開發(fā)的,例如?PPI抑制劑庫、KRAS靶向化合物庫、表觀遺傳庫、轉(zhuǎn)錄因子庫?等,歡迎私信咨詢。
?
參考資料:
[1] Xie, X., Yu, T., Li, X. et al. Recent advances in targeting the “undruggable” proteins: from drug discovery to clinical trials. Sig Transduct Target Ther 8, 335 (2023). https://doi.org/10.1038/s41392-023-01589-z
[2] Henning, N.J., Boike, L., Spradlin, J.N. et al. Deubiquitinase-targeting chimeras for targeted protein stabilization. Nat Chem Biol 18, 412–421 (2022). https://doi.org/10.1038/s41589-022-00971-2
[3] Jing Liu, Xufen Yu, He Chen, H. ümit Kaniskan, Ling Xie, Xian Chen, Jian Jin, and Wenyi Wei
Journal of the American Chemical Society 2022 144 (28), 12934-12941. DOI: 10.1021/jacs.2c04824
?