
2023-09-06 15:27:28來源:吸入制劑瀏覽量:453
在過去的 35 年中,吸入制劑制造商采取了各種策略,在原研吸入制劑上設立監管獨占權和專利權,以限制仿制藥的競爭。
重視專利和監管獨占權
吸入制劑是治療哮喘和慢性阻塞性肺病的主要藥物。這些產品在美國面臨的仿制藥競爭不充分,而且價格依然昂貴。為了更好地了解原研吸入制劑制造商為維護其市場主導地位而采取的策略,我們分析了 1986 年至 2020 年間美國食品藥品監督管理局批準的所有吸入制劑專利和監管獨占權。在獲批的 62 種吸入制劑中,有 53 種是原研產品,這些原研產品在仿制藥競爭中的保護期中位數為 16 年。只有 1 種吸入制劑含有新作用機制的成分。一半以上的專利涉及吸入裝置本身,而不是這些藥物與裝置組合的活性成分或其他方面。制造商通過將活性成分從一種吸入裝置轉移到另一種吸入裝置("裝置跳轉"),進一步延長了原研市場獨占期。從原研產品獲批到原研后續產品專利或監管獨占權期最后到期的時間中位數為 28 年(14 種原研產品的器械循環)。監管改革對于確保原研吸入制劑制造商的專利權能更好地反映新產品的臨床效益至關重要。
吸入制劑是治療哮喘和慢性阻塞性肺部疾病(COPD)的主要藥物。盡管已上市數十年,但這些產品的價格仍然很昂貴,目前約占美國處方藥零售總額的 5%。高昂的吸入制劑價格導致自費支出增加,這可能會導致用藥依從性差以及哮喘和慢性阻塞性肺病加重更頻繁。解決這一問題的關鍵是了解阻礙仿制藥吸入制劑競爭的障礙。吸入制劑與胰島素筆、尼古丁貼片和其他的藥物-器械組合一樣,都含有藥物,這些藥物與給藥所需的器械一起出售。由于生產藥物-器械組合的復雜性,FDA 在批準可互換的仿制藥吸入制劑時采用了一套特殊的監管要求(一種綜合的 "證據權重 "方法)。仿制藥制造商必須進行體外、體內、藥效學或臨床終點研究,以及 "人為因素 "研究,證明患者可以像使用原研吸入制劑一樣無差錯地使用仿制吸入制劑。在滿足這些旨在確保可互換仿制藥-器械組合質量的監管要求時,仿制藥制造商必須避免侵犯原研產品的專利權。當原研制造商向 FDA 申請產品專利時,FDA 將被禁止批準該產品的仿制藥,直到專利到期或受到質疑并被推翻。
專利保護及其與監管體系的聯系為原研吸入制劑制造商通過某些 "生命周期管理 "策略限制仿制藥競爭創造了條件。他們還可以在獲得專利的同時獲得 FDA 授予的法定監管獨占權,在吸入制劑獲得批準后增加新的專利和監管獨占權,將舊的成分合并到新的產品中,并將活性成分從一種吸入裝置轉移到另一種吸入裝置。
美國食品及藥物管理局在 2000 年代中期禁止使用含有消耗臭氧層的氯氟烷烴 (CFC) 的吸入制劑,這在保護環境的同時,也為制造商尋求新策略以維護其獨占權創造了機會。如果監管者和政策制定者要實現促進仿制藥吸入制劑競爭的目標(美國食品及藥物監督管理局已將這一目標確定為主要優先事項),那么了解原研吸入制劑的制造商所采用的各種生命周期管理策略至關重要。
我們建立了一個新穎的數據庫,收錄了 1986-2020 年間美國食品及藥物管理局批準的吸入制劑的所有專利和監管獨占權,并分析了原研制造商如何將這些專利與監管獨占權結合使用,以限制仿制藥的競爭。
方法
隊列識別
我們使用每年的 FDA 批準藥物產品治療等效性評價(桔皮書)和 Drugs@FDA中的產品標簽來確定 1986-2020 年間批準的治療哮喘和慢性阻塞性肺病的吸入制劑產品。我們從 1986 年批準的產品入手,因為從那一年開始,《桔皮書》每年都有連續的版本。這意味著排除了當時已經上市的吸入制劑,如早期的沙丁胺醇產品(這些吸入制劑的完整清單見附錄附圖 A1)。
數據提取
我們從 Drugs@FDA 獲得了所有吸入制劑的 FDA 批準日期。對于批準后的每一年,我們使用當年的桔皮書提取吸入制劑的所有記錄專利和監管獨占權,以及這些專利和獨占權的到期日期。監管獨占權由 FDA 根據法定要求頒發,而專利權則由美國專利商標局 (USPTO) 授予,但兩者的作用都是阻止 FDA 批準仿制藥競爭者。為簡便起見,"監管獨占權 "和 "專營權 "這兩個術語可以互換使用。
我們使用 LexisNexis TotalPatent One 提取了每項專利的標題、摘要、權利要求、美國申請日期和美國公布日期。我們使用 Google Patents 提取優先權日期,即特定專利族中任何成員的最早申請日期,包括在美國以外申請的專利。這些優先權日期是美國 20 年專利期限的起點(根據藥品專利的特殊規定,專利期限可以延長)。我們查閱了每項專利的標題和摘要,必要時還查閱了全文,以確定專利是針對給藥裝置申請的,還是針對產品的其他方面(如活性成分、輔料或使用方法)申請的。我們將監管獨占權分為 FDA 批準時授予的獨占權(批準獨占權)和 FDA 批準后授予的獨占權(批準后獨占權),并將專利分為 FDA 批準前申請的專利(批準前專利)和 FDA 批準后申請的專利(批準后專利)。專利申請日期是根據已成為授權專利的美國申請確定的。為了進一步確定批準后專利的性質,我們還分析了批準后專利的優先權日期是在 FDA 批準之前還是之后。
保護免受直接競爭的期限
我們通過將某一產品的 FDA 批準日期減去桔皮書中所列該產品最后到期的專營權或專利的到期日,計算出該產品免受直接競爭的保護期限。我們對批準時的保護(最后到期的批準獨占權或批準前專利到期日與批準日之間的差額)和批準后獲得的額外保護(最后到期的批準后獨占權或專利與最后到期的批準獨占權或批準前專利之間的差額)進行了區分。授權的仿制藥藥是由原研制造商銷售或授權的原研產品,在本分析中不被視為直接競爭者。
統計分析
所有分析均在 STATA 16.1 (College Station, TX) 和 Excel 16.16.27 (Microsoft) 中完成。由于本研究不涉及人類受試者,因此無需獲得機構審查委員會的批準。
局限性
對于近期批準的產品,我們可能低估了批準前專利的數量(以及批準前專利保護的持續時間),因為臨近 FDA 批準時提交的專利可能仍在審查中或尚未列入桔皮書。同樣,由于近期批準的吸入制劑制造商幾乎沒有時間增加批準后專利或監管獨占權,我們可能低估了這些新增專利和批準后保護的持續時間。為了解決這一局限性,我們分析了制造商在 FDA 批準后增加專利和專營權的速度,而不僅僅是增加專利和專營權的絕對數量。盡管如此,我們的分析還是對制造商在 FDA 批準后增加專利和獨占權的頻率做出了保守的估計。最后,并非所有專利和獨占權都能阻止仿制藥競爭者進入市場。為了避免夸大專利和獨占權在阻止仿制藥競爭中的作用,我們還分析了當原研競爭者仍擁有有效專利或獨占權時,仿制藥競爭者進入市場的頻率。
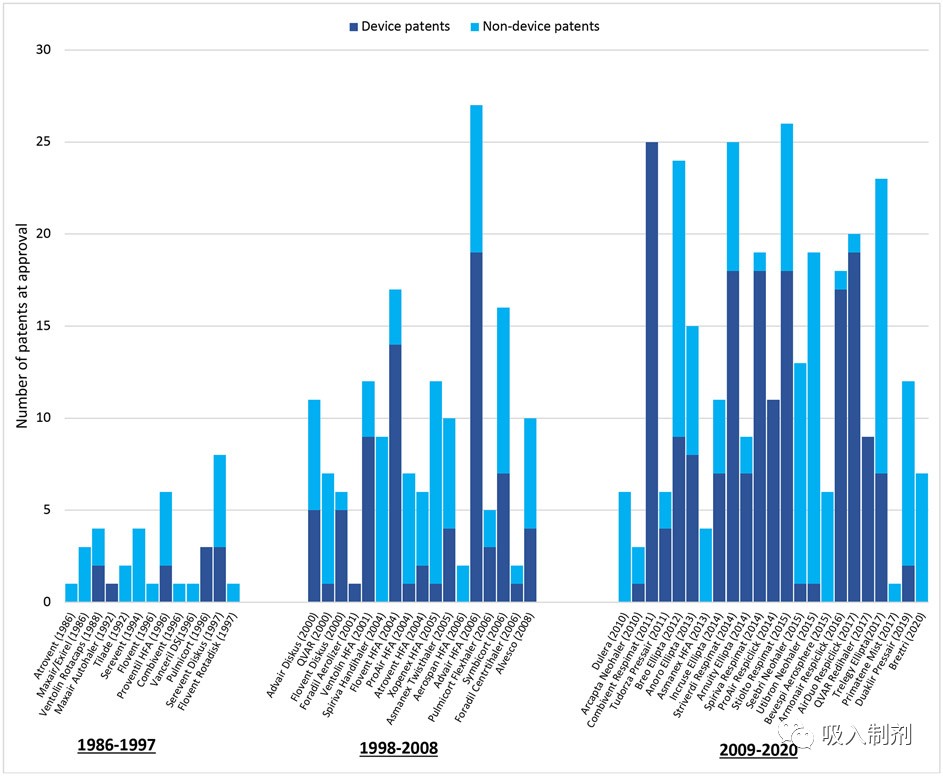
This figure includes patents granted to inhalers that were filed prior to FDA approval. The median number of pre-approval patents grew from 2 per inhaler (interquartile range [IQR] 1-5) from 1986-1997 to 9 per inhaler (IQR 6-12) from 1998-2008 and 12 per inhaler (IQR 6.5-19.5) from 2009-2020.
結果
1986 年至 2020 年間,FDA 批準了 62 種用于治療哮喘和慢性阻塞性肺病的吸入制劑(附錄 A2)。其中 53 種(85%)為原研產品,9 種(15%)為仿制藥產品,包括 7 種仿制藥沙丁胺醇吸入制劑和 2 種仿制藥氟替卡松-沙美特羅吸入制劑。這些吸入藥物有 4 種不同的作用機制:毒蕈堿類拮抗劑、?2-受體激動劑、皮質類固醇抗炎藥和肥大細胞穩定劑。在研究期間之前,這 4 種作用機制的藥物均已在美國市場上市,并作為 ?2-受體激動劑、皮質類固醇和肥大細胞穩定劑的吸入制劑供應(附錄 A1)。在研究期間進入美國市場的唯一一種具有新作用機制的吸入制劑是 1986 年批準上市的異丙托溴銨(Atrovent)。
長效吸入制劑和含有 2 種或 2 種以上活性成分的復方產品,共有 10 種治療類藥物:吸入性皮質類固醇(ICS)、長效毒蕈堿拮抗劑(LAMA)、長效β-受體激動劑(LABA)、ICS-LABAs、LAMA-LABAs、ICS-LAMA-LABAs、短效毒蕈堿拮抗劑(SAMA)、短效β-受體激動劑(SABAs)、SAMA-SABAs 和肥大細胞穩定劑。這 10 個治療類別中的 62 種吸入制劑含有 20 種不同的活性成分(見圖 1)。
FDA審批時的監管獨占權和專利權
17 種原研吸入制劑(32%)在作為新化學實體獲得批準時獲得了監管獨占權。這些獨占權適用于該組 20 種活性成分中的 13 種(一些制造商獲得了不止一種吸入制劑所含成分的獨占權)。在批準時未獲得新化學實體獨占權的 36 種原研吸入制劑(68%)中,30 種(57%)獲得了其他獨占權(包括新組合、新產品和新劑型的獨占權),6 種(11%)在批準時未獲得任何獨占權。
制造商列出了每種吸入制劑 7 項批準前專利的中位數(四分位數間距 IQR 3-13)。器械專利占這些專利的 55%(268/490)。在研究期間,每種藥物的批準前專利中位數從第一個十年(1986-1997 年)的 2 項(IQR 1-4)增加到第二個十年(1998-2008 年)的 8 項(IQR 6-11),再到最后十年(2009-2020 年)的 11 項(IQR 6.5-19)(見圖 2)。每種藥物的器械專利中位數從第一個十年的 0(IQR 0-2)增加到第二個十年的 3(IQR 1-5),再到最后十年的 7(IQR 1-14)。Advair HFA(氟替卡松-沙美特羅)的批準前專利數最多,為 27 項(包括 19 項器械專利),其次是 Stiolto Respimat(噻托溴銨-奧達特羅)26 項(18 項器械專利)、Striverdi Respimat(奧達特羅)25 項(18 項器械專利)和 Combivent Respimat(異丙托溴銨-沙丁胺醇)25 項(25 項器械專利)。
批準時的保護期中位數為 15.4 年(IQR 11.5-17.4)。吸入制劑的批準前專利數量與這些專利所提供的批準前保護總期限之間存在微弱的相關性(R2=0.25)(附錄A3)。
FDA批準后的監管獨占權和專利
在獲得 FDA 批準后,制造商又獲得了 68 項法定獨占權(附錄 A4)。這些獨占權是在吸入制劑獲得批準后以平均每 8.2 年每種吸入制劑增加一項的速度增加的。
在研究期間,制造商還獲得了 90 項批準后專利,即吸入制劑獲得批準后每 6.2 年獲得一項專利。77% 的批準后專利(69/90)的優先權日期在 FDA 批準之前,而 23% 的專利(21/90)的優先權日期在 FDA 批準之后。裝置專利占批準后專利的 73%(66/90)。在至少獲得一項批準后專利的 25 種吸入制劑中,有 11 種吸入制劑的批準后專利延長了專利保護期;這 11 種吸入制劑的專利保護期延長中位數為 7.1 年(IQR 1.8-8.2 年)。
免于競爭保護的總期限
總體而言,制造商從監管獨占權和專利中獲得的保護期中位數為 16.0 年(IQR 11.8-19.6)。最后到期的專利中有 53% 是器械專利(28/53)。SABA 類吸入制劑在 FDA 批準后獲得的中位保護期最長,為 19.6 年(IQR 10.0-21.4),其次是 SAMA-SABA 類 18.8 年(IQR 18.7-18.9)和 ICS-LABA 類 18.5 年(IQR 16.4-20.1)。
在研究樣本中的 53 種原研產品中,只有 1 種在其獨占權和專利到期前面臨可互換的仿制藥競爭:Teva 的 ProAir HFA(沙丁胺醇)擁有 27 年的專利保護期,但在 2020 年提前 11 年結束,盡管專利列在桔皮書中,但仿制藥競爭者還是獲得了 FDA 的批準。在這一案例中,仿制藥制造商 Perrigo 于 2012 年與 Tevain 達成和解,將進入市場的時間推遲到 2016 年,而 FDA 拒絕了 Perrigo 最初的審批申請,導致了進一步的推遲。減去因仿制藥提前進入市場而使 Teva 損失的 11 年時間后,同組中原研吸入制劑的市場獨占期中位數為 15.4 年(IQR 11.7-19.2 年)。
再生專利
專利經常涉及一種以上的產品。吸入制劑相關專利被列入桔皮書的中位數為 2 次(IQR 1-3)。在 35 個案例中,制造商在 4 種或更多產品上列出了相同的專利。其中 26 例(74%)涉及器械專利,包括勃林格公司的 Respimat 系列 18 例,GSK 公司的 Ellipta 和 Diskus 系列 4 例,梯瓦公司的 HFA 和 Respiclick/Digihaler 系列 2 例。這些產品線均跨多個類別:Respimat(LAMA、LABA、LAMA-LABA 和 SAMA-SAMA)、Ellipta(ICS、LAMA、LABA、LAMA-LABA 和 ICS-LAMA-LABA)、Diskus(ICS、LABA 和 ICS-LABA)和 Respiclick/Digihaler (ICS、ICS-LABA 和SABA)。
裝置跳轉
雖然藥品制造商通過專利和獨占權獲得了對吸入制劑的長期保護,但他們通過 "裝置跳轉 "獲得了對這些吸入制劑所含單個活性成分的更長時間的保護。這種策略是將相同的活性成分放入新的裝置中,并獲得新的專利和獨占權,以確保更長的保護期。例如,我們的分析表明,葛蘭素史克公司在其氟替卡松吸入制劑獲得 FDA 批準后,通過連續發布含有氟替卡松的新吸入制劑裝置,獲得了長達 35 年的競爭保護:Flovent(1996 年批準)、Flovent Rotadisk(1997 年)、Flovent Diskus(2000 年)、Flovent HFA(2004 年),以及最近的 Arnuity Ellipta(2014 年)。
總體而言,制造商通過 15 種不同的原研吸入制劑實施了這一戰略,并由此產生了 19 種不同的后續原研產品(見圖 3)。三種原研吸入制劑 PrimateneMist、Ventolin 和 Proventil 是在研究期間之前獲得批準的;所有其他原研吸入制劑和后續產品都是在研究期間獲得批準的。在 19 種后續吸入制劑中,有 7 種(37%)是氫氟烷烴吸入制劑,取代了消耗臭氧的氯氟烷烴吸入制劑。在分析中剔除一種產品(Primatene Mist,其原研藥于 1967 年獲批,當時還沒有桔皮書)后,制造商在原研藥獲批后到后續藥的獨占權或專利權最后到期前,獲得的競爭保護期中位數為 28.1 年(IQR 21.3-33.5)。這一策略之所以能夠奏效,是因為原研參比吸入制劑的仿制藥僅針對特定的原研產品(即一種特定的藥物-器械組合)獲得批準。因此,當原研制造商發布新版吸入制劑(新藥申請)時,舊產品的仿制藥不能與新產品互換,也不能在藥房自動替代該新產品。

*Denotes an inhaler containing chlorofluorocarbons (CFCs), which were removed from the market by the Food and Drug Administration beginning in the 2000s. This figure shows how manufacturers have preserved monopolies on inhaled medications by pairing old active ingredients with new devices. The notched dark blue bars represent the time that elapsed between the first patents filed for an originator product and FDA approval of that product. The solid dark blue bars represent the time that elapsed between FDA approval of an originator product and the last-to-expire exclusivity or patent on the originator or follow-on products. This reflects the total protection that a manufacturer has obtained on inhalers with a given active ingredient (or ingredients). The notched grey bars represent the time that elapsed between the first patents filings for a given product and FDA approval of that product. The solid grey bars represent the time that elapsed between FDA approval of a given product and the last-to-expire exclusivity or patent on that product. A median of 40.3 years (IQR 33.9-45.8) elapsed between the first patent filed on originator inhalers and the last-to-expire exclusivity or patent on these inhalers or their follow-ons. Manufacturers enjoyed a median of 28.1 years (IQR 21.3-33.5) of protection on these inhalers after FDA approval of the originator.
從專利申請到最后到期的專利或獨占權到期的時間
制造商在獲得 FDA 批準前 15.1 年(IQR 9.5-16.8)申請了吸入制劑的首批專利(附錄 A5)。從某一產品首次申請專利到該產品最后一項專利或獨占權到期的時間中位數為 29.2 年(IQR 23.3-35.4)。ICS-LABA類吸入制劑的中位時間最長,為35.5年(IQR 35.2-36.7),其次是LAMA類,為34.6年(IQR 32.7-35.4)。
在上一節分析的 14 個裝置跳轉案例中,從原研產品首次申請專利到原研產品或后續產品最后一項專利到期的中位時間為 40.3 年(IQR 33.9-45.8)(見圖 3)。葛蘭素史克公司于 1967 年為其沙丁胺醇吸入制劑(Ventolin)申請了專利,其后續產品沙丁胺醇吸入制劑的專利有效期至 2026 年,即在首次申請專利 59 年后,產品之間的間隔僅為 3 年。葛蘭素史克公司于 1981 年申請了首個氟替卡松吸入制劑(Flovent)專利,其后續氟替卡松吸入制劑的專利有效期到 2030 年,即從首次申請到現在的 49 年,產品之間沒有間隔。在葛蘭素史克公司的氟替卡松-沙美特羅吸入制劑和梯瓦原研公司的氯地米松吸入制劑上,我們也看到了類似的不間斷專利串,專利期長達 46 年。
討論
在過去的 35 年中,美國食品及藥物管理局批準了 62 種治療哮喘和慢性阻塞性肺病的吸入制劑,涉及 10 個治療類別,但制造商提供的新藥創新卻寥寥無幾。只有一種吸入制劑含有新作用機制的活性成分。制造商并沒有開發新的治療模式,而是改變了吸入式藥物輸送裝置的設計,并試圖通過監管獨占權和專利來維護其市場份額,尤其是在這些裝置上,在我們的隊列中,吸入制劑制造商列出的所有專利中,有一半以上都是這些專利。制造商在不同類別的多種吸入制劑上重復使用相同的專利,并通過將舊的成分轉移到新的裝置上,在單個產品上行使市場權力。其結果是,許多受保護的原研吸入制劑含有首次獲批于幾十年前的活性成分,2022 年初,美國市場上只有 3 種原研吸入制劑面臨可互換仿制藥的競爭(2 種原研沙丁胺醇吸入制劑和 1 種原研氟替卡松-沙美特羅吸入制劑)。盡管同類原研內的競爭可能有助于限制價格,但可互換的仿制藥藥競爭的匱乏限制了節約醫療支出。
我們的研究結果突顯了美國現行監管體系是如何獎勵對老產品進行增量調整的。使用氫氟烷烴(HFAs)作為推進劑的新型吸入制劑取代了含氯氟烷烴產品,并獲得了專利和獨占權的長期保護。也許最突出的例子就是Boehringer公司的 Combivent(沙丁胺醇-異丙托溴銨)系列,從 1996 年含氯氟烷烴版本獲得批準到 2030 年非氯氟烷烴版本專利最后到期,該產品目前已擁有 34 年的專利保護期。如果不進行監管改革,隨著制造商開發出更環保的吸入制劑來替代含氫氟烷烴的產品,這一過程很可能會重演,而氫氟烷烴產品本身就是溫室氣體的強效排放者。
盡管氯氟烷烴禁令可能有助于延長原研制造商獲得的市場獨占權,但在研究期間,吸入制劑的許多增量調整與禁令并無直接關系。約有三分之二的裝置更換涉及到不同類型的吸入制劑(定量壓力吸入氣霧劑、干粉吸入制劑和軟霧劑吸入制劑),而不是從含 CFC 的產品更換為含氫氟烷烴的產品。一些患者可能會從一種類型的吸入制劑裝置中受益(基于吸氣力量、靈巧性等因素),但治療指南并不傾向于任何特定類型的吸入制劑裝置,只要臨床醫生向患者提供有關正確技術的指導,并且患者能夠自如地使用所選裝置即可。
部分問題可能是臨床醫生的教育不足,也許裝置類型的激增加劇了這一問題,但依從性差仍然是一個挑戰。更重要的是,只要吸入制劑技術的改進能帶來理想的獲益,無論是與環境還是與患者的治療效果有關,那么根本的問題仍然是,這些獲益--在許多情況下即使有創造性,也只是微不足道的創造性--是否值得當前的監管體系給予數十億美元的獎勵。
2021 年桔皮書透明法案要求 FDA 和政府問責辦公室闡明并解決桔皮書中有爭議的列名問題,包括藥物與器械組合的專利問題。首先,可以禁止原研制造商在桔皮書中列出器械專利。在桔皮書中列出專利可以使制造商在潛在的仿制藥制造商提出專利挑戰時獲得額外的獨占權。此外,FDA 還可以阻止制造商在獲得批準后向桔皮書中添加專利,除非這些專利保護的是與真正的臨床益處相關的改動。與此相關,FDA 可以要求尋求在桔皮書中列出新版藥物-器械組合專利的原研制造商(例如,含有活性成分的軟霧吸入制劑已經以氫氟烷烴版本出售)在臨床試驗中證明新版本的優越性。
其次,除了桔皮書改革外,另一種削弱專利堆疊激勵機制的建議方法是通過新的立法,允許制造商在批準仿制藥藥時只申請一項專利或獨占權,以獲得 FDA 的認可(這種方法被稱為 "一步到位")。
最后,除了這種直接的監管改革外,美國專利商標局的改革也有助于提高已授權專利的質量。在這種模式下,美國專利商標局的一個由經驗豐富的審查員組成的小組將對桔皮書中的專利進行審查,以檢索現有技術,評估專利有效性,并對具有挑戰性的案件進行審議。這種方法對于藥物與裝置的組合可能特別有價值,因為這種組合需要結合工程和制藥方面的專業知識來進行適當的審查。
專利和監管獨占權一直是拖延仿制藥吸入制劑競爭的重要原因。然而,應該指出的是,這些并不是唯一的原因。FDA 對尋求批準仿制藥的藥物-器械組合的制造商提出了許多要求,這些要求超過了對簡單口服藥物的要求。FDA 正在想方設法簡化藥物-器械組合的審批程序,但這些產品的復雜性使其很難建立適當的互換性標準。
結論
在過去的 35 年中,吸入制劑制造商采取了各種策略,在原研吸入制劑上設立監管獨占權和專利權,以限制仿制藥的競爭。監管改革對于確保原研制造商的回報更好地反映新產品的額外臨床效益至關重要。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容