
2023-08-09 00:00:00來源:百奧利盟官方發布瀏覽量:182
上海市監局近日發布的《藥品生產全過程數字化追溯體系建設和運行規范》,于2023年8月01日起正式實施,百奧利盟?系統合規賦能生物醫藥數字化轉型升級,提供藥品生產全生命周期追溯解決方案。

上海市監局近日發布的《藥品生產全過程數字化追溯體系建設和運行規范》,于2023年8月01日起正式實施。該規范覆蓋從物料進廠至產品出廠的全生命周期;實現生產部門、質量管理部門、檢驗部門等各個部門之間數據的互聯互通;實現原輔料采購及驗收、中間品生產環節、成品生產環節、產品倉儲環節和銷售物流等全部環節的關鍵參數的監測與控制,以達到藥品生產全生命周期的追溯閉環。
藥品質量安全是重大民生和公共安全問題,保障藥品生產全過程可追溯是藥品生產質量管控的重要手段。通過數字化轉型,實現藥品生產全過程信息追溯,可以打通藥品生產、檢驗各環節之間的數據壁壘,保障數據真實、準確、完整和可追溯,促進風險發現和控制、偏差預防和糾正,確保操作流程的合規性和信息透明度,從而持續保證藥品的安全、有效和質量可控。

1.范圍:規定了藥品生產全過程數字化追溯體系建設和運行的總體要求、體系構成、合規管理及數據管理。
5.總體要求:
5.1 全程數字化
藥品生產全過程數字化追溯體系以藥品生產全過程信息的數字化采集、控制和保存為基礎,應覆蓋物料進廠至產品出廠的全過程,實現對原料、輔料和包裝材料的采購及驗收、中間品生產環節、成品生產環節、檢驗環節、倉儲環節和銷售物流等全部環節關鍵參數的監測與控制。
5.2 網絡集成
藥品生產全過程數字化追溯體系應建有互聯互通的網絡,實現設備控制、信息管理、運營管理等各層級系統,以及生產部門、質量管理部門、檢驗部門、倉儲部門等各部門之間數據集成和互聯互通。
6.體系構成:
6.1 體系架構
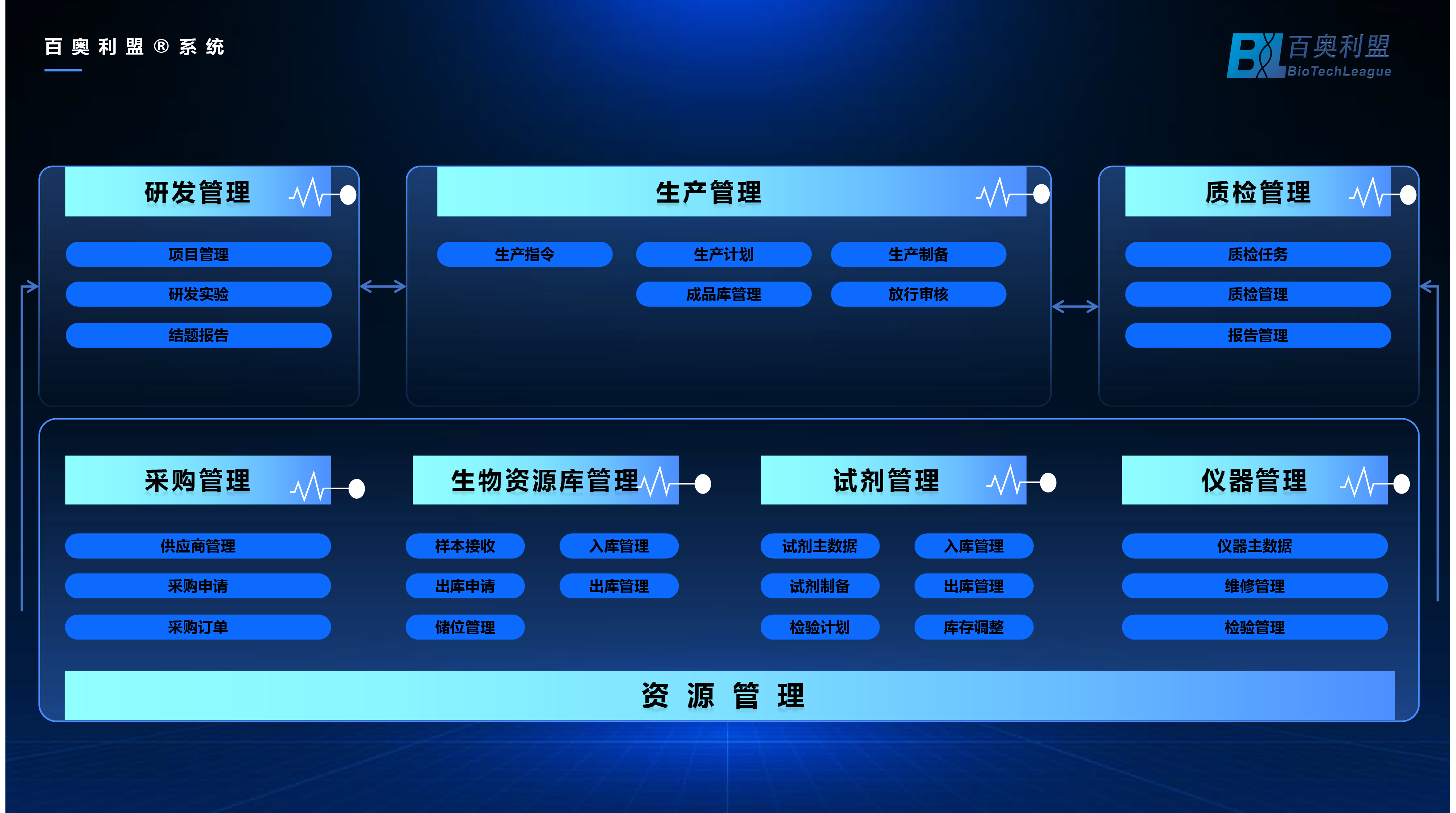
藥品生產全過程數字化追溯體系架構宜由生產制造管理、倉儲管理、實驗室信息管理、質量管理、成品追溯等5大業務系統,以及綜合監控管理、設備管理、文檔管理、培訓管理、視頻監控管理等5大支持系統構成。
藥品生產企業的數字化追溯體系架構至少應包括文檔管理、倉儲管理、實驗室信息管理、成品追溯、綜合監控管理等系統,以滿足藥品生產過程追溯的基本要求。
7.合規管理:
7.1基本要求與權限管理
遵循藥品生產全過程數據滿足可溯源、清晰、同步、原始、準確(ALCOA)原則,至少應具備權限管理、審計追蹤、電子簽名、時鐘管理等功能。
實現用戶角色和權限管理的制度化與標準化,確保系統使用規范和安全。
8.數據管理要求:
數據硬件/軟件接口要求、數據采集和傳輸要求,數據備份與安全,以及藥品生產全過程追溯系統在數據驗證與存儲方面,應保證數據的同源性和數據的一致性且應能夠驗證。
百奧利盟提供的數字化解決方案完全符合生命科學行業的法規和規范,主要從基本法規、實驗室規范、生產GMP規范三個層面,具體內容如下:
基礎法規層面:符合21 CFR Part11(電子記錄及電子簽名法規)、 ALCOA+CCEA原則(數據可靠性原則)以及中華人民共和國電子簽名法;
實驗室規范層面:符合GLP(良好實驗室規范)、ISO17025(檢驗與校準實驗室證),ISO15189(醫學實驗室認證),CAP/CLIA(美國病理家協會實驗體系認證)等相關法規對計算機化系統的要求;
生產GMP規范層面:符合 ISPE GAMP5,NMPA《計算機化系統》、NMPA 《藥品記錄與數據管理規范》、 NMPA 《生物制品》、 NMPA 《細胞治療產品生產質量管理指南(試行)》以及FDA和歐盟的相關法規和規范;
區別于化學合成或半合成方法制造而成的化藥,利用生物技術制造的生物藥(主要包括基因工程藥物、細胞療法、基因療法等),制造過程中涉及到基因克隆、重組蛋白表達、細胞培養等生物技術,制造過程較為復雜,且生物藥的質量和穩定性也較難控制,需要嚴格的生產工藝和質量控制體系。
百奧利盟?系統服務并支持全球300+實驗室、科研院所及生物藥研發生產型企業的日常信息化管理工作,積累了十多年行業最佳實踐經驗,針對生物藥品種類多、流程各異、工藝升級快、技術平臺多等實際問題,高效地幫助客戶通過數字化解決方案,從臨床前研究到臨床I II II階段(實驗室、小試規模、中試規模生產),直至未來生產階段(商業規模化生產上市)的全流程都有相對應的信息化系統進行高效的智能化管理,可以根據不同客戶的實際需求與發展階段,進行模塊化構建與組裝。
不僅”保證合規性、減少合規成本、實現數據與信息追溯,實現數據集成與多部門互聯、解決信息孤島“,而且通過可視化的系統中臺,幫助管理者實現宏觀策略布局的掌控、實時高效的統籌協調,以及各流程環節標準化管理與權限設置,信息數據可追溯與安全監管,百奧利盟?系統使一切皆在掌控之中----合規、安全、智能、可追溯。
(1)研發部門
研發管理:項目管理、研發實驗、結題報告
百奧利盟?系統數字化解決方案根據客戶業務范圍或研發項目方向,靈活的SOP工作流模塊支持拖拽式自定義設置,更加高效、準確進行信息數據錄入和公式算法自動化生成,避免人工疏漏失誤,快速生成結題報告;支持項目維度檢索數據,提高研發管理水平。對于研發的成果,研發項目進度等方面進行評估和控制;通過培訓管理模塊制定培訓計劃(包括且不僅限于年度培訓周期輪次、培訓課件內容設置、考核標準、培訓記錄等),確保人員技能&素質水平處于穩定專業的理論與實操能力,從而提高企業整體的“安全、質量、成本”管理成效。
(2)生產部門
生產追溯:生產指令、生產計劃、生產制備、放行審核、成品庫管理
百奧利盟?系統數字化解決方案可以對生產操作全流程進行安全、準確、可追溯管理,包括生產設備/用具的驗證以及計量有效期自動判斷、物料準備掃碼、設備開關機記錄、生產操作記錄、取樣記錄、生產余料退庫、電子簽名、樣本標簽管理等。這樣可以確保生產過程的安全、準確、可追溯,避免人為因素對生產過程的影響。
百奧利盟?系統數字化解決方案可指導生產人員按照SOP要求,完成生產前準備及檢查、生產過程記錄、檢驗樣品取樣以及送檢、完工清場等過程,根據過程內容自動生成電子批生產記錄。電子批生產記錄既可以在線查閱,也可以線下打印審核。批記錄準確地記錄每批次的生產信息,避免了手工記錄時可能出現的錯誤和遺漏,方便管理和追溯。在電子批記錄中,可以方便地查看生產的各個環節,包括原輔料的使用情況、操作過程、質控取樣過程、清場過程。
(3)質量部門
質檢管理:質檢任務、質檢管理、報告管理
還包括且覆蓋:文檔管理(管理質量體系文檔的管理,如起草、審核、生效、生成授控、權限查閱)、培訓管理(培訓計劃、參與人員、培訓考核等管理確保高水準安全操作的業務能力)、環境管理(可根據實際情況,安排環境監測周期、記錄環境數據)
百奧利盟?系統數字化解決方案可以幫助管理者更有效統籌管理從研發、生產、采購部門的不同來源樣本安排質檢計劃,從而更合理高效地分配使用設備、儀器、樣本庫管理;通過報表的形式抓取質檢結果,根據時間段、批次、檢驗類別、檢驗項目等檢索條件,快速篩選和整理所需數據,為年度質量回顧和注冊申報提供快捷、高效、準確的數據整理支持;通過培訓管理模塊制定培訓計劃(包括且不僅限于年度培訓周期輪次、培訓課件內容設置、考核標準、培訓記錄等),確保人員技能&素質水平處于穩定專業的理論與實操能力,從而提高企業整體的“安全、質量、成本”管理成效。
(4)其他支持功能
資源管理:采購管理(供應商管理、采購申請、采購訂單)、生物資源庫(樣本接收、入庫管理、出庫申請、出庫管理、儲位管理)、試劑管理(試劑主數據、入庫管理、出庫管理、試劑制備、檢驗計劃、庫存調整)、儀器管理(儀器主數據、維修管理、校驗管理)
百奧利盟?系統數字化解決方案幫助客戶有效分配與使用現有資源,真真正正實現了對資源的實時監管與協調,通過更科學的計劃、更靈活的統籌分配,確保各部門順暢的標準化流程執行與管理,避免出現人為錯誤疏漏、資源浪費或閑置,數據信息真實可追溯,為管理者決策(糾錯/應急處理等)提供可參考的數據信息和真實依據。
-----------------------------------------------------------------------------
參考資料:
《藥品生產全過程數字化追溯體系建設和運行規范》
相關法規和規范:
? HIPPA(病人隱私信息保護法案)
? 中國人類遺傳資源管理條例
? 21 CFR Part11(電子記錄及電子簽名法規)
? 中國電子簽名法
? ALCOA+CCEA原則(數據可靠性原則)GMP相關規范
? NMPA 2010年5月 GMP附錄《計算機化系統》《確認與驗證》
? NMPA 2020年2月 《藥品記錄與數據管理規范》
? NMPA 2020年7月 GMP附錄 《生物制品》
? NMPA 2020年1月 《藥品生產質量管理規范-細胞治療產品附錄》COI(身份鏈)COC(監管鏈)
? EU 歐盟藥事法規第4卷GMP,附錄11《計算機化系統》
? ISPE GAMP5-2 良好自動化生產實踐指南,遵從GxP計算機化系統監管的風險管理方法
? ISPE PHARMA4.0
? WHO GMP 2003,Annex4實驗室相關規范
? GLP-計算機化系統的要求
? PCR臨床實驗室規范
? ISO17025(檢驗與校準實驗室認證)
? ISO15189(醫學實驗室認證)
? ASTM E 2066(實驗室信息管理系統的鑒定標準導則)
? ASTM E 1578(實驗室信息管理系統(LIMS)的標準指南)
? CAP/CLIA(美國病理家協會實驗體系認證)
? AAALAC(國際實驗動物規范)
? AABB(生物樣本庫國際認證)