
2023-08-02 00:00:00來源: TargetMol小分子化合物專家瀏覽量:203
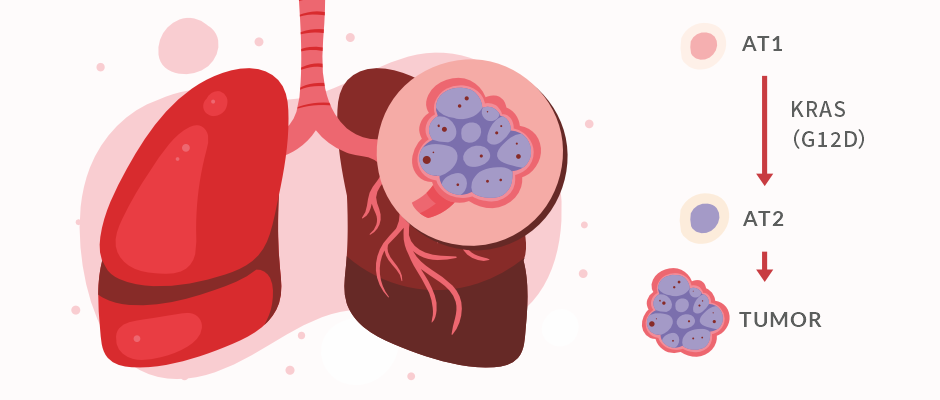
肺腺癌 ( LuAD ) ,是近年來每年死亡數最多的癌癥之一。據統計,在美國,每天都有超過 350 人死于肺癌[1]。大量研究表明,肺癌的發生與吸煙、環境污染、電離輻射相關,但具體的病因仍不明確。近日 Nature 上一篇文章,揭示了 KRAS(G12D) 驅動一種鱗狀肺腺癌的分子機制,讓我們一起跟隨 T 仔來看看吧~
?
肺泡是由單層上皮細胞構成的半球狀囊泡。肺泡上皮由兩種高度特化的細胞組成,分別是肺泡 1 型( alveolar type, AT1 ) 細胞和肺泡 2 型 ( AT2 ) 細胞[2]。其中,AT1 為肺泡表面主要的細胞類型,負責氣體交換的功能,細胞形態呈鱗狀,薄而扁平。AT2 是一種“雙功能”干細胞,形態呈較小的立方形,負責產生肺表面活性物質,并且可以作為兼性祖細胞,在成人肺損傷后自我更新和再生 AT1 細胞。

肺腺癌常出現在肺的遠端氣體交換區域 ,其特征是具有 AT2 細胞學特征與分子特征的腫瘤細胞。 已有多項研究指出,AT2 細胞是 LuAd 的關鍵起源細胞,AT2 的干細胞活性由表皮生長因子受體配體 ( EGFR ) 和體內致癌性 KRAS(G12D) 選擇性誘導,在小鼠體內誘導 KRAS(G12D) 后會產生腺瘤腫瘤結節[3]。
?
但在人類 LuAd 譜中還有一種非常良性的亞型,被稱為鱗狀腺癌 ( human lepidic LuAd ) ,以腫瘤細胞沿著完整的肺泡間隔非破壞性擴散為特征,其的腫瘤細胞在細胞學和分子上類似于 AT2 細胞,但目前并沒有任何 LuAd 小鼠模型能夠重現以鱗狀方式緩慢擴張的肺泡腫瘤,這種良性表型細胞的起源和分子機制仍不明確。
?
2023 年 7 月 19 日,來自斯坦福大學的研究團隊在 Nature 發文 KRAS(G12D) drives lepidic adenocarcinoma through stem-cell reprogramming ,揭示了 KRAS(G12D) 通過將分化的 AT1 細胞重新編程回 AT2 干細胞,從而生成惰性腫瘤的過程。
?

https://www.nature.com/articles/s41586-023-06324-w
?
鑒于鱗狀腺癌與其他?LuAd 亞型重疊的突變譜以及其獨特的生物學特性,作者認為鱗狀腺癌的起源應該并非 AT2 細胞。而 AT1 細胞作為唯一的另一種肺泡上皮細胞類型,引起了作者的注意。但通常而言, AT1 ?細胞被認為是終末分化的,并且在整個生命過程中由 AT2 干細胞再生而來。因此,可能存在一種促進 AT1 ?細胞去分化重編程的機制,比如 LuAd 中常見的致癌基因突變 —— KRAS (G12D)。
?
研究通過基因改造,靶向誘導小鼠 AT1 細胞中 KRAS(G12D) 的表達。 6 個月后觀察到不同程度的介于鱗狀和立方體形態之間的細胞。單細胞 RNA 測序 ( scRNA-seq ) 結果也顯示, 相當一部分 AT1 細胞在 KRAS(G12D) 的誘導下會逐漸喪失 AT1 細胞的分子表型,被重編程為 AT2 細胞 ( iAT2 ) 。并且重編程的 iAT2 細胞在轉錄組學上與正常的 AT2 細胞非常相似,大部分還具有增殖所必須的WNT活性。但同時也存在一些并不會被 KRAS(G12D) 誘導影響的 AT1 細胞。
?

KRAS(G12D) 將 AT1 細胞異步重編程為 AT2 干細胞
?
相較具有干細胞活性的 AT2 而言, AT1 細胞中 KRAS(G12D) 的表達具有較弱的致癌性,6 個月的誘導表達也僅產生貼壁的腺瘤或是結節,這可能也解釋了為何 AT1 細胞來源的這種鱗狀腺癌為何具有更良性的表型。
?
在 AT1 和 AT2 兩種來源的腫瘤細胞中,下游絲裂原激活蛋白激酶 (MAPK) 通路的 JNK 通路無顯著差異,均具有較高的活性,但 AT1 驅動的癌細胞中 ERK 通路的磷酸化程度顯著更低。提示了我們 JNK 通路在 KRAS 激活 AT1 細胞中的重要作用。
?
進一步的實驗發現,在 KRAS(G12D) 和 WT KRAS 小鼠 AT1 表型 (NKX2-1+ LAMP3- ) 細胞中, pJUN 染色也沒有差異。這說明了 KRAS(G12D) 下游 MAPK 激活的失敗可能是部分 AT1 細胞未能重編程為 AT2 細胞的原因所在。
與此同時,AT1 和 AT2 兩種來源的腫瘤細胞對于 WNT 的激活也顯示出截然不同的反應。在 AT1 細胞中 WNT 的激活對 ERK 活性并無影響,并且會降低 JNK 活性,使得與腺瘤生長相關的 MAPK 總活性較低,起到抗腫瘤生長的作用。在 AT2 細胞中 WNT 的激活會顯著增加 ERK 活性,降低 JNK 活性,驅動腺瘤的增殖生長。
?
這表明, ERK 通路的激活可能是 AT1 腺瘤進展的關鍵驅動因素。在給予 KRAS(G12D) 誘導 AT1 細胞1 周的小鼠含有 PLX4720 (ERK 信號傳導激動劑)、PD0325901 (MEK1/2 抑制劑(ERK 直接上游))或不含添加劑的飼料 11 周后,染色結果證實腺瘤數量和大小與 ERK 活性水平密切相關。 ERK 通路激活不僅促進了 AT1 細胞的腺瘤轉化,還驅動了腫瘤的生長和組織學進展。
?
?
?
綜上,本研究鑒定出了一種新的肺腺癌起源細胞,AT1 細胞。在小鼠肺中, AT1 細胞會被 KRAS(G12D) 驅動重編程為 AT2 細胞,并且激活 MAPK 信號通路,生成惰性腫瘤。提示我們針對 KRAS(G12D) 靶點以及 MAPK 信號通路的藥物開發可能是肺腺癌治療非常有前景的新方向。
?
科研助力
?
當下,KRAS?相關研究依舊如火如荼,TargetMol? 可為您提供 MAPK 抑制劑庫,助力您的科研需求。歡迎點擊下方產品跳轉產品頁查看,如感興趣或有疑問可私聊 T 仔咨詢噢~

? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?
https://www.targetmol.cn/compound-library/MAPK_Inhibitor_Library
?
MAPK 是信號從細胞表面傳導到細胞核內部的重要傳遞者。絲裂原活化蛋白激酶 (MAPK) 是一組能被不同的細胞外刺激活化的蛋白激酶,如細胞因子、神經遞質、激素、細胞應激及細胞黏附等。MAPK 鏈是真核生物信號傳遞網絡中的重要途徑之一,在基因表達調控和細胞質功能活動中發揮關鍵作用。共同調節著細胞的生長、分化、對環境的應激適應、炎癥反應等多種重要的細胞生理和病理過程。
?
TargetMol MAPK 抑制劑庫是有367個MAPK信號通路相關的小分子的集合,用于研究MAPK信號通路及相關疾病藥物篩選。
?
參考文獻:
[2] Hogan, B.L., Barkauskas, C.E., Chapman, H.A., Epstein, J.A., Jain, R., Hsia, C.C., Niklason, L., Calle, E., Le, A., Randell, S.H., et al. (2014). Repair and regeneration of the respiratory system: complexity, plasticity, and mechanisms of lung stem cell function.Cell Stem Cell 15, 123–138.
[3]Desai TJ, Brownfield DG, Krasnow MA. Alveolar progenitor and stem cells in lung development, renewal and cancer.?Nature. 2014;507(7491):190-194. doi:10.1038/nature12930
[4] Juul NH, Yoon JK, Martinez MC, et al. KRAS(G12D) drives lepidic adenocarcinoma through stem-cell reprogramming [published online ahead of print, 2023 Jul 19].?Nature. 2023;10.1038/s41586-023-06324-w. doi:10.1038/s41586-023-06324-w