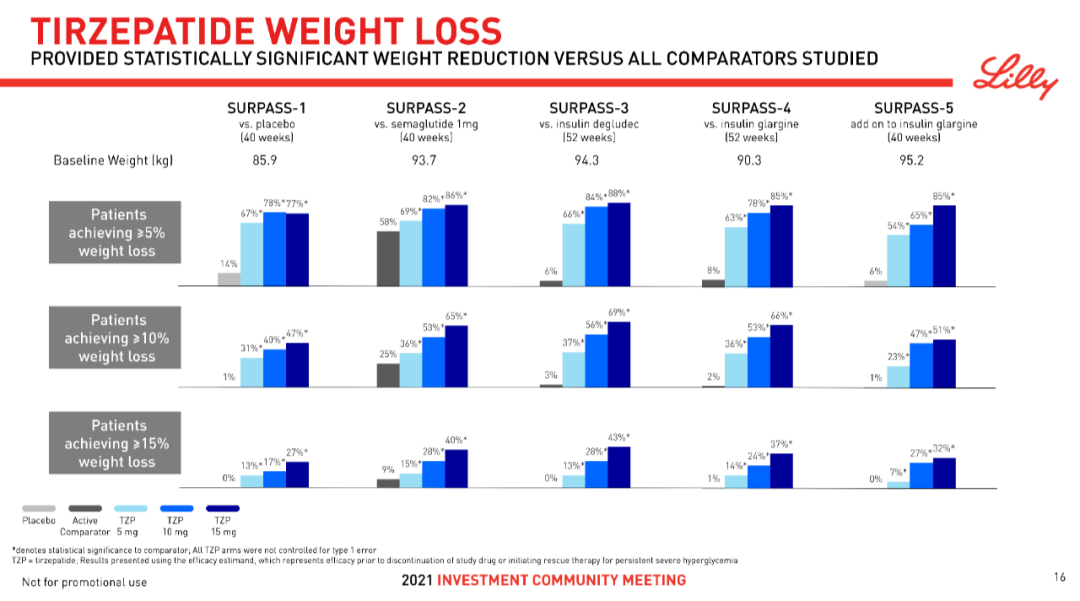
據外媒Endpoints報道,禮來正在向FDA提交Mounjaro(Tirzepatide)用于治療肥胖癥的最新III期數據,并將使用一張優先審查券將審查時間由標準的10個月縮短至6個月。禮來執行副總裁兼糖尿病領域負責人Mike Mason在公司第一季度業績電話會議上表示,這可能會使減肥適應癥在今年年底獲得批準。滾動提交已經在進行中,預計將在未來幾周內完成申請。4月27日,禮來公布了Tirzepatide治療肥胖或超重的2型糖尿病成人患者的SURMOUNT-2研究數據:較高劑量的Tirzepatide可幫助患者在72周內減輕15.7%的體重,即15.6kg,而較低劑量的Tirzepatide可使患者體重減輕13.4%,即13.5kg。Tirzepatide是一款每周注射1次的GLP-1R/GIPR雙重激動劑,于2022年5月首次獲FDA批準上市,用于治療2型糖尿病;2022年9月,該適應癥上市申請獲得CDE受理。2022年10月,FDA授予了Tirzepatide用于成人肥胖或超重的快速通道指定。SURMOUNT-2是一項多中心、隨機、雙盲、安慰劑對照的III期臨床研究,旨在評估每周1次Tirzepatide(10mg ,15mg)用于肥胖或超重的2型糖尿病成人患者的有效性與安全性。該研究共納入938例受試者,平均基線體重為100.7kg,基線A1C為8.0%。患者按1:1:1接受Tirzepatide 10mg、15mg或安慰劑。共同主要終點為Tirzepatide 10mg和15mg劑量組在第72周時降低體重的百分比效果以及減重5%以上的患者比例。結果顯示,與安慰劑相比,Tirzepatide(10mg和15mg)在治療72周時取得了優于安慰劑的減肥效果。與安慰劑相比,該研究同時滿足共同主要終點和所有關鍵次要終點。與安慰劑(3.3%、3.2kg)相比,10mg組患者體重平均減輕了13.4%(13.5kg),15mg組平均體重減輕了15.7%(15.6kg)。此外,10mg、15mg組分別有81.6%和86.4%的患者減重5%以上,而安慰劑組比例為30.5%,達到了共同主要終點。Tirzepatide還達到了所有關鍵的次要終點,包括降低A1C和其他心臟代謝參數。與安慰劑相比,A1C降幅與成人2型糖尿病患者的SURPASS試驗相似。禮來目前已向FDA滾動提交減重適應癥上市申請,預計明年可完成全部申報文件的提交。該上市申請主要是基于SURMOUNT-1和SURMOUNT-2這兩項研究數據。此外,針對肥胖患者的SURMOUNT-3研究以及維持肥胖患者體重減輕的SURMOUNT-4研究數據預計2023年陸續出爐。針對肥胖的非2型糖尿病患者的SURMOUNT-1研究已于2022年5月完成,結果顯示,Tirzepatide達到了兩個共同主要終點:與安慰劑相比,Tirzepatide組患者體重較基線變化百分比更高,并且Tirzepatide組患者達到體重減輕至少5%的比例更高。具體結果如下:與安慰劑(2.4%,2kg)相比,接受5mg Tirzepatide的受試者體重平均減輕了16.0%,10mg組平均減輕了21.4%,而15mg組平均減輕了22.5%(相當于24kg)。此外,Tirzepatide組分別有89%(5mg)和96%(10mg和15mg)的患者體重減輕了至少5%,而安慰劑組僅有28%患者體重減輕5%。值得注意的是,Tirzepatide每周一次在肥胖或合并體重相關合并癥的超重的非2型糖尿病患者的中國III期SURMOUNT-CN研究已于2023年2月完成,且取得了積極結果,達到主要終點和所有關鍵次要終點,未出現新的安全性信號,具體數據正在整理中。根據禮來2023年第一季度財報數據,Tirzepatide今年Q1收獲了5.68億美元的銷售額。BMO資本市場分析師Evan David Seigerman不久前預測,考慮到2型糖尿病疊加肥胖等適應癥,Tirzepatide峰值銷售額有望達520億美元。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容