
2023-04-25 09:51:14來源:醫藥魔方瀏覽量:286
自2015年以來,國家藥監局推出了一系列的藥品監管改革措施。為了衡量這些改革的影響,復旦大學藥學院教授、上海市藥物研發協同創新中心主任邵黎明團隊研究了2015–2020年間FDA批準的新藥在中國的可及性(數據來源FDA、NMPA以及藥企官網)。這也是對他們之前使用2004–2014年數據進行類似分析(doi:10.1038/nrd.2016.200)的更新。相關文章近期發表在Nature Reviews Drug Discovery上。

2015年至2020年,FDA共批準了200個新分子實體(NME)。同期,62種新藥在中國獲批,其中包括28種NME、17種新生物制品和17種中藥。
在美國批準的200項NME中,截至分析截止日期2022年2月1日,55項(28%)也在中國獲批(時間框架與邵教授團隊之前的分析方法一致)。圖1顯示了美國和中國批準的NME的數量。補充表1和補充表2中提供了在美國和中國批準的所有藥物的清單,包括它們的治療領域以及它們在兩國的提交和批準日期。

圖1 | 2015–2020年間在美國也在中國批準的新藥分析(按治療領域劃分)
在此期間,針對癌癥和傳染病的藥物是在中美兩國都批準的NME中最常見的。值得注意的是,2015–2020年間,FDA批準的53種針對腫瘤適應癥的NME中有21種(40%)在中國獲得批準,而相應在2004–2014年間,58種NME中有14種(24%)獲得批準。這一比例的提高可能是由于NMPA引入了適應癥團隊審查系統,該系統成立于2016年,始于腫瘤學適應癥。中國癌癥患者的大量未滿足需求也加快了中國進口腫瘤藥物的審批。
然而,在其他治療領域很少有FDA批準的NME在中國獲批,而且這個“小比例”與之前在2004–2014年的觀察結果基本一致。不過,2015–2020年,美國FDA在內分泌和代謝治療領域批準的22種NME中,只有3種(14%)在中國獲得批準,而2004–2014年為32%(12/38)。
此外,2015–2020年間美國批準的200項NME中,93項(47%)被批準用于治療罕見病,其中23項也在中國獲批(圖2),總體比例相似(23/55;42%)。
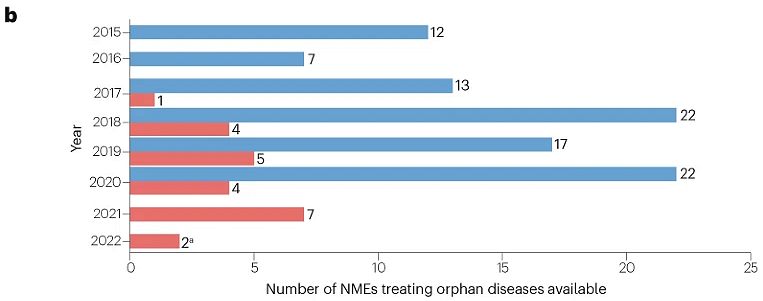
圖2 | 200種NME中,各年在美國和中國批準用于罕見病(獲FDA孤兒藥資格認定 )的數量,中國批準的截止日期為2022年2月1日(藍色為美國,紅色為中國)
對于2015–2020年間獲得FDA以及NMPA批準的NME,中美兩國批準的平均滯后時間為2.2年,短于2004–2014年間觀察到的3年滯后時間(圖3)。滯后時長縮短是由近年來NMPA的批準推動的,2018–2020年的平均滯后時間進一步縮短為1.2年。只有一種創新藥物首先在中國獲得批準:治療慢性特發性便秘的普蘆卡必利(中國早6年批準)。兩種創新藥物幾乎同期在中美獲批:用于治療慢性心力衰竭的伊伐布雷定和用于誘導和維持成人手術鎮靜的瑞馬唑侖(中國晚15天批準)。然而,一些新藥在中國的批準時間比美國晚很多。例如,抗真菌藥物艾沙康唑在美國首次批準約7年后在中國獲得批準,抗癌藥物索立德吉在美國批準6年后在中國獲批。
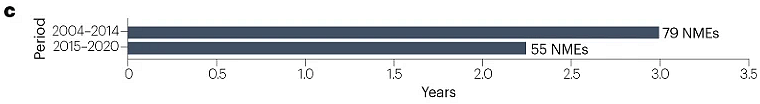
圖3 | 美國和中國NME批準之間的時間滯后
邵教授團隊還計算并比較了從新藥申請(NDA)到每種藥物在美國和中國都獲得批準的持續時間。在中國,大多數新藥從NDA提交到批準平均需要大約1年或更短的時間,這與美國NDA審查時間接近。
國家藥監局自2015年以來的監管改革大大提高了藥品審評和審批過程的透明度和效率。以下附上2015年以來助力加快新藥審批的幾項重大監管改革政策:
為了加快臨床急需的國外新藥的審評和批準,2015年3月,NMPA規定進口藥物可以在中國進行多中心臨床試驗。2017年6月,NMPA加入了人用藥品技術要求國際協調理事會(ICH),并引入了藥物研發和注冊的全球標準(如ICH E5和ICH E17)。
2017年10月,NMPA發布了《關于調整進口藥品注冊管理有關事項的決定》,規定在中國進行國際多中心藥物臨床試驗,允許同步開展I期臨床試驗。一個例子是 Epclusa(索磷布韋+維帕他韋),用于治療成人和3歲及以上兒童的慢性丙型肝炎。Epclusa于2018年5月(FDA批準23個月后)在中國迅速獲得批準,主要基于五項多中心III期試驗。
2018年7月,NMPA發布了《國家藥品監督管理局關于調整藥物臨床試驗審評審批程序的公告》,對臨床試驗申請啟動了60天審批制度,也被稱為臨床試驗默示許可制度。2018年11月正式實施后,IND的平均審批時間從6個月或更長時間穩步下降到60個工作日內。
同樣在2018年7月,NMPA發布了《接受藥品境外臨床試驗數據的技術指導原則》,以加快臨床急需的海外新藥的審批。2018年10月,NMPA與國家衛生健康委員會共同發布了《臨床急需境外新藥審評審批工作程序》。2020年,CDE在3個月的規定時限內完成了所有臨床急需的13種罕見病治療藥物的技術審評,其他26種急需藥物的審評在6個月內完成,減少了進口新藥審批的時間滯后。
最后,2020年7月,NMPA開始實施新修訂的《藥品注冊管理辦法》,進一步優化了審評審批流程,鼓勵制藥公司基于臨床實用性開發新藥。2020年10月,CDE發布了《境外已上市境內未上市藥品臨床技術要求》,列出了3類可以減少或豁免臨床試驗的境外原研藥。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容