包括阿爾茨海默病(AD)在內(nèi)的神經(jīng)系統(tǒng)疾病往往被認(rèn)為“不可治愈”,這是因?yàn)閭鹘y(tǒng)的小分子不能干擾與疾病相關(guān)的蛋白功能。近日,在韓國(guó)慶熙大學(xué)研究團(tuán)隊(duì)開(kāi)展的一項(xiàng)研究中,實(shí)驗(yàn)人員開(kāi)發(fā)了一種專門靶向和降解致病性修飾后翻譯蛋白的新技術(shù),為神經(jīng)系統(tǒng)疾病提供了新的機(jī)會(huì)。基于這種技術(shù)開(kāi)發(fā)的靶向蛋白降解劑(TPD)降解p-p38蛋白。p38蛋白經(jīng)過(guò)翻譯后修飾(PTM)變成磷酸化p-p38,與AD的發(fā)生發(fā)展相關(guān)。該研究發(fā)表在ACS Central Science雜志上。來(lái)源:ACS Central Science目前,針對(duì)TPD的研究已經(jīng)取得初步進(jìn)展,但還沒(méi)有任何一項(xiàng)技術(shù)能夠靶向經(jīng)歷PTM的蛋白。經(jīng)過(guò)進(jìn)一步加工的蛋白變得復(fù)雜,但如果一種TPD工具能夠識(shí)別具有特定PTM的蛋白質(zhì),可能提供一種針對(duì)異常PTM而導(dǎo)致疾病的方法。
p38是人體內(nèi)一種關(guān)鍵蛋白,參與多種信號(hào)通路,與AD的發(fā)生和發(fā)展有關(guān)。此前已有靶向p38來(lái)治療AD的各類嘗試,但是這類藥物臨床試驗(yàn)表現(xiàn)出脫靶效應(yīng)和有限的療法。磷酸化后的p38結(jié)構(gòu)變化,功能激活。通過(guò)追蹤這種蛋白可能提高治療的特異性。因此,研究人員首次嘗試開(kāi)發(fā)靶向p-p38的TPD,試圖為治療AD提供新的思路。
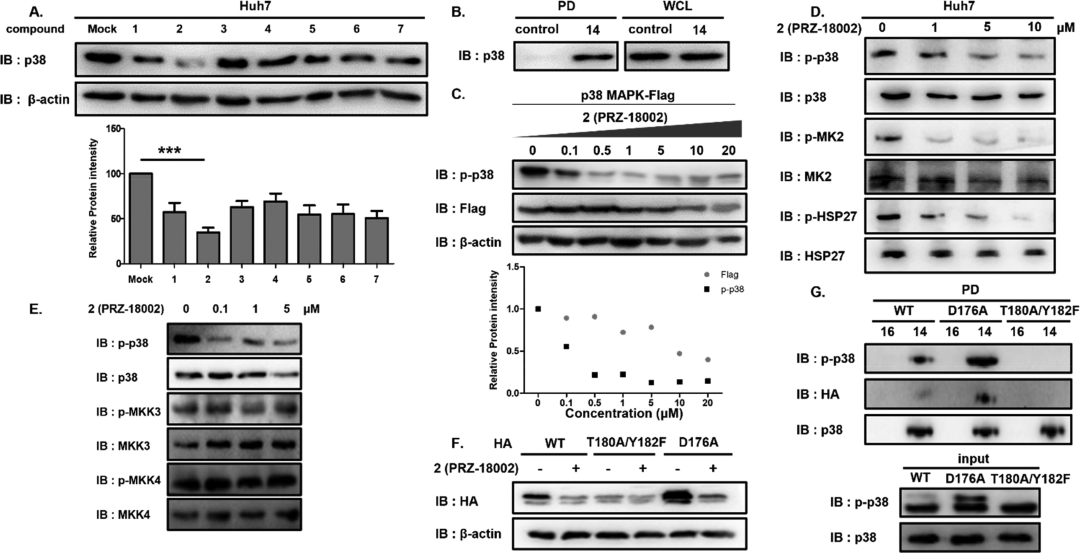
p-p38蛋白降解劑的開(kāi)發(fā)思路(來(lái)源:ACS Central Science)在篩選多種對(duì)p-p38具有特異性的化合物后,團(tuán)隊(duì)最終確定了PRZ-18002為候選化合物,這種結(jié)構(gòu)可選擇性誘導(dǎo)p-p38降解,而不干擾類似蛋白和未發(fā)生磷酸化的p38。p-p38降解的鑒定(來(lái)源:ACS Central Science)小鼠模型中,PRZ-18002處理后的AD模型小鼠中p-p38選擇性降解,促炎信號(hào)通路下調(diào),緩解了AD相關(guān)的神經(jīng)炎癥和病理生理學(xué)特征,如認(rèn)知障礙和Aβ蛋白蓄積。
PRZ-18002的動(dòng)物模型實(shí)驗(yàn)結(jié)果(來(lái)源:ACS Central Science)研究小組說(shuō):“TPD技術(shù)比基因敲除更具優(yōu)勢(shì),因?yàn)檫@種技術(shù)可以誘導(dǎo)病理突變或異常PTM導(dǎo)致的疾病相關(guān)蛋白發(fā)生選擇性降解。這項(xiàng)研究證明了TPD作為藥物發(fā)現(xiàn)中新型治療模式的巨大潛力。”
[1]Seung Hwan Son et al. Protein Kinase (MAPK) as a Novel Approach for the Treatment of Alzheimer′s Disease. ACS Central Science. 2023.[2]https://www.genengnews.com/neurological-disorders/alzheimers/alzheimers-model-mice-treated-using-targeted-protein-degradation/
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺(tái)觀點(diǎn)。如涉及作品內(nèi)容、版權(quán)和其它問(wèn)題,請(qǐng)與本網(wǎng)站留言聯(lián)系,我們將在第一時(shí)間刪除內(nèi)容